Химиотерапия - Chemotherapy
| Химиотерапия | |
|---|---|
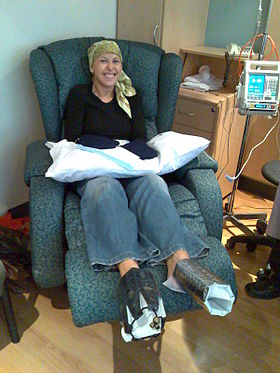 Женщина лечится доцетаксел химиотерапия для рак молочной железы. Холодные рукавицы и холодные пинетки надевают ей на руки и ноги, чтобы не повредить ногти. | |
| Другие имена | химиотерапия, CTX, CTx |
Химиотерапия (часто сокращенно химиотерапия и иногда CTX или же CTx) является разновидностью лечение рака который использует один или несколько противораковых препаратов (химиотерапевтические средства ) как часть стандартизированной режим химиотерапии. Химиотерапия может проводиться с лечебный намерение (которое почти всегда включает комбинацию лекарств), или оно может быть направлено на продление жизни или уменьшить симптомы (паллиативная химиотерапия). Химиотерапия - одна из основных категорий медицинской дисциплины, специально посвященной фармакотерапия за рак, который называется медицинская онкология.[1][2]
Период, термин химиотерапия стал обозначать неспецифическое использование внутриклеточных яды подавлять митоз (деление клетки) или вызвать Повреждение ДНК, поэтому подавление Ремонт ДНК может усилить химиотерапию.[3] Коннотация слова химиотерапия исключает более селективные агенты, которые блокируют внеклеточные сигналы (преобразование сигнала ). Разработка методов лечения со специфическими молекулярными или генетическими мишенями, которые подавляют стимулирующие рост сигналы от классических эндокринных гормонов (прежде всего эстрогены для рака груди и андрогены для рака простаты) теперь называются гормональная терапия. Напротив, другие подавления сигналов роста, подобные тем, которые связаны с рецепторные тирозинкиназы упоминаются как таргетная терапия.
Важно отметить, что использование лекарств (будь то химиотерапия, гормональная терапия или таргетная терапия) составляет системная терапия для рака тем, что они попадают в кровоток и, следовательно, в принципе способны бороться с раком в любом анатомическом месте тела. Системная терапия часто используется в сочетании с другими методами, которые составляют местная терапия (то есть методы лечения, эффективность которых ограничена анатомической областью, в которой они применяются) для рака, такого как радиационная терапия, хирургия или же гипертермическая терапия.
Традиционные химиотерапевтические агенты: цитотоксический посредством вмешательства в деление клеток (митоз), но раковые клетки сильно различаются по своей чувствительности к этим агентам. В значительной степени химиотерапию можно рассматривать как способ повреждения или стресса клеток, что может затем привести к их гибели, если апоптоз инициирован. Многие из побочных эффектов химиотерапии могут быть связаны с повреждением нормальных клеток, которые быстро делятся и поэтому чувствительны к антимитотическим препаратам: клетки в Костный мозг, пищеварительный тракт и волосяные фолликулы. Это приводит к наиболее частым побочным эффектам химиотерапии: миелосупрессия (снижение производства клеток крови, следовательно, также иммуносупрессия ), мукозит (воспаление слизистой оболочки пищеварительного тракта) и алопеция (потеря волос). Из-за воздействия на иммунные клетки (особенно лимфоциты) химиотерапевтические препараты часто находят применение при множестве заболеваний, которые возникают в результате опасной чрезмерной активности иммунной системы по отношению к себе (так называемая аутоиммунитет ). К ним относятся ревматоидный артрит, системная красная волчанка, рассеянный склероз, васкулит и много других.
Стратегии лечения
Сегодня существует ряд стратегий введения химиотерапевтических препаратов. Химиотерапия может проводиться с лечебный намерение или может быть направлено на продление жизни или облегчить симптомы.
- Индукционная химиотерапия - это первая линия лечения рака с помощью химиотерапевтических препаратов. Этот вид химиотерапии используется в лечебных целях.[1][6]:55–59
- Комбинированная химиотерапия - это использование препаратов с другими лечение рака, Такие как хирургия, радиационная терапия, или же гипертермическая терапия.
- Консолидационная химиотерапия назначается после ремиссии, чтобы продлить общее время без болезни и улучшить общую выживаемость. Применяемый препарат такой же, как и препарат, достигший ремиссии.[6]:55–59
- Интенсифицирующая химиотерапия идентична консолидирующей химиотерапии, но используется другой препарат, чем индукционная химиотерапия.[6]:55–59
- Комбинированная химиотерапия предполагает одновременное лечение человека несколькими разными лекарствами. Препараты различаются по механизму и побочным эффектам. Самым большим преимуществом является минимизация шансов развития резистентности к какому-либо одному агенту. Также препараты часто можно использовать в более низких дозах, снижающих токсичность.[6]:55–59[7]:17–18[5]
- Неоадъювант химиотерапия проводится до местного лечения, такого как хирургическое вмешательство, и предназначена для уменьшения первичной опухоли.[6]:55–59 Его также назначают при раке с высоким риском микрометастазирования.[8]:42
- Адъювантная химиотерапия дается после местного лечения (лучевой терапии или хирургического вмешательства). Его можно использовать, когда мало признаков рака, но есть риск рецидива.[6]:55–59 Это также полезно для уничтожения любых раковых клеток, которые распространились на другие части тела. Эти микрометастазы можно лечить адъювантной химиотерапией и может снизить частоту рецидивов, вызванных этими диссеминированными клетками.[9]
- Поддерживающая химиотерапия - это повторное лечение низкими дозами для продления ремиссии.[5][6]:55–59
- Спасательная химиотерапия или паллиативная химиотерапия назначаются без лечебных целей, а просто для уменьшения опухолевой нагрузки и увеличения продолжительности жизни. Для этих схем в целом ожидается лучший профиль токсичности.[6]:55–59
Все схемы химиотерапии требовать, чтобы реципиент мог пройти лечение. Статус производительности часто используется в качестве меры, чтобы определить, может ли человек пройти химиотерапию или требуется снижение дозы. Потому что только часть клеток опухоли погибает при каждом лечении (дробное убийство ), для дальнейшего уменьшения размера опухоли необходимо вводить повторные дозы.[10] В современных режимах химиотерапии медикаментозное лечение применяется циклически, частота и продолжительность лечения ограничиваются токсичностью.[11]
Эффективность
Эффективность химиотерапии зависит от типа и стадии рака. Общая эффективность варьируется от лечения некоторых видов рака, например некоторых лейкемии,[12][13] быть неэффективным, например, в некоторых опухоли головного мозга,[14] быть ненужным в других, как и большинство немеланомный рак кожи.[15]
Дозировка

Дозировка химиотерапии может быть затруднена: слишком низкая доза будет неэффективной против опухоли, тогда как при чрезмерных дозах токсичность (побочные эффекты ) будет невыносимым для человека, получающего его.[4] Стандартный метод определения дозировки химиотерапии основан на расчетных площадь поверхности тела (BSA). BSA обычно рассчитывается с помощью математической формулы или номограмма с использованием веса и роста получателя, а не путем прямого измерения площади тела. Эта формула была первоначально получена в исследовании 1916 года и была попыткой перевести лекарственные дозы, установленные для лабораторных животных, в эквивалентные дозы для людей.[16] В исследование были включены только девять человек.[17] Когда в 1950-х годах была введена химиотерапия, формула BSA была принята в качестве официального стандарта для дозирования химиотерапии из-за отсутствия лучшего варианта.[18][19]
В последнее время ставится под сомнение применимость этого метода для расчета однородных доз. Причина в том, что формула учитывает только вес и рост человека. На абсорбцию и клиренс лекарственного средства влияет множество факторов, включая возраст, пол, метаболизм, болезненное состояние, функцию органов, межлекарственные взаимодействия, генетику и ожирение, которые в значительной степени влияют на фактическую концентрацию лекарственного средства в кровотоке человека. .[18][20][21] В результате существует высокая вариабельность концентрации системного химиотерапевтического препарата у людей, получавших BSA, и было продемонстрировано, что эта вариабельность более чем десятикратна для многих лекарств.[17][22] Другими словами, если два человека получают одинаковую дозу данного лекарства на основе BSA, концентрация этого лекарства в кровотоке одного человека может быть в 10 раз выше или ниже по сравнению с концентрацией другого человека.[22] Эта вариабельность типична для многих химиотерапевтических препаратов, дозируемых BSA, и, как показано ниже, была продемонстрирована в исследовании 14 распространенных химиотерапевтических препаратов.[17]
Результатом такой фармакокинетической изменчивости среди людей является то, что многие люди не получают правильную дозу для достижения оптимальной эффективности лечения с минимальными токсическими побочными эффектами. Некоторые люди получили передозировку, а другие - недостаточную.[18][20][21][23][24][25][26] Например, в рандомизированном клиническом исследовании исследователи обнаружили, что 85% пациентов с метастатическим колоректальным раком, получавших 5-фторурацил (5-FU), не получали оптимальную терапевтическую дозу при дозировании по стандарту BSA - 68% получали недостаточную дозу, а 17% - передозировка.[23]
Существуют разногласия по поводу использования BSA для расчета доз химиотерапии для людей, которые тучный.[27] Из-за более высокого уровня BSA врачи часто произвольно снижают дозу, предписываемую формулой BSA, опасаясь передозировка.[27] Во многих случаях это может привести к неоптимальному лечению.[27]
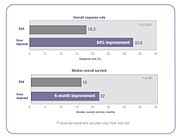
Несколько клинических исследований продемонстрировали, что при индивидуальной подборе доз химиотерапии для достижения оптимального системного воздействия лекарственного средства результаты лечения улучшаются, а токсические побочные эффекты уменьшаются.[23][25] В процитированном выше клиническом исследовании 5-ФУ люди, доза которых была скорректирована для достижения заранее определенной целевой экспозиции, достигли 84% улучшения скорости реакции на лечение и шестимесячного улучшения общей выживаемости (ОВ) по сравнению с теми, кому вводили BSA. .[23]


В том же исследовании исследователи сравнили частоту распространенной токсичности 3/4 степени, связанной с 5-ФУ, у людей с скорректированной дозой и людей, получавших дозу в соответствии с BSA.[23] Частота изнурительной диареи снизилась с 18% в группе, получавшей дозу BSA, до 4% в группе с корректировкой дозы, и были устранены серьезные гематологические побочные эффекты.[23] Из-за пониженной токсичности пациенты с скорректированной дозой могли лечиться в течение более длительных периодов времени.[23] Люди, получавшие BSA, лечились в общей сложности 680 месяцев, в то время как люди в группе с корректировкой дозы лечились в общей сложности 791 месяц.[23] Завершение курса лечения - важный фактор в достижении лучших результатов лечения.
Похожие результаты были получены в исследовании с участием людей с колоректальным раком, которые лечились популярными FOLFOX режим.[25] Частота серьезной диареи снизилась с 12% в группе пациентов, получавших дозу БСА, до 1,7% в группе с корректировкой дозы, а частота тяжелых мукозитов снизилась с 15% до 0,8%.[25]
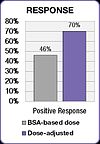
Исследование FOLFOX также продемонстрировало улучшение результатов лечения.[25] Положительный ответ увеличился с 46% в группе, получавшей дозу BSA, до 70% в группе с корректировкой дозы. Медиана выживаемости без прогрессирования (PFS) и общая выживаемость (OS) улучшились на шесть месяцев в группе с корректировкой дозы.[25]
Один из подходов, который может помочь клиницистам индивидуализировать дозировку химиотерапевтических препаратов, - это измерение уровней лекарства в плазме крови с течением времени и корректировка дозы в соответствии с формулой или алгоритмом для достижения оптимального воздействия. При установленном целевом воздействии для оптимизации эффективности лечения с минимальной токсичностью дозировку можно персонализировать для достижения целевого воздействия и оптимальных результатов для каждого человека. Такой алгоритм использовался в упомянутых выше клинических испытаниях и привел к значительному улучшению результатов лечения.
Онкологи уже индивидуализируют дозировку некоторых противораковых препаратов в зависимости от воздействия. Карбоплатин[28]:4 и бусульфан[29][30] дозирование зависит от результатов анализов крови, чтобы рассчитать оптимальную дозу для каждого человека. Также доступны простые анализы крови для оптимизации дозы метотрексат,[31] 5-ФУ, паклитаксел, и доцетаксел.[32][33]
Уровень сывороточного альбумина непосредственно перед назначением химиотерапии является независимым прогностическим показателем выживаемости при различных типах рака.[34]
Типы

Алкилирующие агенты
Алкилирующие агенты - это самая старая группа химиотерапевтических средств, используемых сегодня. Первоначально получено из горчичный газ используется в Первая Мировая Война, в настоящее время используется много типов алкилирующих агентов.[4] Они названы так из-за их способности алкилировать много молекул, в том числе белки, РНК и ДНК. Эта способность связывать ковалентно к ДНК через их алкильная группа является основной причиной их противоракового действия.[36] ДНК состоит из двух цепей, и молекулы могут либо дважды связываться с одной цепью ДНК (внутрицепочечная перекрестная связь), либо могут связываться один раз с обеими цепями (межцепочечная перекрестная связь). Если клетка пытается воспроизвести сшитую ДНК во время деление клеток или пытается его восстановить, нити ДНК могут разорваться. Это приводит к форме запрограммированной гибели клеток, называемой апоптоз.[35][37] Алкилирующие агенты будут работать в любой точке клеточного цикла и поэтому известны как препараты, не зависящие от клеточного цикла. По этой причине действие на клетку зависит от дозы; доля погибающих клеток прямо пропорциональна дозе лекарства.[38]
Подтипы алкилирующих агентов: азотные горчицы, нитрозомочевины, тетразины, азиридины,[39] цисплатины и производные, и неклассические алкилирующие агенты. Азотные горчицы включают мехлорэтамин, циклофосфамид, мелфалан, хлорамбуцил, ифосфамид и бусульфан. Нитрозомочевины включают N-нитрозо-N-метилмочевина (MNU), кармустин (BCNU), ломустин (CCNU) и семустин (MeCCNU), Фотемустин и стрептозотоцин. Тетразины включают дакарбазин, митозоломид и темозоломид. Азиридины включают тиотепа, митомицин и диазиквон (AZQ). Цисплатин и его производные включают: цисплатин, карбоплатин и оксалиплатин.[36][37] Они ухудшают функцию клеток, образуя ковалентные связи с амино-, карбоксил, сульфгидрил, и фосфатные группы в биологически важных молекулах.[40] К неклассическим алкилирующим агентам относятся: прокарбазин и гексаметилмеламин.[36][37]
Антиметаболиты

Антиметаболиты представляют собой группу молекул, которые препятствуют синтезу ДНК и РНК. Многие из них имеют структуру, аналогичную строительным блокам ДНК и РНК. Строительные блоки нуклеотиды; молекула, содержащая азотистое основание, сахар и фосфатная группа. Азотистые основания делятся на пурины (гуанин и аденин ) и пиримидины (цитозин, тимин и урацил ). Антиметаболиты напоминают азотистые основания или нуклеозиды (нуклеотид без фосфатной группы), но изменились. химические группы.[41] Эти препараты оказывают свое действие, либо блокируя ферменты, необходимые для синтеза ДНК, либо встраиваясь в ДНК или РНК. Подавляя ферменты, участвующие в синтезе ДНК, они предотвращают митоз, потому что ДНК не может дублировать себя. Кроме того, после неправильного включения молекул в ДНК, Повреждение ДНК может произойти и запрограммированная гибель клеток (апоптоз ) индуцировано. В отличие от алкилирующих агентов антиметаболиты зависят от клеточного цикла. Это означает, что они работают только в течение определенной части клеточного цикла, в данном случае S-фаза (фаза синтеза ДНК). По этой причине при определенной дозе эффект плато и пропорционально прекращение гибели клеток при увеличении доз. Подтипы антиметаболитов: антифолаты, фторпиримидины, аналоги дезоксинуклеозидов и тиопурины.[36][41]
Антифолаты включают метотрексат и пеметрексед. Метотрексат подавляет дигидрофолатредуктаза (DHFR), фермент, регенерирующий тетрагидрофолат из дигидрофолат. Когда фермент ингибируется метотрексатом, клеточные уровни коферментов фолиевой кислоты снижаются. Они необходимы для тимидилат и производство пуринов, которые необходимы как для синтеза ДНК, так и для деления клеток.[6]:55–59[7]:11 Пеметрексед - еще один антиметаболит, который влияет на выработку пурина и пиримидина и, следовательно, также подавляет синтез ДНК. Он в первую очередь подавляет фермент тимидилатсинтаза, но также оказывает влияние на DHFR, аминоимидазолкарбоксамид рибонуклеотид формилтрансферазу и глицинамид рибонуклеотид формилтрансфераза.[42] Фторпиримидины включают фторурацил и капецитабин. Фторурацил представляет собой аналог азотистых оснований, который метаболизируется в клетках с образованием по крайней мере двух активных продуктов; Монофосфат 5-фторууридина (FUMP) и 5-фтор-2'-дезоксиуридин 5'-фосфат (fdUMP). FUMP включается в РНК, а fdUMP ингибирует фермент тимидилатсинтазу; оба из которых приводят к гибели клеток.[7]:11 Капецитабин - это пролекарство 5-фторурацила, который расщепляется в клетках с образованием активного лекарства.[43] Аналоги дезоксинуклеозидов включают: цитарабин, гемцитабин, децитабин, азацитидин, флударабин, неларабин, кладрибин, клофарабин, и пентостатин. Тиопурины включают тиогуанин и меркаптопурин.[36][41]
Антимикротрубочковые агенты

Антимикротрубочковые агенты находятся растение -производные химические вещества, которые блокируют деление клеток, предотвращая микротрубочка функция. Микротрубочки - важная клеточная структура, состоящая из двух белков, α-тубулин и β-тубулин. Это полые стержневидные структуры, необходимые для деления клеток, помимо других клеточных функций.[44] Микротрубочки - это динамические структуры, что означает, что они постоянно находятся в состоянии сборки и разборки. Винча алкалоиды и таксаны представляют собой две основные группы антимикротрубочковых агентов, и хотя обе эти группы препаратов вызывают дисфункцию микротрубочек, их механизмы действия полностью противоположны: Винча алкалоиды препятствуют сборке микротрубочек, тогда как таксаны препятствуют их разборке. Тем самым они предотвращают завершение митоза раковых клеток. После этого происходит остановка клеточного цикла, которая вызывает запрограммированную гибель клеток (апоптоз ).[36][45] Эти препараты также могут влиять на рост кровеносных сосудов, важный процесс, который опухоль использует для роста и метастазирования.[45]
Винча алкалоиды происходят из Мадагаскарский барвинок, Катарантус розовый,[46][47] ранее известный как Винча розовая. Они связываются со специфическими участками тубулина, подавляя сборку тубулина в микротрубочки. Оригинал барвинок алкалоиды натуральные продукты которые включают винкристин и винбластин.[48][49][50][51] После успеха этих препаратов полусинтетические барвинок алкалоиды были произведены: винорелбин (используется при лечении немелкоклеточный рак легкого[50][52][53]), виндезин, и винфлунин.[45] Эти препараты клеточный цикл -специфический. Они связываются с молекулами тубулина в S-фаза и предотвратить правильное образование микротрубочек, необходимых для M-фаза.[38]
Таксаны - это натуральные и полусинтетические препараты. Первый препарат в своем классе, паклитаксел, изначально был извлечен из Taxus brevifolia, Тихоокеанский тис. Теперь этот препарат и еще один в этом классе, доцетаксел, производятся полусинтетически из химического вещества, содержащегося в коре другого тиса, Taxus baccata.
Подофиллотоксин является противоопухолевым лигнан получен в основном из Американский майяблок (Podophyllum peltatum) и Гималайский майяблок (Sinopodophyllum hexandrum). Он обладает антимикротрубочковой активностью, и его механизм аналогичен механизму барвинок алкалоиды в том, что они связываются с тубулином, ингибируя образование микротрубочек. Подофиллотоксин используется для производства двух других препаратов с разными механизмами действия: этопозид и тенипозид.[54][55]
Ингибиторы топоизомеразы

Ингибиторы топоизомеразы - это препараты, влияющие на активность двух ферментов: топоизомераза I и топоизомераза II. Когда двухцепочечная спираль ДНК разматывается, во время репликации ДНК или транскрипция например, прилегающая неоткрытая ДНК наматывается сильнее (суперспирали), как открытая середина скрученной веревки. Стрессу, вызванному этим эффектом, частично способствуют ферменты топоизомеразы. Они производят одно- или двухцепочечные разрывы в ДНК, уменьшая натяжение в цепи ДНК. Это позволяет нормальному раскручиванию ДНК происходить во время репликация или транскрипция. Ингибирование топоизомеразы I или II мешает обоим этим процессам.[56][57]
Два ингибитора топоизомеразы I, иринотекан и топотекан, полусинтетически получены из камптотецин, который получают из китайского декоративного дерева Camptotheca acuminata.[38] Лекарства, нацеленные на топоизомеразу II, можно разделить на две группы. Яды топоизомеразы II вызывают повышенный уровень ферментов, связанных с ДНК. Это предотвращает репликацию ДНК и транскрипция, вызывает разрывы цепи ДНК и приводит к запрограммированной гибели клеток (апоптоз ). Эти агенты включают этопозид, доксорубицин, митоксантрон и тенипозид. Вторая группа, каталитические ингибиторы, - это препараты, которые блокируют активность топоизомеразы II и, следовательно, предотвращают синтез и трансляцию ДНК, поскольку ДНК не может раскручиваться должным образом. В эту группу входят новобиоцин, мербароне и акларубицин, которые также имеют другие важные механизмы действия.[58]
Цитотоксические антибиотики
Цитотоксический антибиотики представляют собой разнообразную группу препаратов, которые имеют различные механизмы действия. Общая тема, которую они разделяют в показаниях к химиотерапии, заключается в том, что они прерывают деление клеток. Самая важная подгруппа - это антрациклины и блеомицины; другие известные примеры включают митомицин С и актиномицин.[59]
Среди антрациклинов, доксорубицин и даунорубицин были первыми и были получены от бактерия Streptomyces peucetius.[60] Производные этих соединений включают: эпирубицин и идарубицин. Другими клинически используемыми препаратами из группы антрациклинов являются: пирарубицин, акларубицин, и митоксантрон.[61] Механизмы антрациклинов включают: Интеркаляция ДНК (молекулы вставляются между двумя цепями ДНК), образование высокореактивных свободные радикалы которые повреждают межклеточные молекулы и ингибируют топоизомеразу.[62]
Актиномицин - сложная молекула, которая интеркалирует ДНК и предотвращает Синтез РНК.[63]
Блеомицин, а гликопептид изолирован от Streptomyces verticillus, также интеркалирует ДНК, но производит свободные радикалы которые повреждают ДНК. Это происходит, когда блеомицин связывается с ион металла, становится химически восстановленный и реагирует с кислород.[64][6]:87
Митомицин - цитотоксический антибиотик, способный алкилировать ДНК.[65]
Доставка

Большая часть химиотерапии доставлен внутривенно, хотя ряд агентов можно вводить перорально (например, мелфалан, бусульфан, капецитабин ). Согласно недавнему систематическому обзору (2016 г.), пероральные методы лечения создают дополнительные проблемы для пациентов и медицинских бригад в плане сохранения и поддержки соблюдения планов лечения.[66]
Существует множество внутривенных методов доставки лекарств, известных как устройства для сосудистого доступа. К ним относятся крылатое инфузионное устройство, периферический венозный катетер, катетер средней линии, периферически введенный центральный катетер (PICC), центральный венозный катетер и имплантируемый порт. Устройства имеют различное применение в зависимости от продолжительности химиотерапевтического лечения, способа доставки и типов химиотерапевтического агента.[7]:94–95
В зависимости от человека, рака, стадии рака, типа химиотерапии и дозировки внутривенная химиотерапия может быть назначена либо стационарный или амбулаторный основание. Для непрерывного, частого или длительного внутривенного введения химиотерапии различные системы могут быть введены хирургическим путем в сосудистую сеть для обеспечения доступа.[7]:113–118 Обычно используемые системы - это Линия Хикмана, то Port-a-Cath, а Линия PICC. Они имеют более низкий риск заражения и гораздо менее подвержены флебит или же экстравазация, и устраняют необходимость повторного введения периферических канюль.[нужна цитата ]
Изолированная перфузия конечностей (часто используется в меланома ),[67] или изолированное введение химиотерапии в печень[68] или легкое использовалось для лечения некоторых опухолей. Основная цель этих подходов - доставить очень высокую дозу химиотерапии к участкам опухоли, не вызывая серьезного системного повреждения.[69] Эти подходы могут помочь контролировать одиночные или ограниченные метастазы, но они по определению не являются системными и, следовательно, не лечат распределенные метастазы или микрометастазы.
Местные химиотерапевтические препараты, такие как 5-фторурацил, используются для лечения некоторых случаев немеланомный рак кожи.[70]
Если у рака Центральная нервная система вовлечение или с менингеальным заболеванием, интратекальный может быть назначена химиотерапия.[4]
Побочные эффекты
Химиотерапевтические методы имеют ряд побочных эффектов, которые зависят от типа используемых лекарств. Наиболее распространенные лекарства влияют в основном на быстро делящиеся клетки тела, например, клетки крови и клетки ротовой полости, желудка и кишечника. Связанные с химиотерапией токсические эффекты могут возникать остро после приема в течение нескольких часов или дней или хронически, от недель до лет.[6]:265
Иммуносупрессия и миелосупрессия
Практически все химиотерапевтические схемы могут вызывать угнетение иммунная система, часто парализуя Костный мозг и приводит к уменьшению белые кровяные клетки, красные кровяные тельца, и тромбоциты.Анемия и тромбоцитопения может потребоваться переливание крови. Нейтропения (уменьшение нейтрофильный гранулоцит считать меньше 0,5 х 109/литр ) можно улучшить синтетическим G-CSF (гранулоцит -колониестимулирующий фактор, например, филграстим, ленограстим ).
В очень тяжелом миелосупрессия, что встречается при некоторых схемах, почти весь костный мозг стволовые клетки (клетки, производящие белый и красные кровяные тельца ) уничтожаются, то есть аллогенный или же аутологичный трансплантация клеток костного мозга необходимы. (В аутологичных BMT клетки удаляются из организма человека до лечения, размножаются и затем повторно вводятся; в аллогенный BMT, источник - донор.) Однако у некоторых людей все еще развиваются заболевания из-за этого вмешательства в костный мозг.[нужна цитата ]
Хотя людям, получающим химиотерапию, рекомендуется мыть руки, избегать больных и принимать другие меры по снижению инфекций, около 85% инфекций вызваны естественными микроорганизмами, встречающимися в организме человека. желудочно-кишечный тракт (включая ротовая полость ) и скин.[71]:130 Это может проявляться в виде системных инфекций, таких как: сепсис, или как локальные вспышки, такие как Простой герпес, опоясывающий лишай, или другие члены Герпесвириды.[72] Риск болезни и смерти можно снизить, если принимать обычные антибиотики, такие как хинолоны или же триметоприм / сульфаметоксазол до того, как появится температура или признаки инфекции.[73] Хинолоны показывают эффективную профилактику в основном при гематологическом раке.[73] Однако в целом на каждые пять человек с ослабленным иммунитетом после химиотерапии, принимающих антибиотики, можно предотвратить повышение температуры тела; на каждые 34 человека, принимающих антибиотик, можно предотвратить одну смерть.[73] Иногда лечение химиотерапией откладывается, потому что иммунная система подавлена до критически низкого уровня.
В Япония, правительство одобрило использование некоторых лекарственные грибы подобно Trametes versicolor, чтобы противодействовать угнетению иммунной системы у людей, проходящих химиотерапию.[74]
Нейтропенический энтероколит
Из-за подавления иммунной системы, нейтропенический энтероколит (тифлит) - это «опасное для жизни желудочно-кишечное осложнение химиотерапии».[75] Тифлит кишечная инфекция, которая может проявляться симптомами, включая тошнота, рвота, понос, а вздутый живот, высокая температура, озноб, или же боль в животе и нежность.
Тифлит это неотложная медицинская помощь. У него очень плохой прогноз и часто приводит к летальному исходу, если его вовремя не распознать и не лечить агрессивно.[76] Успешное лечение зависит от ранней диагностики, обеспечиваемой высоким показателем подозрительности и использования компьютерной томографии, безоперационного лечения неосложненных случаев, а иногда и избирательного права гемиколэктомия чтобы предотвратить повторение.[76]
Желудочно-кишечные расстройства
Тошнота, рвота, анорексия, понос, спазмы в животе и запор являются распространенными побочными эффектами химиотерапевтических препаратов, убивающих быстро делящиеся клетки.[77] Недоедание и обезвоживание может возникнуть, когда реципиент не ест или не пьет достаточно, или когда человека часто рвет из-за повреждения желудочно-кишечного тракта. Это может привести к быстрой потере веса или, иногда, к увеличению веса, если человек ест слишком много, чтобы ослабить тошноту или изжогу. Увеличение веса также может быть вызвано приемом некоторых стероидных препаратов. Эти побочные эффекты часто можно уменьшить или устранить с помощью противорвотное средство наркотики. Доказательства с низкой степенью достоверности также предполагают, что пробиотики могут иметь профилактический и лечебный эффект от диареи, связанный только с химиотерапией и с лучевой терапией.[78] Однако высокий показатель подозрения уместно, так как понос и вздутие живота также являются симптомами тифлит, очень серьезное и потенциально опасное для жизни неотложная медицинская помощь что требует немедленного лечения.
Анемия
Анемия может быть комбинированным результатом, вызванным миелосупрессивной химиотерапией, и возможными причинами, связанными с раком, такими как кровотечение, кровяная клетка разрушение (гемолиз ), наследственное заболевание, дисфункция почек, недостаточность питания или анемия хронического заболевания. Лечения для смягчения анемии включают гормоны для увеличения производства крови (эритропоэтин ), добавки железа, и переливание крови.[79][80][81] Миелосупрессивная терапия может вызвать склонность к легкому кровотечению, что приводит к анемии. Лекарства, которые убивают быстро делящиеся клетки или клетки крови, могут уменьшить количество тромбоциты в крови, что может привести к синяки и кровотечение. Чрезвычайно низкое количество тромбоцитов может быть временно увеличено за счет переливание тромбоцитов разрабатываются новые препараты для увеличения количества тромбоцитов во время химиотерапии.[82][83][84][85] Иногда химиотерапевтическое лечение откладывается, чтобы позволить восстановить количество тромбоцитов.
Усталость может быть следствием рака или его лечения и может длиться от месяцев до лет после лечения. Одна из физиологических причин усталости: анемия, что может быть вызвано химиотерапией, хирургия, лучевая терапия, первичное и метастатическое заболевание или истощение питательных веществ.[86][87] Упражнение аэробики было обнаружено, что он помогает снизить утомляемость у людей с солидные опухоли.[88]
Тошнота и рвота
Тошнота и рвота являются двумя наиболее опасными побочными эффектами, связанными с лечением рака, для людей, больных раком, и их семей. В 1983 году Коутс и др. обнаружили, что люди, получающие химиотерапию, относят тошноту и рвоту к первым и вторым наиболее серьезным побочным эффектам соответственно. До 20% людей, получавших высокоэметогенные препараты в эту эпоху, откладывали или даже отказывались от потенциально лечебного лечения.[89] Тошнота и рвота, вызванные химиотерапией (CINV), характерны для многих видов лечения и некоторых форм рака. С 1990-х годов появилось несколько новых классов противорвотные средства были разработаны и коммерциализированы, став почти универсальным стандартом в схемах химиотерапии и помогая успешно управлять этими симптомами у многих людей. Эффективное посредничество этих неприятных и иногда парализующих симптомов приводит к повышению качества жизни реципиента и более эффективным циклам лечения из-за меньшего количества остановок лечения из-за лучшей переносимости и улучшения общего состояния здоровья.
Потеря волос
Потеря волос (алопеция) может быть вызвана химиотерапией, которая убивает быстро делящиеся клетки; другие лекарства могут вызвать истончение волос. Чаще всего это временные эффекты: волосы обычно начинают отрастать через несколько недель после последней процедуры, но иногда с изменением цвета, текстуры, толщины или стиля. Иногда волосы имеют тенденцию к завиванию после отрастания, что приводит к «завиткам после химиотерапии». Сильная потеря волос чаще всего возникает при приеме таких препаратов, как доксорубицин, даунорубицин, паклитаксел, доцетаксел, циклофосфамид, ифосфамид и этопозид. Постоянное истончение или выпадение волос может быть следствием некоторых стандартных схем химиотерапии.
Выпадение волос, вызванное химиотерапией, происходит по неандрогенному механизму и может проявляться как тотальная алопеция, телогеновый отток или реже очаговая алопеция.[90] Обычно это связано с системным лечением из-за высокой скорости митоза волосяных фолликулов и более обратимо, чем андрогенное выпадение волос.[91][92] хотя постоянные случаи могут иметь место.[93] Химиотерапия вызывает выпадение волос у женщин чаще, чем у мужчин.[94]
Охлаждение кожи головы предлагает средства предотвращения как постоянного, так и временного выпадения волос; однако были высказаны опасения по поводу этого метода.[95][96]
Вторичное новообразование
После успешной химиотерапии или лучевой терапии может произойти развитие вторичной неоплазии. Самый распространенный вторичное новообразование вторичный острый миелоидный лейкоз, который развивается в основном после лечения алкилирующими агентами или ингибиторами топоизомеразы.[97] Выжившие детский рак более чем в 13 раз чаще получают вторичное новообразование в течение 30 лет после лечения, чем население в целом.[98] Не все это увеличение можно отнести к химиотерапии.
Бесплодие
Некоторые виды химиотерапии гонадотоксичны и могут вызывать бесплодие.[99] Химиотерапия с высоким риском включает прокарбазин и другие алкилирующие препараты, такие как циклофосфамид, ифосфамид, бусульфан, мелфалан, хлорамбуцил и хлорметин.[99] Лекарства со средним риском включают доксорубицин и аналоги платины, такие как цисплатин и карбоплатин.[99] С другой стороны, терапии с низким риском гонадотоксичности включают производные растений, такие как винкристин и винбластин, антибиотики такие как блеомицин и дактиномицин, и антиметаболиты, такие как метотрексат, меркаптопурин и 5-фторурацил.[99]
Женское бесплодие химиотерапией оказывается вторичным по отношению к преждевременная недостаточность яичников потерей примордиальные фолликулы.[100] Эта потеря не обязательно является прямым эффектом химиотерапевтических агентов, но может быть связана с повышенной скоростью инициации роста для замещения поврежденных развивающихся фолликулов.[100]
Люди могут выбирать между несколькими методами сохранение плодородия до химиотерапии, в том числе криоконсервация спермы, ткани яичника, ооцитов или эмбрионов.[101] As more than half of cancer patients are elderly, this adverse effect is only relevant for a minority of patients. A study in France between 1999 and 2011 came to the result that embryo freezing before administration of gonadotoxic agents to females caused a delay of treatment in 34% of cases, and a live birth in 27% of surviving cases who wanted to become pregnant, with the follow-up time varying between 1 and 13 years.[102]
Potential protective or attenuating agents include GnRH analogs, where several studies have shown a protective effect in vivo in humans, but some studies show no such effect. Сфингозин-1-фосфат (S1P) has shown similar effect, but its mechanism of inhibiting the sphingomyelin apoptotic pathway may also interfere with the апоптоз action of chemotherapy drugs.[103]
In chemotherapy as a conditioning regimen in hematopoietic stem cell transplantation, a study of people conditioned with cyclophosphamide alone for severe aplastic anemia came to the result that ovarian recovery occurred in all women younger than 26 years at time of transplantation, but only in five of 16 women older than 26 years.[104]
Тератогенность
Chemotherapy is тератогенный в течение беременность, особенно во время первый триместр, to the extent that аборт usually is recommended if pregnancy in this period is found during chemotherapy.[105] Second- and third-trimester exposure does not usually increase the teratogenic risk and adverse effects on cognitive development, but it may increase the risk of various осложнения беременности and fetal myelosuppression.[105]
In males previously having undergone chemotherapy or radiotherapy, there appears to be no increase in genetic defects or congenital malformations in their children conceived after therapy.[105] Использование вспомогательные репродуктивные технологии и micromanipulation techniques might increase this risk.[105] In females previously having undergone chemotherapy, miscarriage and congenital malformations are not increased in subsequent conceptions.[105] Однако когда экстракорпоральное оплодотворение и embryo cryopreservation is practised between or shortly after treatment, possible genetic risks to the growing oocytes exist, and hence it has been recommended that the babies be screened.[105]
Периферическая невропатия
Between 30 and 40 percent of people undergoing chemotherapy experience chemotherapy-induced peripheral neuropathy (CIPN), a progressive, enduring, and often irreversible condition, causing pain, tingling, numbness and sensitivity to cold, beginning in the hands and feet and sometimes progressing to the arms and legs.[106] Химиотерапевтические препараты, связанные с CIPN, включают: талидомид, эпотилоны, vinca alkaloids, taxanes, ингибиторы протеасом, and the platinum-based drugs.[106][107] Whether CIPN arises, and to what degree, is determined by the choice of drug, duration of use, the total amount consumed and whether the person already has периферическая невропатия. Though the symptoms are mainly sensory, in some cases двигательные нервы и автономная нервная система are affected.[108] CIPN often follows the first chemotherapy dose and increases in severity as treatment continues, but this progression usually levels off at completion of treatment. The platinum-based drugs are the exception; with these drugs, sensation may continue to deteriorate for several months after the end of treatment.[109] Some CIPN appears to be irreversible.[109] Pain can often be managed with drug or other treatment but the numbness is usually resistant to treatment.[110]
Cognitive impairment
Some people receiving chemotherapy report fatigue or non-specific neurocognitive problems, such as an inability to concentrate; this is sometimes called post-chemotherapy cognitive impairment, referred to as "chemo brain" in popular and social media.[111]
Tumor lysis syndrome
In particularly large tumors and cancers with high white cell counts, Такие как лимфомы, тератомы, и немного лейкемии, some people develop tumor lysis syndrome. The rapid breakdown of cancer cells causes the release of chemicals from the inside of the cells. Following this, high levels of мочевая кислота, калий и фосфат are found in the blood. High levels of phosphate induce secondary hypoparathyroidism, resulting in low levels of calcium in the blood. This causes kidney damage and the high levels of potassium can cause аритмия сердца. Although prophylaxis is available and is often initiated in people with large tumors, this is a dangerous side-effect that can lead to death if left untreated.[7]:202
Organ damage
Кардиотоксичность (heart damage) is especially prominent with the use of антрациклин drugs (доксорубицин, эпирубицин, idarubicin, и liposomal doxorubicin ). The cause of this is most likely due to the production of свободные радикалы in the cell and subsequent Повреждение ДНК. Other chemotherapeutic agents that cause cardiotoxicity, but at a lower incidence, are циклофосфамид, docetaxel и clofarabine.[112]
Гепатотоксичность (liver damage) can be caused by many cytotoxic drugs. The susceptibility of an individual to liver damage can be altered by other factors such as the cancer itself, viral hepatitis, иммуносупрессия и nutritional deficiency. The liver damage can consist of damage to liver cells, hepatic sinusoidal syndrome (obstruction of the veins in the liver), холестаз (where bile does not flow from the liver to the intestine) and liver fibrosis.[113][114]
Нефротоксичность (kidney damage) can be caused by tumor lysis syndrome and also due direct effects of drug clearance by the kidneys. Different drugs will affect different parts of the kidney and the toxicity may be бессимптомный (only seen on blood or urine tests) or may cause острая травма почек.[115][116]
Ототоксичность (damage to the inner ear) is a common side effect of platinum based drugs that can produce symptoms such as dizziness and головокружение.[117][118] Children treated with platinum analogues have been found to be at risk for developing hearing loss.[119][120][121]
Other side-effects
Less common side-effects include red skin (эритема ), dry skin, damaged fingernails, a dry mouth (ксеростомия ), water retention, и sexual impotence. Some medications can trigger аллергический или же pseudoallergic реакции.
Specific chemotherapeutic agents are associated with organ-specific toxicities, including сердечно-сосудистые заболевания (например., доксорубицин ), интерстициальное заболевание легких (например., блеомицин ) и иногда secondary neoplasm (например., MOPP therapy for Hodgkin's disease).
Hand-foot syndrome is another side effect to cytotoxic chemotherapy.
Nutritional problems are also frequently seen in cancer patients at diagnosis and through chemotherapy treatment. Research suggests that in children and young people undergoing cancer treatment, parenteral nutrition may help with this leading to weight gain and increased calorie and protein intake, when compared to enteral nutrition.[122]
Ограничения
Chemotherapy does not always work, and even when it is useful, it may not completely destroy the cancer. People frequently fail to understand its limitations. In one study of people who had been newly diagnosed with incurable, рак 4 стадии, more than two-thirds of people with lung cancer and more than four-fifths of people with colorectal cancer still believed that chemotherapy was likely to cure their cancer.[123]
В гематоэнцефалический барьер poses an obstacle to delivery of chemotherapy to the мозг. This is because the brain has an extensive system in place to protect it from harmful chemicals. Drug transporters can pump out drugs from the brain and brain's blood vessel cells into the спинномозговая жидкость and blood circulation. These transporters pump out most chemotherapy drugs, which reduces their efficacy for treatment of brain tumors. Only small липофильный alkylating agents Такие как ломустин или же темозоломид are able to cross this blood–brain barrier.[124][125][126]
Кровеносный сосуд in tumors are very different from those seen in normal tissues. As a tumor grows, tumor cells furthest away from the blood vessels become low in oxygen (гипоксический ). To counteract this they then signal for new blood vessels to grow. The newly formed tumor vasculature is poorly formed and does not deliver an adequate blood supply to all areas of the tumor. This leads to issues with drug delivery because many drugs will be delivered to the tumor by the сердечно-сосудистая система.[127]
Сопротивление
Сопротивление is a major cause of treatment failure in chemotherapeutic drugs. There are a few possible causes of resistance in cancer, one of which is the presence of small pumps on the surface of cancer cells that actively move chemotherapy from inside the cell to the outside. Cancer cells produce high amounts of these pumps, known as р-гликопротеин, in order to protect themselves from chemotherapeutics. Исследования по р-гликопротеин and other such chemotherapy efflux pumps is currently ongoing. Medications to inhibit the function of р-гликопротеин are undergoing investigation, but due to toxicities and interactions with anti-cancer drugs their development has been difficult.[128][129] Another mechanism of resistance is амплификация гена, a process in which multiple copies of a gene are produced by cancer cells. This overcomes the effect of drugs that reduce the expression of genes involved in replication. With more copies of the gene, the drug can not prevent all expression of the gene and therefore the cell can restore its proliferative ability. Cancer cells can also cause defects in the cellular pathways of апоптоз (programmed cell death). As most chemotherapy drugs kill cancer cells in this manner, defective apoptosis allows survival of these cells, making them resistant. Many chemotherapy drugs also cause DNA damage, which can be repaired by ферменты in the cell that carry out Ремонт ДНК. Upregulation of these genes can overcome the DNA damage and prevent the induction of apoptosis. Mutations in genes that produce drug target proteins, such as тубулин, can occur which prevent the drugs from binding to the protein, leading to resistance to these types of drugs.[130] Drugs used in chemotherapy can induce cell stress, which can kill a cancer cell; however, under certain conditions, cells stress can induce changes in gene expression that enables resistance to several types of drugs.[131] В рак легких, the transcription factor NFκB is thought to play a role in resistance to chemotherapy, via inflammatory pathways.[132][133][134]
Cytotoxics and targeted therapies
Targeted therapies are a relatively new class of cancer drugs that can overcome many of the issues seen with the use of cytotoxics. They are divided into two groups: small molecule and antibodies. The massive toxicity seen with the use of cytotoxics is due to the lack of cell specificity of the drugs. They will kill any rapidly dividing cell, tumor or normal. Targeted therapies are designed to affect cellular proteins or processes that are utilised by the cancer cells. This allows a high dose to cancer tissues with a relatively low dose to other tissues. Хотя побочные эффекты are often less severe than that seen of cytotoxic chemotherapeutics, life-threatening effects can occur. Initially, the targeted therapeutics were supposed to be solely selective for one protein. Now it is clear that there is often a range of protein targets that the drug can bind. An example target for targeted therapy is the BCR-ABL1 protein produced from the Филадельфийская хромосома, a genetic lesion found commonly in хронический миелолейкоз and in some patients with acute lymphoblastic leukemia. Этот гибридный белок has enzyme activity that can be inhibited by иматиниб, а малая молекула препарат, средство, медикамент.[135][136][137][138]
Mechanism of action

Рак is the uncontrolled growth of клетки coupled with злокачественный behaviour: invasion and метастаз (among other features).[139] It is caused by the interaction between генетический susceptibility and environmental factors.[140][141] These factors lead to accumulations of генетические мутации в oncogenes (genes that control the growth rate of cells) and tumor suppressor genes (genes that help to prevent cancer), which gives cancer cells their malignant characteristics, such as uncontrolled growth.[142]:93–94
In the broad sense, most chemotherapeutic drugs work by impairing митоз (деление клеток ), effectively targeting fast-dividing cells. As these drugs cause damage to cells, they are termed цитотоксический. They prevent mitosis by various mechanisms including damaging DNA and inhibition of the cellular machinery involved in cell division.[38][143] One theory as to why these drugs kill cancer cells is that they induce a programmed form of cell death known as апоптоз.[144]
As chemotherapy affects cell division, tumors with high темпы роста (Такие как acute myelogenous leukemia and the aggressive лимфомы, включая Hodgkin's disease ) are more sensitive to chemotherapy, as a larger proportion of the targeted cells are undergoing деление клеток в любое время. Malignancies with slower growth rates, such as indolent lymphomas, tend to respond to chemotherapy much more modestly.[4] Heterogeneic tumours may also display varying sensitivities to chemotherapy agents, depending on the subclonal populations within the tumor.
Cells from the иммунная система also make crucial contributions to the antitumor effects of chemotherapy.[145] For example, the chemotherapeutic drugs оксалиплатин и циклофосфамид can cause tumor cells to die in a way that is detectable by the immune system (called immunogenic cell death ), which mobilizes immune cells with antitumor functions.[146] Chemotherapeutic drugs that cause cancer immunogenic tumor cell death can make unresponsive tumors sensitive to иммунный контрольно-пропускной пункт терапия.[147]
Другое использование
Some chemotherapy drugs are used in diseases other than cancer, such as in autoimmune disorders,[148] and noncancerous plasma cell dyscrasia. In some cases they are often used at lower doses, which means that the side effects are minimized,[148] while in other cases doses similar to ones used to treat cancer are used. Метотрексат используется при лечении ревматоидный артрит (РА),[149] псориаз,[150] анкилозирующий спондилоартрит[151] и рассеянный склероз.[152][153] The anti-inflammatory response seen in RA is thought to be due to increases in аденозин, что приводит к иммуносупрессия; effects on immuno-regulatory циклооксигеназа -2 enzyme pathways; reduction in pro-inflammatory цитокины; and anti-proliferative properties.[149] Although methotrexate is used to treat both multiple sclerosis and ankylosing spondylitis, its efficacy in these diseases is still uncertain.[151][152][153] Циклофосфамид is sometimes used to treat волчаночный нефрит, a common symptom of системная красная волчанка.[154] Дексаметазон along with either бортезомиб или же melphalan is commonly used as a treatment for AL амилоидоз. Recently, bortezomid in combination with циклофосфамид and dexamethasone has also shown promise as a treatment for AL amyloidosis. Other drugs used to treat миелома Такие как леналидомид have shown promise in treating AL amyloidosis.[155]
Chemotherapy drugs are also used in conditioning regimens prior to bone marrow transplant (hematopoietic stem cell transplant ). Conditioning regimens are used to suppress the recipient's immune system in order to allow a transplant to engraft. Cyclophosphamide is a common cytotoxic drug used in this manner, and is often used in conjunction with облучение всего тела. Chemotherapeutic drugs may be used at high doses to permanently remove the recipient's bone marrow cells (myeloablative conditioning) or at lower doses that will prevent permanent bone marrow loss (non-myeloablative and reduced intensity conditioning).[156] When used in non-cancer setting, the treatment is still called "chemotherapy", and is often done in the same treatment centers used for people with cancer.
Occupational exposure and safe handling
In the 1970s, antineoplastic (chemotherapy) drugs were identified as hazardous, and the Американское общество фармацевтов систем здравоохранения (ASHP) has since then introduced the concept of hazardous drugs after publishing a recommendation in 1983 regarding handling hazardous drugs. The adaptation of federal regulations came when the U.S. Управление по охране труда (OSHA) first released its guidelines in 1986 and then updated them in 1996, 1999, and, most recently, 2006.[157]
В Национальный институт охраны труда и здоровья (NIOSH) has been conducting an assessment in the workplace since then regarding these drugs. Occupational exposure to antineoplastic drugs has been linked to multiple health effects, including infertility and possible carcinogenic effects. A few cases have been reported by the NIOSH alert report, such as one in which a female pharmacist was diagnosed with papillary transitional cell carcinoma. Twelve years before the pharmacist was diagnosed with the condition, she had worked for 20 months in a hospital where she was responsible for preparing multiple antineoplastic drugs.[158] The pharmacist didn't have any other risk factor for cancer, and therefore, her cancer was attributed to the exposure to the antineoplastic drugs, although a cause-and-effect relationship has not been established in the literature. Another case happened when a malfunction in biosafety cabinetry is believed to have exposed nursing personnel to antineoplastic drugs. Investigations revealed evidence of genotoxic biomarkers two and nine months after that exposure.
Routes of exposure
Antineoplastic drugs are usually given through внутривенный, внутримышечный, intrathecal, или же подкожный администрация. In most cases, before the medication is administered to the patient, it needs to be prepared and handled by several workers. Any worker who is involved in handling, preparing, or administering the drugs, or with cleaning objects that have come into contact with antineoplastic drugs, is potentially exposed to hazardous drugs. Health care workers are exposed to drugs in different circumstances, such as when pharmacists and pharmacy technicians prepare and handle antineoplastic drugs and when nurses and physicians administer the drugs to patients. Additionally, those who are responsible for disposing antineoplastic drugs in health care facilities are also at risk of exposure.[159]
Dermal exposure is thought to be the main route of exposure due to the fact that significant amounts of the antineoplastic agents have been found in the gloves worn by healthcare workers who prepare, handle, and administer the agents. Another noteworthy route of exposure is inhalation of the drugs' vapors. Multiple studies have investigated inhalation as a route of exposure, and although air sampling has not shown any dangerous levels, it is still a potential route of exposure. Ingestion by hand to mouth is a route of exposure that is less likely compared to others because of the enforced hygienic standard in the health institutions. However, it is still a potential route, especially in the workplace, outside of a health institute. One can also be exposed to these hazardous drugs through injection by needle sticks. Research conducted in this area has established that occupational exposure occurs by examining evidence in multiple urine samples from health care workers.[160]
Опасности
Hazardous drugs expose health care workers to serious health risks. Many studies show that antineoplastic drugs could have many side effects on the reproductive system, such as fetal loss, congenital malformation, and infertility. Health care workers who are exposed to antineoplastic drugs on many occasions have adverse reproductive outcomes such as spontaneous abortions, stillbirths, and congenital malformations. Moreover, studies have shown that exposure to these drugs leads to menstrual cycle irregularities. Antineoplastic drugs may also increase the risk of learning disabilities among children of health care workers who are exposed to these hazardous substances.
Moreover, these drugs have канцерогенный последствия. In the past five decades, multiple studies have shown the carcinogenic effects of exposure to antineoplastic drugs. Similarly, there have been research studies that linked alkylating agents with humans developing leukemias. Studies have reported elevated risk of breast cancer, nonmelanoma skin cancer, and cancer of the rectum among nurses who are exposed to these drugs. Other investigations revealed that there is a potential генотоксичный effect from anti-neoplastic drugs to workers in health care settings.[158]
Safe handling in health care settings
As of 2018, there were no occupational exposure limits set for antineoplastic drugs, i.e., OSHA or the Американская конференция государственных промышленных гигиенистов (ACGIH) have not set workplace safety guidelines.[161]
Подготовка
NIOSH recommends using a ventilated cabinet that is designed to decrease worker exposure. Additionally, it recommends training of all staff, the use of cabinets, implementing an initial evaluation of the technique of the safety program, and wearing protective gloves and gowns when opening drug packaging, handling vials, or labeling. When wearing средства индивидуальной защиты, one should inspect gloves for physical defects before use and always wear double gloves and protective gowns. Health care workers are also required to wash their hands with water and soap before and after working with antineoplastic drugs, change gloves every 30 minutes or whenever punctured, and discard them immediately in a chemotherapy waste container.[162]
The gowns used should be disposable gowns made of polyethylene-coated polypropylene. When wearing gowns, individuals should make sure that the gowns are closed and have long sleeves. When preparation is done, the final product should be completely sealed in a plastic bag.
The health care worker should also wipe all waste containers inside the ventilated cabinet before removing them from the cabinet. Finally, workers should remove all protective wear and put them in a bag for their disposal inside the ventilated cabinet.[159]
Администрация
Drugs should only be administered using protective medical devices such as needle lists and closed systems and techniques such as priming of IV tubing by pharmacy personnel inside a ventilated cabinet. Workers should always wear personal protective equipment such as double gloves, goggles, and protective gowns when opening the outer bag and assembling the delivery system to deliver the drug to the patient, and when disposing of all material used in the administration of the drugs.[161]
Hospital workers should never remove tubing from an IV bag that contains an antineoplastic drug, and when disconnecting the tubing in the system, they should make sure the tubing has been thoroughly flushed. After removing the IV bag, the workers should place it together with other disposable items directly in the yellow chemotherapy waste container with the lid closed. Protective equipment should be removed and put into a disposable chemotherapy waste container. After this has been done, one should double bag the chemotherapy waste before or after removing one's inner gloves. Moreover, one must always wash one's hands with soap and water before leaving the drug administration site.[163]
Employee training
All employees whose jobs in health care facilities expose them to hazardous drugs must receive training. Training should include shipping and receiving personnel, housekeepers, pharmacists, assistants, and all individuals involved in the transportation and storage of antineoplastic drugs. These individuals should receive information and training to inform them of the hazards of the drugs present in their areas of work. They should be informed and trained on operations and procedures in their work areas where they can encounter hazards, different methods used to detect the presence of hazardous drugs and how the hazards are released, and the physical and health hazards of the drugs, including their reproductive and carcinogenic hazard potential. Additionally, they should be informed and trained on the measures they should take to avoid and protect themselves from these hazards. This information ought to be provided when health care workers come into contact with the drugs, that is, perform the initial assignment in a work area with hazardous drugs. Moreover, training should also be provided when new hazards emerge as well as when new drugs, procedures, or equipment are introduced.[161]
Housekeeping and waste disposal
When performing cleaning and decontaminating the work area where antineoplastic drugs are used, one should make sure that there is sufficient ventilation to prevent the buildup of airborne drug concentrations. When cleaning the work surface, hospital workers should use deactivation and cleaning agents before and after each activity as well as at the end of their shifts. Cleaning should always be done using double protective gloves and disposable gowns. After employees finish up cleaning, they should dispose of the items used in the activity in a yellow chemotherapy waste container while still wearing protective gloves. After removing the gloves, they should thoroughly wash their hands with soap and water. Anything that comes into contact or has a trace of the antineoplastic drugs, such as needles, empty vials, syringes, gowns, and gloves, should be put in the chemotherapy waste container.[164]
Spill control
A written policy needs to be in place in case of a spill of antineoplastic products. The policy should address the possibility of various sizes of spills as well as the procedure and personal protective equipment required for each size. A trained worker should handle a large spill and always dispose of all cleanup materials in the chemical waste container according to EPA regulations, not in a yellow chemotherapy waste container.[165]
Occupational monitoring
А medical surveillance program must be established. In case of exposure, occupational health professionals need to ask for a detailed history and do a thorough physical exam. They should test the urine of the potentially exposed worker by doing a urine dipstick or microscopic examination, mainly looking for blood, as several antineoplastic drugs are known to cause bladder damage.[158]
Urinary mutagenicity is a marker of exposure to antineoplastic drugs that was first used by Falck and colleagues in 1979 and uses bacterial mutagenicity assays. Apart from being nonspecific, the test can be influenced by extraneous factors such as dietary intake and smoking and is, therefore, used sparingly. However, the test played a significant role in changing the use of horizontal flow cabinets to vertical flow biological safety cabinets during the preparation of antineoplastic drugs because the former exposed health care workers to high levels of drugs. This changed the handling of drugs and effectively reduced workers’ exposure to antineoplastic drugs.[158]
Biomarkers of exposure to antineoplastic drugs commonly include urinary платина, метотрексат, urinary циклофосфамид и ifosfamide, and urinary metabolite of 5-фторурацил. In addition to this, there are other drugs used to measure the drugs directly in the urine, although they are rarely used. A measurement of these drugs directly in one's urine is a sign of high exposure levels and that an uptake of the drugs is happening either through inhalation or dermally.[158]
Available agents
There is an extensive list of antineoplastic agents. Several classification schemes have been used to subdivide the medicines used for cancer into several different types.[166][167]
История
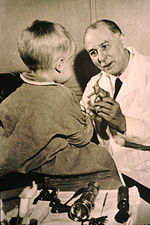
The first use of small-molecule drugs to treat cancer was in the early 20th century, although the specific chemicals first used were not originally intended for that purpose. Горчичный газ использовался как химическая война agent during Первая Мировая Война and was discovered to be a potent suppressor of кроветворение (blood production).[168] A similar family of compounds known as nitrogen mustards were studied further during Вторая Мировая Война на Йельская школа медицины.[169] It was reasoned that an agent that damaged the rapidly growing white blood cells might have a similar effect on cancer.[169] Therefore, in December 1942, several people with advanced лимфомы (cancers of the lymphatic system and lymph nodes) were given the drug by vein, rather than by breathing the irritating gas.[169] Their improvement, although temporary, was remarkable.[170] Concurrently, during a military operation in World War II, following a German воздушный налет on the Italian harbour of Бари, several hundred people were accidentally exposed to mustard gas, which had been transported there by the Союзные войска to prepare for possible retaliation in the event of German use of chemical warfare. The survivors were later found to have very low white blood cell counts.[171] After WWII was over and the reports declassified, the experiences converged and led researchers to look for other substances that might have similar effects against cancer. The first chemotherapy drug to be developed from this line of research was mustine. Since then, many other drugs have been developed to treat cancer, and drug development has exploded into a multibillion-dollar industry, although the principles and limitations of chemotherapy discovered by the early researchers still apply.[172]
Период, термин химиотерапия
Слово химиотерапия without a modifier usually refers to cancer treatment, but its historical meaning was broader. The term was coined in the early 1900s by Пол Эрлих as meaning any use of chemicals to treat any disease (chemo - + -therapy ), such as the use of антибиотики (antibacterial chemotherapy).[173] Ehrlich was not optimistic that effective chemotherapy drugs would be found for the treatment of cancer.[173] The first modern chemotherapeutic agent was арсфенамин, an arsenic compound discovered in 1907 and used to treat сифилис.[174] Позже за этим последовали сульфаниламиды (sulfa drugs) and пенициллин. В сегодняшней использование, то смысл "any treatment of disease with drugs" is often expressed with the word фармакотерапия.
Продажи
The top 10 best-selling (in terms of revenue) cancer drugs of 2013:[175]
| Нет. | 2013 Global Sales | ГОСТИНИЦА | Торговые наименования | Marketing authorization holder | Показания |
|---|---|---|---|---|---|
| 1 | $7.78 billion | Ритуксимаб | Rituxan, MabThera | Roche, Pharmstandard | non-Hodgkin's lymphoma, CLL |
| 2 | $6.75 billion | Бевацизумаб | Авастин | Рош | Colorectal, lung, ovarian and brain cancer |
| 3 | $6.56 billion | Трастузумаб | Герцептин | Рош | Breast, esophagus and stomach cancer |
| 4 | 4,69 млрд долларов | Иматиниб | Gleevec | Новартис | Leukemia, GI cancer |
| 5 | $1.09 billion | Леналидомид | Revlimid | Celgene, Pharmstandard | Multiple myeloma, mantle cell lymphoma |
| 6 | $2.7 billion | Пеметрексед | Alimta | Эли Лилли | Рак легких |
| 7 | $2.6 billion | Бортезомиб | Велкейд | Johnson & Johnson, Takeda, Pharmstandard | Множественная миелома |
| 8 | $1.87 billion | Цетуксимаб | Erbitux | Merck KGaA, Bristol-Myers Squibb | Colon and head and neck cancer |
| 9 | $1.73 billion | Лейпрорелин | Lupron, Eligard | AbbVie and Takeda; Sanofi and Astellas Pharma | Prostate and ovarian cancer |
| 10 | $1.7 billion | Абиратерон | Zytiga | Джонсон и Джонсон | Рак простаты |
Исследование

Targeted therapies
Specially targeted delivery vehicles aim to increase effective levels of chemotherapy for tumor cells while reducing effective levels for other cells. This should result in an increased tumor kill or reduced toxicity or both.[176]
Конъюгаты антитело-лекарственное средство
Конъюгаты антитело-лекарственное средство (ADCs) comprise an антитело, drug and a linker between them. The antibody will be targeted at a preferentially expressed protein in the tumour cells (known as a опухолевый антиген ) or on cells that the tumor can utilise, such as blood vessel endothelial cells. They bind to the tumor antigen and are internalised, where the linker releases the drug into the cell. These specially targeted delivery vehicles vary in their stability, selectivity, and choice of target, but, in essence, they all aim to increase the maximum effective dose that can be delivered to the tumor cells.[177] Reduced systemic toxicity means that they can also be used in people who are sicker, and that they can carry new chemotherapeutic agents that would have been far too toxic to deliver via traditional systemic approaches.[нужна цитата ]
The first approved drug of this type was gemtuzumab ozogamicin (Mylotarg), released by Wyeth (сейчас же Pfizer ). The drug was approved to treat острый миелоидный лейкоз, but has now been withdrawn from the market because the drug did not meet efficacy targets in further clinical trials.[178][179] Two other drugs, трастузумаб эмтанзин и brentuximab vedotin, are both in late clinical trials, and the latter has been granted accelerated approval for the treatment of огнеупорный Лимфома Ходжкина and systemic anaplastic large cell lymphoma.[177]
Наночастицы
Наночастицы are 1–1000 нанометр (nm) sized particles that can promote tumor selectivity and aid in delivering low-растворимость наркотики. Nanoparticles can be targeted passively or actively. Passive targeting exploits the difference between tumor blood vessels and normal blood vessels. Blood vessels in tumors are "leaky" because they have gaps from 200 to 2000 nm, which allow nanoparticles to escape into the tumor. Active targeting uses biological molecules (антитела, белки, ДНК и рецепторные лиганды ) to preferentially target the nanoparticles to the tumor cells. There are many types of nanoparticle delivery systems, such as кремнезем, полимеры, липосомы and magnetic particles. Nanoparticles made of magnetic material can also be used to concentrate agents at tumor sites using an externally applied magnetic field.[176] They have emerged as a useful vehicle in магнитная доставка лекарств for poorly soluble agents such as паклитаксел.[180]
Electrochemotherapy
Electrochemotherapy is the combined treatment in which injection of a chemotherapeutic drug is followed by application of high-voltage electric pulses locally to the tumor. The treatment enables the chemotherapeutic drugs, which otherwise cannot or hardly go through the membrane of cells (such as bleomycin and cisplatin), to enter the cancer cells. Hence, greater effectiveness of antitumor treatment is achieved.
Clinical electrochemotherapy has been successfully used for treatment of cutaneous and subcutaneous tumors irrespective of their histological origin.[181][182][183][184][185][186] The method has been reported as safe, simple and highly effective in all reports on clinical use of electrochemotherapy. В соответствии с проектом ESOPE (Европейские стандартные операционные процедуры электрохимиотерапии) были подготовлены Стандартные операционные процедуры (СОП) для электрохимиотерапии, основанные на опыте ведущих европейских онкологических центров по электрохимиотерапии.[183][187] Недавно были разработаны новые методы электрохимиотерапии для лечения внутренних опухолей с использованием хирургических процедур, эндоскопических методов или чрескожных доступов для получения доступа к области лечения.[188][189]
Гипертермическая терапия
Гипертермическая терапия это тепловая обработка рака, которая может быть мощным инструментом при использовании в сочетании с химиотерапией (термохимиотерапией) или облучением для борьбы с различными видами рака. Тепло можно приложить локально к месту опухоли, что расширит кровеносные сосуды опухоли, позволяя большему количеству химиотерапевтических препаратов попасть в опухоль. Кроме того, мембрана опухолевой клетки станет более пористой, что позволит большему количеству химиотерапевтического лекарства проникнуть в опухолевую клетку.
Также было показано, что гипертермия помогает предотвратить или обратить вспять «химиорезистентность». Устойчивость к химиотерапии иногда развивается со временем, поскольку опухоли адаптируются и могут преодолеть токсичность химиопрепаратов. «Преодоление химиорезистентности широко изучалось в прошлом, особенно с использованием CDDP-устойчивых клеток. Что касается потенциальной выгоды от того, что лекарственно-устойчивые клетки могут быть задействованы для эффективной терапии путем сочетания химиотерапии с гипертермией, было важно показать, что химиорезистентность против нескольких противоопухолевые препараты (например, митомицин С, антрациклины, BCNU, мелфалан), включая CDDP, могут быть обращены, по крайней мере, частично, путем добавления тепла.[190]
Другие животные
Химиотерапия используется в ветеринарии так же, как и в медицине человека.[191]
Смотрите также
- Противораковые препараты (журнал)
- Антимикробная химиотерапия
- Рак и тошнота
- Утомляемость, связанная с раком
- Химиотерапия
- Режимы химиотерапии
- Цитостаз
- Экспериментальные методы лечения рака
- Безопасное обращение с опасными лекарствами
- Доставки лекарств
- Гипертермическая терапия
- Иммунотерапия
- Национальная комплексная онкологическая сеть
- Спад когнитивных функций, вызванный радиацией
- Лучевая терапия
- Виротерапия
Рекомендации
- ^ а б Альфарук К.О., Сток С.М., Тейлор С., Уолш М., Муддатир А.К., Вердуско Д. и др. (15 июля 2015 г.). «Устойчивость к химиотерапии рака: отсутствие лекарственного ответа от ADME на P-gp». Cancer Cell International. 15 (1): 71. Дои:10.1186 / s12935-015-0221-1. ЧВК 4502609. PMID 26180516.
- ^ Джонстон Р. У., Руфли А. А., Лоу С. В. (январь 2002 г.). «Апоптоз: связь между генетикой рака и химиотерапией». Клетка. 108 (2): 153–64. Дои:10.1016 / S0092-8674 (02) 00625-6. PMID 11832206. S2CID 7429296.
- ^ Раджман Л., Чвалек К., Синклер Д.А. (2018). "Терапевтический потенциал молекул, усиливающих НАД: доказательства in vivo". Клеточный метаболизм. 27 (3): 529–547. Дои:10.1016 / j.cmet.2018.02.011. ЧВК 6342515. PMID 29514064.
- ^ а б c d е ж Корри П.Г., Пиппа Г. (2008). «Цитотоксическая химиотерапия: клинические аспекты». Лекарство. 36 (1): 24–28. Дои:10.1016 / j.mpmed.2007.10.012.
- ^ а б c Wagner AD, Syn NL, Moehler M, Grothe W., Yong WP, Tai BC, Ho J, Unverzagt S (август 2017 г.). «Химиотерапия при запущенном раке желудка». Кокрановская база данных систематических обзоров. 8: CD004064. Дои:10.1002 / 14651858.cd004064.pub4. ЧВК 6483552. PMID 28850174.
- ^ а б c d е ж грамм час я j k Рэйчел Эйрли (2009). Химиотерапия рака. Вили-Блэквелл. ISBN 978-0-470-09254-5.
- ^ а б c d е ж Вуд М, Брайтон Д (2005). Справочник больницы Royal Marsden по химиотерапии рака: руководство для многопрофильной команды. Сент-Луис, Миссури: Эльзевьер Черчилль Ливингстон. ISBN 978-0-443-07101-0.
- ^ Перри, Майкл Дж. (2008). Справочник по химиотерапии. Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. ISBN 978-0-7817-7328-7.
- ^ Эпштейн Р.Дж. (август 2005 г.). «Поддерживающая терапия для подавления микрометастазирования: новая проблема адъювантного лечения рака». Клинические исследования рака. 11 (15): 5337–41. Дои:10.1158 / 1078-0432.CCR-05-0437. PMID 16061845.
- ^ Скил RT (2003). Справочник по химиотерапии рака (в мягкой обложке) (6-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-3629-9.
- ^ Чабнер Б., Лонго Д.Л. (2005). Химиотерапия и биотерапия рака: принципы и практика (4-е изд.). Филадельфия: Липпинкотт Виллианс и Уилкинс. ISBN 978-0-7817-5628-0.
- ^ Наступиль ЖЖ, Rose AC, Flowers CR (май 2012). «Диффузная В-клеточная лимфома большого размера: современные подходы к лечению». Онкология. 26 (5): 488–95. PMID 22730604.
- ^ Freedman A (октябрь 2012 г.). «Фолликулярная лимфома: обновленная информация о диагностике и лечении 2012 г.». Американский журнал гематологии. 87 (10): 988–95. Дои:10.1002 / ajh.23313. PMID 23001911. S2CID 35447562.
- ^ Рэмплинг Р., Джеймс А., Папанастассиу В. (июнь 2004 г.). «Настоящее и будущее лечение злокачественных опухолей головного мозга: хирургия, лучевая терапия, химиотерапия». Журнал неврологии, нейрохирургии и психиатрии. 75 Suppl 2 (Suppl 2): ii24-30. Дои:10.1136 / jnnp.2004.040535. ЧВК 1765659. PMID 15146036.
- ^ Мадан В., Лир Дж. Т., Шеймиес Р. М. (февраль 2010 г.). «Немеланомный рак кожи». Ланцет. 375 (9715): 673–85. Дои:10.1016 / S0140-6736 (09) 61196-X. ЧВК 3339125. PMID 20171403.
- ^ Du Bois D, Du Bois EF (1989). «Формула для оценки приблизительной площади поверхности, если известны рост и вес. 1916». Питание. 5 (5): 303–11, обсуждение 312–3. PMID 2520314.
- ^ а б c Феличи А., Вервей Дж., Спарребум А. (сентябрь 2002 г.). «Стратегии дозирования противоопухолевых препаратов: хорошее, плохое и площадь поверхности тела». Европейский журнал рака. 38 (13): 1677–84. Дои:10.1016 / s0959-8049 (02) 00151-x. PMID 12175683.
- ^ а б c Kaestner SA, Sewell GJ (февраль 2007 г.). «Дозирование химиотерапии, часть I: научная основа современной практики и использования площади поверхности тела» (PDF). Клиническая онкология. 19 (1): 23–37. Дои:10.1016 / j.clon.2006.10.010. HDL:10026.1/3714. PMID 17305252.
- ^ Пинкель Д. (август 1958 г.). «Использование площади поверхности тела в качестве критерия дозировки лекарств в химиотерапии рака». Исследования рака. 18 (7): 853–6. PMID 13573353.
- ^ а б Гурни Х (апрель 2002 г.). «Как рассчитать дозу химиотерапии». Британский журнал рака. 86 (8): 1297–302. Дои:10.1038 / sj.bjc.6600139. ЧВК 2375356. PMID 11953888.
- ^ а б Беумер Дж. Х., Чу Э., Саламоне С. Дж. (Ноябрь 2012 г.). «Дозирование химиотерапии на основе площади поверхности тела: уместно ли в 21 веке?». Журнал клинической онкологии. 30 (31): 3896–7. Дои:10.1200 / JCO.2012.44.2863. PMID 22965963.
- ^ а б Бейкер С.Д., Вервей Дж., Ровински Е.К., Донехауэр Р.К., Шелленс Дж. Х., Грохов Л. Б., Спарребум А (декабрь 2002 г.). "Роль площади поверхности тела в дозировании исследуемых противораковых агентов у взрослых, 1991-2001 гг.". Журнал Национального института рака. 94 (24): 1883–8. Дои:10.1093 / jnci / 94.24.1883. PMID 12488482.
- ^ а б c d е ж грамм час я j Гамлен Э, Дельва Р., Джейкоб Дж., Мерруш Ю., Рауль Дж. Л., Пезет Д., Дорваль Э, Пиот Дж., Морель А., Буадрон-Целль М. (май 2008 г.). «Индивидуальная корректировка дозы фторурацила на основе последующего фармакокинетического наблюдения по сравнению с обычной дозировкой: результаты многоцентрового рандомизированного исследования пациентов с метастатическим колоректальным раком». Журнал клинической онкологии. 26 (13): 2099–105. Дои:10.1200 / jco.2007.13.3934. PMID 18445839. S2CID 9557055.
- ^ Саам Дж., Кричфилд Г.К., Гамильтон С.А., Роа Б.Б., Венструп Р.Дж., Калдате Р.Р. (сентябрь 2011 г.). «Дозирование 5-фторурацила на основе площади поверхности тела приводит к обширной индивидуальной вариабельности воздействия 5-фторурацила у пациентов с колоректальным раком, получающих схемы FOLFOX». Клинический колоректальный рак. 10 (3): 203–6. Дои:10.1016 / j.clcc.2011.03.015. PMID 21855044.
- ^ а б c d е ж грамм Capitain O, Asevoaia A, Boisdron-Celle M, Poirier AL, Morel A, Gamelin E (декабрь 2012 г.). «Индивидуальная корректировка дозы фторурацила в FOLFOX на основе фармакокинетических наблюдений по сравнению с обычным дозированием на площадь тела и поверхность: фаза II, испытательное исследование». Клинический колоректальный рак. 11 (4): 263–7. Дои:10.1016 / j.clcc.2012.05.004. PMID 22683364.
- ^ Kaldate RR, Haregewoin A, Grier CE, Hamilton SA, McLeod HL (2012). «Моделирование зависимости площади 5-фторурацила под кривой от дозы для разработки алгоритма фармакокинетического дозирования для пациентов с колоректальным раком, получающих FOLFOX6». Онколог. 17 (3): 296–302. Дои:10.1634 / теонколог.2011-0357. ЧВК 3316912. PMID 22382460.
- ^ а б c Хантер Р.Дж., Наво М.А., Такер PH, Бодурка, округ Колумбия, Вольф Д.К., Смит Д.А. (февраль 2009 г.). «Дозирование химиотерапии у пациентов с ожирением: фактическая и назначенная площадь поверхности тела (BSA)». Отзывы о лечении рака. 35 (1): 69–78. Дои:10.1016 / j.ctrv.2008.07.005. PMID 18922643.
- ^ Ханна, Луиза; Кросби, Том; Фергус Макбет, ред. (2008). Практическая клиническая онкология. Кембридж, Великобритания: Издательство Кембриджского университета. ISBN 978-0-521-61816-8.
- ^ Buffery PJ, Аллен KM, Chin PK, Moore GA, Barclay ML, Begg EJ (февраль 2014 г.). «Тринадцатилетний опыт фармакокинетического мониторинга и дозирования бусульфана: можно ли улучшить стратегию?». Терапевтический мониторинг лекарственных средств. 36 (1): 86–92. Дои:10.1097 / FTD.0b013e31829dc940. PMID 24299921. S2CID 28646787.
- ^ Бартелинк И.Х., Бредиус Р.Г., Белицер С.В., Сутторп М.М., Бирингс М., Книббе К.А. и др. (2014). «Связь между воздействием бусульфана и исходом у детей, получающих бусульфан внутривенно перед трансплантацией гемопоэтических стволовых клеток». Ther Drug Monit. 36 (1): 93–99. Дои:10.1097 / FTD.0b013e3182a04fc7. PMID 24061446. S2CID 21072472.
- ^ «Анализ метотрексата ARK». Ковчег Диагностика. Архивировано из оригинал 28 апреля 2014 г.. Получено 28 апреля 2014.
- ^ «Настройка химиотерапии для лучшего лечения рака». Моя диагностика ухода. Архивировано из оригинал 28 апреля 2014 г.. Получено 25 ноября 2018.
- ^ «Краткая история дозирования BSA». Моя диагностика ухода.
- ^ Ашер В., Ли Дж., Бали А. (сентябрь 2012 г.). «Предоперационный сывороточный альбумин является независимым прогностическим показателем выживаемости при раке яичников». Медицинская онкология. 29 (3): 2005–9. Дои:10.1007 / s12032-011-0019-5. PMID 21735143. S2CID 19558612.
- ^ а б Сиддик Ж. (2005). «Механизмы действия противораковых химиотерапевтических агентов: ДНК-взаимодействующие алкилирующие агенты и противоопухолевые препараты на основе платины». Справочник по раку. John Wiley & Sons, Ltd. Дои:10.1002 / 0470025077.chap84b. ISBN 978-0470025062.
- ^ а б c d е ж Линд М.Дж., М.Дж. (2008). «Принципы цитотоксической химиотерапии». Лекарство. 36 (1): 19–23. Дои:10.1016 / j.mpmed.2007.10.003.
- ^ а б c Дамиа Г., Д'Инкальчи М. (сентябрь 1998 г.). «Механизмы устойчивости к алкилирующим агентам». Цитотехнология. 27 (1–3): 165–73. Дои:10.1023 / А: 1008060720608. ЧВК 3449574. PMID 19002790.
- ^ а б c d Малхотра V, Перри MC (2003). «Классическая химиотерапия: механизмы, токсичность и терапевтическое окно». Биология и терапия рака. 2 (4 Дополнение 1): S2-4. Дои:10.4161 / cbt.199. PMID 14508075.
- ^ Джорджи-Рено С, Рено Дж, Барон М, Гебель-Серволлес П, Делик Дж, Крос С., Паолетти С. (1988). «Гетероциклические хиноны XIII. Димеризация в ряду 5,8-хиназолиндионов: Синтез и противоопухолевые эффекты бис (4-амино-5,8-хиназолиндионов)». Chem. Pharm. Бык. 36 (10): 3933–3947. Дои:10.1248 / cpb.36.3933. PMID 3245973.
- ^ Такимото CH, Calvo E (2008). «Принципы онкологической фармакотерапии». In Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (ред.). Лечение рака: мультидисциплинарный подход (11-е изд.).
- ^ а б c Parker WB (июль 2009 г.). «Энзимология пуриновых и пиримидиновых антиметаболитов, используемых в лечении рака». Химические обзоры. 109 (7): 2880–93. Дои:10.1021 / cr900028p. ЧВК 2827868. PMID 19476376.
- ^ Аджей А.А. (июнь 2004 г.). «Пеметрексед (АЛИМТА), новый многоцелевой противоопухолевый агент». Клинические исследования рака. 10 (12, часть 2): 4276–4280 с. Дои:10.1158 / 1078-0432.CCR-040010. PMID 15217974. S2CID 31467685.
- ^ Вагстафф AJ, Ибботсон T, Гоа KL (2003). «Капецитабин: обзор его фармакологии и терапевтической эффективности при лечении распространенного рака груди». Наркотики. 63 (2): 217–36. Дои:10.2165/00003495-200363020-00009. PMID 12515569.
- ^ Ровинский EK, Donehower RC (октябрь 1991). «Клиническая фармакология и использование антимикротрубочковых агентов в химиотерапевтических средствах против рака». Фармакология и терапия. 52 (1): 35–84. Дои:10.1016/0163-7258(91)90086-2. PMID 1687171.
- ^ а б c Юэ QX, Лю X, Guo DA (август 2010 г.). «Натуральные продукты, связывающие микротрубочки, для лечения рака». Planta Medica. 76 (11): 1037–43. Дои:10.1055 / с-0030-1250073. PMID 20577942.
- ^ Хирата К., Миямото К., Миура Y (1994). "Катарантус розовый L. (Барвинок): Производство виндолина и катарантина в культурах с множественными побегами ». В Bajaj YP (ред.). Биотехнологии в сельском и лесном хозяйстве 26. Лекарственные и ароматические растения. VI. Springer-Verlag. стр.46–55. ISBN 9783540563914.
- ^ ван дер Хейден Р., Якобс Д. И., Снейер В., Халлард Д., Верпоорте Р. (март 2004 г.). «Алкалоиды Catharanthus: фармакогнозия и биотехнология». Современная лекарственная химия. 11 (5): 607–28. Дои:10.2174/0929867043455846. PMID 15032608.
- ^ Gansäuer A, Justicia J, Fan CA, Worgull D, Piestert F (2007). «Восстановительное образование связи C — C после раскрытия эпоксида посредством переноса электрона». В Крише MJ (ред.). Катализируемое металлом образование восстановительных связей C — C: отход от предварительно приготовленных металлоорганических реагентов. Темы современной химии. 279. Springer Science & Business Media. С. 25–52. Дои:10.1007/128_2007_130. ISBN 9783540728795.
- ^ Купер Р., Дикин Дж. Дж. (2016). «Дар Африки миру». Ботанические чудеса: химия растений, изменивших мир. CRC Press. С. 46–51. ISBN 9781498704304.
- ^ а б Кеглевич П., Хазай Л., Калаус Г., Сантай С. (май 2012 г.). «Модификации основных скелетов винбластина и винкристина». Молекулы. 17 (5): 5893–914. Дои:10.3390 / молекулы17055893. ЧВК 6268133. PMID 22609781.
- ^ Равинья, Энрике (2011). «Алкалоиды барвинка». Эволюция открытия лекарств: от традиционных лекарств к современным лекарствам. Джон Уайли и сыновья. С. 157–159. ISBN 9783527326693.
- ^ Фаллер Б.А., Пандит Т.Н. (2011). «Безопасность и эффективность винорелбина в лечении немелкоклеточного рака легкого». Понимание клинической медицины: онкология. 5: 131–44. Дои:10.4137 / CMO.S5074. ЧВК 3117629. PMID 21695100.
- ^ Ngo QA, Русси Ф., Кормье А., Торет С., Кносов М., Генар Д., Герит Ф. (январь 2009 г.). «Синтез и биологическая оценка алкалоидов барвинка и гибридов фомопсина». Журнал медицинской химии. 52 (1): 134–42. Дои:10.1021 / jm801064y. PMID 19072542.
- ^ Damayanthi Y, Lown JW (июнь 1998 г.). «Подофиллотоксины: текущее состояние и последние разработки». Современная лекарственная химия. 5 (3): 205–52. PMID 9562603.
- ^ Лю YQ, Ян Л., Тянь X (2007). «Подофиллотоксин: современные перспективы». Текущие биоактивные соединения. 3 (1): 37–66. Дои:10.1016 / j.jallcom.2006.06.070.
- ^ Лодиш Х., Берк А., Зипурский С.Л. и др. (2000). Молекулярная клеточная биология. 4-е издание. Роль топоизомераз в репликации ДНК. Нью-Йорк: У. Х. Фриман.
- ^ Гудселл Д.С. (2002). «Молекулярная перспектива: топоизомеразы ДНК». Стволовые клетки. 20 (5): 470–1. Дои:10.1634 / стволовые клетки.20-5-470. PMID 12351817. S2CID 9257158.
- ^ Nitiss JL (май 2009 г.). «Нацеливание на ДНК-топоизомеразу II в химиотерапии рака». Обзоры природы. Рак. 9 (5): 338–50. Дои:10.1038 / nrc2607. ЧВК 2748742. PMID 19377506.
- ^ Офферманнс С., Розенталь В. (14 августа 2008 г.). Энциклопедия молекулярной фармакологии. Springer Science & Business Media. п. 155. ISBN 9783540389163.
- ^ Офферманнс С., Розенталь В. (14 августа 2008 г.). Энциклопедия молекулярной фармакологии. Springer Science & Business Media. С. 91 и далее. ISBN 9783540389163.
- ^ Келлер Дж, Эбл М (1988). «Митоксантрон: новое производное антрациклина». Клиническая аптека. 7 (8): 574–81. PMID 3048848.
- ^ Минотти Дж., Менна П., Сальваторелли Э., Каир Дж., Джанни Л. (июнь 2004 г.). «Антрациклины: молекулярные достижения и фармакологические разработки в области противоопухолевой активности и кардиотоксичности». Фармакологические обзоры. 56 (2): 185–229. Дои:10.1124 / пр.56.2.6. PMID 15169927. S2CID 13138853.
- ^ Собелл Х.М. (август 1985 г.). «Актиномицин и транскрипция ДНК». Труды Национальной академии наук Соединенных Штатов Америки. 82 (16): 5328–31. Bibcode:1985PNAS ... 82.5328S. Дои:10.1073 / pnas.82.16.5328. ЧВК 390561. PMID 2410919.
- ^ Дорр RT (апрель 1992 г.). «Фармакология блеомицина: механизм действия и резистентность, клиническая фармакокинетика». Семинары по онкологии. 19 (2 Дополнение 5): 3–8. PMID 1384141.
- ^ Вервей Дж., Пинедо Х.М. (октябрь 1990 г.). «Митомицин С: механизм действия, полезность и ограничения». Противораковые препараты. 1 (1): 5–13. Дои:10.1097/00001813-199010000-00002. PMID 2131038.
- ^ Грир Дж. А., Амоял Н., Нисотель Л., Фишбейн Дж. Н., Макдональд Дж., Стэгл Дж. И др. (Март 2016 г.). "Систематический обзор соблюдения оральной противоопухолевой терапии". Онколог. 21 (3): 354–76. Дои:10.1634 / теонколог.2015-0405. ЧВК 4786357. PMID 26921292.
- ^ Морено-Рамирес Д., де ла Крус-Мерино Л., Феррандис Л., Вильегас-Портеро Р., Ньето-Гарсия А. (2010). «Изолированная перфузия конечностей при злокачественной меланоме: систематический обзор эффективности и безопасности». Онколог. 15 (4): 416–27. Дои:10.1634 / теонколог.2009-0325. ЧВК 3227960. PMID 20348274.
- ^ Verhoef C, de Wilt JH, ten Hagen TL, Eggermont AM (октябрь 2008 г.). «Изолированная перфузия печени для лечения опухолей печени: закат или восход солнца?». Клиники хирургической онкологии Северной Америки. 17 (4): 877–94, xi. Дои:10.1016 / j.soc.2008.04.007. PMID 18722924.
- ^ Хендрикс JM, Van Schil PE (1998). «Изолированная перфузия легких для лечения легочных метастазов». Хирургическая онкология. 7 (1–2): 59–63. Дои:10.1016 / S0960-7404 (98) 00028-0. PMID 10421507.
- ^ Читвуд К., Эцкорн Дж., Коэн Дж. (Сентябрь 2013 г.). «Местное и внутриочаговое лечение немеланомного рака кожи: сравнение эффективности и стоимости». Дерматологическая хирургия. 39 (9): 1306–16. Дои:10.1111 / dsu.12300. PMID 23915332. S2CID 597295.
- ^ Хуанг ES (2000). Внутренняя медицина: руководство для врачей, руководство по выживанию резидента. Арлингтон, Вирджиния: Scrub Hill Press. п. 130. ISBN 978-0-9645467-5-2.
- ^ Элад С., Задик И., Хьюсон И., Хован А., Корреа М.Э., Логан Р., Элтинг Л.С., Спийкервет Ф.К., Бреннан М.Т. (август 2010 г.). «Систематический обзор вирусных инфекций, связанных с поражением полости рта у онкологических больных: в центре внимания Herpesviridea». Поддерживающая терапия при раке. 18 (8): 993–1006. Дои:10.1007 / s00520-010-0900-3. PMID 20544224. S2CID 2969472.
- ^ а б c Гафтер-Гвили А., Фрейзер А., Пол М., Видал Л., Лори Т.А., ван де Ветеринг, доктор медицины, Кремер Л.С., Лейбовичи Л. (январь 2012 г.). «Антибиотикопрофилактика бактериальных инфекций у пациентов с афебрильной нейтропенией после химиотерапии». Кокрановская база данных систематических обзоров. 1: CD004386. Дои:10.1002 / 14651858.CD004386.pub3. ЧВК 4170789. PMID 22258955.
- ^ "Кориолус разноцветный". Cancer.org. 10 июня 2008 г.. Получено 7 августа 2012.
- ^ Давила М.Л. (январь 2006 г.). «Нейтропенический энтероколит». Текущее мнение в гастроэнтерологии. 22 (1): 44–7. Дои:10.1097 / 01.mog.0000198073.14169.3b. PMID 16319675. S2CID 25479771.
- ^ а б Кейдан Р.Д., Фаннинг Дж., Гейтенби Р.А., Виз Дж. Л. (март 1989 г.). «Рецидивирующий тифлит. Заболевание, возникшее в результате агрессивной химиотерапии». Заболевания толстой и прямой кишки. 32 (3): 206–9. Дои:10.1007 / BF02554529. PMID 2920627. S2CID 46090832.
- ^ Гибсон Р.Дж., Киф DM (сентябрь 2006 г.). «Диарея и запор, вызванные химиотерапией рака: механизмы повреждения и стратегии профилактики». Поддерживающая терапия при раке. 14 (9): 890–900. Дои:10.1007 / s00520-006-0040-у. PMID 16604351. S2CID 109778.
- ^ Вей Д., Хеус П., ван де Ветеринг FT, ван Тиенховен Г., Верлей Л., Шолтен Р. Дж. (Август 2018 г.). «Пробиотики для профилактики или лечения диареи, связанной с химиотерапией или лучевой терапией, у людей, больных раком». Кокрановская база данных систематических обзоров. 8: CD008831. Дои:10.1002 / 14651858.cd008831.pub3. ЧВК 6513393. PMID 30168576.
- ^ Groopman JE, Itri LM (октябрь 1999 г.). «Анемия, вызванная химиотерапией у взрослых: частота и лечение». Журнал Национального института рака. 91 (19): 1616–34. Дои:10.1093 / jnci / 91.19.1616. PMID 10511589.
- ^ Генри Д.Х. (июль 2006 г.). «Роль внутривенного железа в анемии, связанной с раком». Онкология. 20 (8 Дополнение 6): 21–4. PMID 16925107.
- ^ Роджерс Дж. Розенталь Дж, Саббатини П., Шварц Р.Н., Штейн Р.С., Вий Р. (июль 2008 г.). «Анемия, вызванная раком и химиотерапией». Журнал Национальной комплексной онкологической сети. 6 (6): 536–64. Дои:10.6004 / jnccn.2008.0042. PMID 18597709.
- ^ Вадхан-Радж С. (январь 2009 г.). «Управление тромбоцитопенией, вызванной химиотерапией: текущий статус тромбопоэтических агентов». Семинары по гематологии. 46 (1 Прил. 2): С26-32. Дои:10.1053 / j.seminatheol.2008.12.007. PMID 19245931.
- ^ Сехон СС, Рой V (май 2006 г.). «Тромбоцитопения у взрослых: практический подход к оценке и лечению». Южный медицинский журнал. 99 (5): 491–8, викторина 499–500, 533. Дои:10.1097 / 01.smj.0000209275.75045.d4. PMID 16711312. S2CID 16527763.
- ^ Эсткурт Л., Стэнворт С., Дори С., Хоупвелл С., Мерфи М.Ф., Тинмут А., Хеддл Н. и др. (Кокрановская группа по гематологическим злокачественным новообразованиям) (май 2012 г.). «Профилактическое переливание тромбоцитов для предотвращения кровотечений у пациентов с гематологическими нарушениями после химиотерапии и трансплантации стволовых клеток». Кокрановская база данных систематических обзоров (5): CD004269. Дои:10.1002 / 14651858.CD004269.pub3. PMID 22592695.
- ^ Estcourt LJ, Stanworth SJ, Doree C, Hopewell S, Trivella M, Murphy MF и др. (Кокрановская группа по гематологическим злокачественным новообразованиям) (ноябрь 2015 г.). «Сравнение различных пороговых значений количества тромбоцитов для проведения профилактического переливания тромбоцитов для предотвращения кровотечений у людей с гематологическими нарушениями после миелосупрессивной химиотерапии или трансплантации стволовых клеток». Кокрановская база данных систематических обзоров (11): CD010983. Дои:10.1002 / 14651858.CD010983.pub2. ЧВК 4717525. PMID 26576687.
- ^ Бергер А.М., Абернети А.П., Аткинсон А., Барсевик А.М., Брейтбарт В.С., Селла Д., Симприх Б., Клиленд С., Эйзенбергер М.А., Эскаланте С.П., Якобсен П.Б., Калдор П., Лигибель Дж. А., Мерфи Б. А., О'Коннор Т., Пирл В. Ф., Родлер Э., Руго Х.С., Томас Дж., Вагнер Л.И. (август 2010 г.). «Рекомендации NCCN по клинической практике, связанные с утомляемостью, связанной с раком». Журнал Национальной комплексной онкологической сети. 8 (8): 904–31. Дои:10.6004 / jnccn.2010.0067. PMID 20870636. S2CID 70400559.
- ^ Франклин DJ, Пакель Л. (март 2006 г.). «Утомляемость, связанная с раком». Архивы физической медицины и реабилитации. 87 (3 Приложение 1): S91–3, викторина S94–5. Дои:10.1016 / j.apmr.2005.12.015. PMID 16500197.
- ^ Судорога Ф, Байрон-Дэниел Дж (ноябрь 2012 г.). Судорога F (ред.). «Упражнения для снятия усталости, связанной с раком, у взрослых» (PDF). Кокрановская база данных систематических обзоров. 11: CD006145. Дои:10.1002 / 14651858.CD006145.pub3. PMID 23152233.
- ^ Гилл П., Гротей А., Лопринци С. (2006). Тошнота и рвота у онкологических больных. Онкология. С. 1482–1496. Дои:10.1007/0-387-31056-8_83. ISBN 978-0-387-24291-0.
Тошнота и рвота - два из побочных эффектов, связанных с лечением рака, которых больше всего опасаются для больных раком и их семей.
- ^ Чадха V, Шеной С.Д. (2003). «Выпадение волос у онкологических химиотерапевтических больных». Индийский журнал дерматологии, венерологии и лепрологии. 69 (2): 131–2. PMID 17642856.
- ^ Lemieux J (октябрь 2012 г.). «Уменьшение алопеции, вызванной химиотерапией, с охлаждением кожи головы». Клинические достижения в гематологии и онкологии. 10 (10): 681–2. PMID 23187775.
- ^ Шапиро Дж., Прайс В.Х. (апрель 1998 г.). «Отрастание волос. Лечебные средства». Дерматологические клиники. 16 (2): 341–56. Дои:10.1016 / S0733-8635 (05) 70017-6. PMID 9589208.
- ^ Аль-Моханна Х., Аль-Хенайзан С. (2010). «Постоянная алопеция после облучения черепа у ребенка». Журнал кожной медицины и хирургии. 14 (3): 141–3. Дои:10.2310/7750.2010.09014. PMID 20487675. S2CID 43583651.
- ^ Джан Джи, Демир М., Эрол О, Айдынер А. (июнь 2013 г.). «Сравнение опыта мужчин и женщин с алопецией, вызванной химиотерапией». Европейский журнал медсестер онкологии. 17 (3): 255–60. Дои:10.1016 / j.ejon.2012.06.003. PMID 22901547.
- ^ Trüeb RM (март 2009 г.). «Алопеция, вызванная химиотерапией». Семинары по кожной медицине и хирургии. 28 (1): 11–4. Дои:10.1016 / j.sder.2008.12.001. PMID 19341937.
- ^ Чон С.Ю., Чемпион RW, Геддес Э.Р., Рашид Р.М. (июль 2012 г.). «Алопеция, вызванная химиотерапией». Журнал Американской академии дерматологии. 67 (1): e37-47. Дои:10.1016 / j.jaad.2011.02.026. PMID 22178150.
- ^ Вторичные новообразования после химиотерапии, лучевой терапии и иммуносупрессии. 55. Базель: Каргер. 2000 г. ISBN 9783318006155. OCLC 606559421.
- ^ Hijiya N, Hudson MM, Lensing S, Zacher M, Onciu M, Behm FG, Razzouk BI, Ribeiro RC, Rubnitz JE, Sandlund JT, Rivera GK, Evans WE, Relling MV, Pui CH (март 2007 г.). «Кумулятивная заболеваемость вторичными новообразованиями как первое событие после острого лимфобластного лейкоза в детском возрасте». JAMA. 297 (11): 1207–15. Дои:10.1001 / jama.297.11.1207. PMID 17374815.
- ^ а б c d Brydøy M, Fosså SD, Dahl O, Bjøro T (2007). «Дисфункция гонад и проблемы фертильности у выживших после рака». Acta Oncologica. 46 (4): 480–9. Дои:10.1080/02841860601166958. PMID 17497315. S2CID 20672988.
- ^ а б Морган С., Андерсон Р.А., Горли С., Уоллес У.Х., Спирс Н. (2012). «Как химиотерапевтические препараты повреждают яичник?». Обновление репродукции человека. 18 (5): 525–35. Дои:10.1093 / humupd / dms022. PMID 22647504.
- ^ Гурган Т., Салман С., Демирол А. (октябрь 2008 г.). «Техника беременности и вспомогательной репродукции у мужчин и женщин после лечения рака». Плацента. 29 Дополнение B: 152–9. Дои:10.1016 / j.placenta.2008.07.007. PMID 18790328.
- ^ Courbiere B, Decanter C, Bringer-Deutsch S, Rives N, Mirallié S, Pech JC, De Ziegler D, Carré-Pigeon F, May-Panloup P, Sifer C, Amice V, Schweitzer T, Porcu-Buisson G, Poirot C (Сентябрь 2013). «Экстренное ЭКО для замораживания эмбрионов для сохранения женской фертильности: французское многоцентровое когортное исследование». Репродукция человека. 28 (9): 2381–8. Дои:10.1093 / humrep / det268. PMID 23832792.
- ^ Ронесс Х, Калич-Философ Л, Мейроу Д. (2014). «Профилактика повреждения яичников, вызванного химиотерапией: возможные роли гормональных и негормональных ослабляющих агентов». Обновление репродукции человека. 20 (5): 759–74. Дои:10.1093 / humupd / dmu019. PMID 24833728.
- ^ Тичелли А., Рово А. (август 2013 г.). «Проблемы с фертильностью после трансплантации гемопоэтических стволовых клеток». Экспертный обзор гематологии. 6 (4): 375–88. Дои:10.1586/17474086.2013.816507. PMID 23991924. S2CID 25139582.
В свою очередь цитируя: Сандерс Дж. Э., Хоули Дж., Леви В., Гули Т., Бакнер С. Д., Диг Х. Дж., Дони К., Сторб Р., Салливан К., Уизерспун Р., Аппельбаум ФР (апрель 1996 г.). «Беременность после приема высоких доз циклофосфана с или без высоких доз бусульфана или облучения всего тела и трансплантации костного мозга». Кровь. 87 (7): 3045–52. Дои:10.1182 / blood.V87.7.3045.bloodjournal8773045. PMID 8639928. - ^ а б c d е ж Арнон Дж, Мейроу Д., Льюис-Ронесс Х, Орной А. (2001). «Генетические и тератогенные эффекты лечения рака на гаметы и эмбрионы». Обновление репродукции человека. 7 (4): 394–403. Дои:10.1093 / humupd / 7.4.394. PMID 11476352. [1]
- ^ а б дель Пино BM (23 февраля 2010 г.). «Периферическая нейропатия, вызванная химиотерапией». Бюллетень NCI Cancer Bulletin. 7 (4): 6.
- ^ Гризольд В., Оберндорфер С., Windebank AJ (2012). «Химиотерапия и полинейропатии» (PDF). Журнал Европейской ассоциации нейроонкологов. 12 (1).
- ^ Бейерс AJ, Jongen JL, Vreugdenhil G (январь 2012 г.). «Нейротоксичность, вызванная химиотерапией: значение нейрозащитных стратегий». Нидерландский медицинский журнал. 70 (1): 18–25. PMID 22271810. Архивировано из оригинал 3 декабря 2013 г.
- ^ а б Windebank AJ, Grisold W (март 2008 г.). «Невропатия, вызванная химиотерапией». Журнал периферической нервной системы. 13 (1): 27–46. Дои:10.1111 / j.1529-8027.2008.00156.x. PMID 18346229. S2CID 20411101.
- ^ Savage L (июль 2007 г.). "Боль, вызванная химиотерапией, ставит ученых в тупик". Журнал Национального института рака. 99 (14): 1070–1. Дои:10.1093 / jnci / djm072. PMID 17623791.
- ^ Tannock IF, Ahles TA, Ganz PA, Van Dam FS (июнь 2004 г.). «Когнитивные нарушения, связанные с химиотерапией рака: отчет семинара». Журнал клинической онкологии. 22 (11): 2233–9. Дои:10.1200 / JCO.2004.08.094. PMID 15169812. Архивировано из оригинал 17 сентября 2012 г.
- ^ Шейх А.Ю., Ши Дж.А. (июнь 2012 г.). «Кардиотоксичность, вызванная химиотерапией». Текущие отчеты о сердечной недостаточности. 9 (2): 117–27. Дои:10.1007 / s11897-012-0083-у. PMID 22382639. S2CID 35723897.
- ^ Татишетти А.В., Агрести Н., О'Брайен С.Б. (ноябрь 2013 г.). «Гепатотоксичность, вызванная химиотерапией». Клиники болезней печени. 17 (4): 671–86, ix – x. Дои:10.1016 / j.cld.2013.07.010. PMID 24099024.
- ^ Король П.Д., Перри М.С. (2001). «Гепатотоксичность химиотерапии». Онколог. 6 (2): 162–76. Дои:10.1634 / теонколог. 6-2-162. PMID 11306728.
- ^ де Йонге MJ, Verweij J (февраль 2006 г.). «Почечная токсичность химиотерапии». Семинары по онкологии. 33 (1): 68–73. Дои:10.1053 / j.seminoncol.2005.11.011. PMID 16473645.
- ^ Хамфрис Б.Д., Сойфер Р.Дж., Маги С.К. (январь 2005 г.). «Почечная недостаточность, связанная с раком, и ее лечение: обновленная информация». Журнал Американского общества нефрологов. 16 (1): 151–61. Дои:10.1681 / ASN.2004100843. PMID 15574506.
- ^ Брок П.Р., Найт К.Р., Фрейер Д.Р., Кэмпбелл К.С., Штайгер П.С., Блэкли Б.В. и др. (Июль 2012 г.). «Вызванная платиной ототоксичность у детей: согласованный обзор механизмов, предрасположенности и защиты, включая новую шкалу ототоксичности Международного общества детской онкологии в Бостоне». Журнал клинической онкологии. 30 (19): 2408–17. Дои:10.1200 / JCO.2011.39.1110. ЧВК 3675696. PMID 22547603.
- ^ Рыбак Л.П., Мукерджа Д., Джаджу С., Рамкумар В. (ноябрь 2009 г.). «Ототоксичность и защита цисплатина: клинические и экспериментальные исследования». Журнал экспериментальной медицины Тохоку. 219 (3): 177–86. Дои:10.1620 / tjem.219.177. ЧВК 2927105. PMID 19851045.
- ^ ван Ас JW, ван ден Берг Х., ван Дален ЕС (январь 2020 г.). «Различная продолжительность инфузии для предотвращения потери слуха у онкологических детей, вызванной платиной». Кокрановская база данных систематических обзоров. 1: CD010885. Дои:10.1002 / 14651858.CD010885.pub5. ЧВК 6984653. PMID 31961948.
- ^ van As JW, van den Berg H, van Dalen EC (август 2016 г.). «Потеря слуха, вызванная платиной, после лечения детского рака». Кокрановская база данных систематических обзоров (8): CD010181. Дои:10.1002 / 14651858.cd010181.pub2. ЧВК 6466671. PMID 27486906.
- ^ van As JW, van den Berg H, van Dalen EC (май 2019 г.). «Медицинские вмешательства для профилактики потери слуха у онкологических детей, вызванной платиной». Кокрановская база данных систематических обзоров. 5: CD009219. Дои:10.1002 / 14651858.cd009219.pub5. ЧВК 6504134. PMID 31063591.
- ^ Уорд EJ, Генри Л.М., друг AJ, Wilkins S, Phillips RS (август 2015 г.). «Нутриционная поддержка детей и молодых людей с онкологическими заболеваниями, проходящих химиотерапию». Кокрановская база данных систематических обзоров (8): CD003298. Дои:10.1002 / 14651858.cd003298.pub3. PMID 26301790.
- ^ Уикс Дж. К., Каталано П. Дж., Кронин А., Финкельман М. Д., Мак Дж. В., Китинг Н. Л., Шраг Д. (октябрь 2012 г.). «Ожидания пациентов относительно эффектов химиотерапии при запущенном раке». Медицинский журнал Новой Англии. 367 (17): 1616–25. Дои:10.1056 / NEJMoa1204410. ЧВК 3613151. PMID 23094723.
- ^ Дикен Дж. Ф., Лёшер В. (март 2007 г.). «Гематоэнцефалический барьер и рак: переносчики, лечение и троянские кони». Клинические исследования рака. 13 (6): 1663–74. Дои:10.1158 / 1078-0432.CCR-06-2854. PMID 17363519.
- ^ Агарвала СС, Кирквуд Дж. М. (2000). «Темозоломид, новый алкилирующий агент с активностью в центральной нервной системе, может улучшить лечение запущенной метастатической меланомы». Онколог. 5 (2): 144–51. Дои:10.1634 / теонколог.5-2-144. PMID 10794805.
- ^ Герстнер Э. Р., Файн Р. Л. (июнь 2007 г.). «Повышенная проницаемость гематоэнцефалического барьера для химиотерапии при метастатических опухолях головного мозга: создание парадигмы лечения». Журнал клинической онкологии. 25 (16): 2306–12. Дои:10.1200 / JCO.2006.10.0677. PMID 17538177.
- ^ Минчинтон А.И., Таннок И.Ф. (август 2006 г.). «Проникновение лекарств в солидные опухоли». Обзоры природы. Рак. 6 (8): 583–92. Дои:10.1038 / nrc1893. PMID 16862189. S2CID 42818461.
- ^ Goldman B (февраль 2003 г.). «Множественная лекарственная устойчивость: могут ли новые лекарства помочь химиотерапии против рака?». Журнал Национального института рака. 95 (4): 255–7. Дои:10.1093 / jnci / 95.4.255. PMID 12591977.
- ^ Кроули Э., Макдевитт CA, Каллаган Р. (2009). Множественная лекарственная устойчивость при раке. Генерация ингибиторов P-гликопротеина: куда теперь?. Протоколы Springer. С. 405–432.
- ^ Лукмани Ю.А. (2005). «Механизмы лекарственной устойчивости при химиотерапии рака». Медицинские принципы и практика. 14 Дополнение 1: 35–48. Дои:10.1159/000086183. PMID 16103712.
- ^ Moschovi M, Critselis E, Cen O, Adamaki M, Lambrou GI, Chrousos GP, Vlahopoulos S (2015). «Лекарства, влияющие на гомеостаз: бросая вызов адаптации раковых клеток». Экспертный обзор противоопухолевой терапии. 15 (12): 1405–17. Дои:10.1586/14737140.2015.1095095. PMID 26523494. S2CID 28992964.
- ^ Хиви С., Годвин П., Бэрд А.М., Барр М.П., Умезава К., Каффе С. и др. (Октябрь 2014 г.). «Стратегическое нацеливание на ось PI3K-NFκB в цисплатин-резистентном НМРЛ». Биология и терапия рака. 15 (10): 1367–77. Дои:10.4161 / cbt.29841. ЧВК 4130730. PMID 25025901.
- ^ Райан С.Л., Берд С., Барр М.П., Умедзава К., Хиви С., Годвин П. и др. (Сентябрь 2019 г.). «Нацеленность на NF-κB-опосредованные воспалительные пути в цисплатин-резистентном НМРЛ» (PDF). Рак легких. 135: 217–227. Дои:10.1016 / j.lungcan.2019.07.006. PMID 31446998.
- ^ Годвин П., Бэрд А.М., Хиви С., Барр М.П., О'Бирн К.Дж., Гейтли К. (2013). «Нацеленность на ядерный фактор-каппа B для преодоления устойчивости к химиотерапии». Границы онкологии. 3: 120. Дои:10.3389 / fonc.2013.00120. ЧВК 3655421. PMID 23720710.
- ^ Гербер Д.Е. (февраль 2008 г.). «Таргетная терапия: новое поколение методов лечения рака». Американский семейный врач. 77 (3): 311–9. PMID 18297955.
- ^ Аллен TM (октябрь 2002 г.). «Лиганд-таргетная терапия в противоопухолевой терапии». Обзоры природы. Рак. 2 (10): 750–63. Дои:10.1038 / nrc903. PMID 12360278. S2CID 21014917.
- ^ Чен Х.Х., Клек Дж. Н. (август 2009 г.). «Побочные эффекты противоопухолевых агентов, нацеленных на путь VEGF». Обзоры природы. Клиническая онкология. 6 (8): 465–77. Дои:10.1038 / nrclinonc.2009.94. PMID 19581909. S2CID 30482752.
- ^ Чжан Дж., Ян П.Л., Грей Н.С. (январь 2009 г.). «Нацеливание на рак с помощью низкомолекулярных ингибиторов киназы». Обзоры природы. Рак. 9 (1): 28–39. Дои:10.1038 / nrc2559. PMID 19104514. S2CID 17934366.
- ^ Ханахан Д., Вайнберг Р.А. (январь 2000 г.). «Признаки рака». Клетка. 100 (1): 57–70. Дои:10.1016 / S0092-8674 (00) 81683-9. PMID 10647931. S2CID 1478778.
- ^ Ходжсон С (январь 2008 г.). «Механизмы наследственной предрасположенности к раку». Журнал науки B Чжэцзянского университета. 9 (1): 1–4. Дои:10.1631 / jzus.B073001. ЧВК 2170461. PMID 18196605.
- ^ Перера FP (ноябрь 1997 г.). «Окружающая среда и рак: кому подвержены?». Наука. 278 (5340): 1068–73. Bibcode:1997Научный ... 278.1068П. Дои:10.1126 / science.278.5340.1068. PMID 9353182.
- ^ Хоскинс В.Дж., Перес К.А., Янг Р.С., Баракат Р.Р., Маркман М., Рэндалл М.Э., ред. (2005). Принципы и практика гинекологической онкологии (4-е изд.). Балтимор, штат Мэриленд: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-4689-2.
- ^ Кехе К., Бальшувейт Ф., Штейнриц Д., Тирманн Х. (сентябрь 2009 г.). «Молекулярная токсикология кожного воспаления и образования пузырей, вызванных серным ипритом». Токсикология. 263 (1): 12–9. Дои:10.1016 / j.tox.2009.01.019. PMID 19651324.
- ^ Макин Дж., Хикман Дж. А. (июль 2000 г.). «Апоптоз и химиотерапия рака». Исследования клеток и тканей. 301 (1): 143–52. Bibcode:1994РСПТБ.345..319Х. Дои:10.1007 / s004419900160. PMID 10928287. S2CID 22909070.
- ^ Зитвогель Л., Апето Л., Гирингелли Ф., Кремер Г. (январь 2008 г.). «Иммунологические аспекты химиотерапии рака». Обзоры природы. Иммунология. 8 (1): 59–73. Дои:10.1038 / nri2216. PMID 18097448. S2CID 205490545.
- ^ Галлуцци Л., Буке А., Кепп О., Цитвогель Л., Кремер Г. (февраль 2017 г.). «Иммуногенная смерть клеток при раке и инфекционных заболеваниях». Обзоры природы. Иммунология. 17 (2): 97–111. Дои:10.1038 / нет.2016.107. PMID 27748397. S2CID 4045072.
- ^ Pfirschke C, Engblom C, Rickelt S, Cortez-Retamozo V, Garris C, Pucci F, Yamazaki T, Poirier-Colame V, Newton A, Redouane Y, Lin YJ, Wojtkiewicz G, Iwamoto Y, Mino-Kenudson M, Huynh T.G. , Хайнс Р.О., Фриман Г.Дж., Кремер Г., Зитвогель Л., Вайследер Р., Питтет М.Дж. (февраль 2016 г.). «Иммуногенная химиотерапия делает опухоли чувствительными к терапии блокадой контрольных точек». Иммунитет. 44 (2): 343–54. Дои:10.1016 / j.immuni.2015.11.024. ЧВК 4758865. PMID 26872698.
- ^ а б Бен-Ари ET (апрель 2004 г.). «Двойное назначение: некоторые методы лечения рака, используемые для лечения аутоиммунных заболеваний» (PDF). Журнал Национального института рака. 96 (8): 577–9. Дои:10.1093 / jnci / 96.8.577. PMID 15100330.
- ^ а б Кутоло М., Солли А., Пиццорни С., Сериоло Б., Штрауб Р. Х. (август 2001 г.). «Противовоспалительные механизмы метотрексата при ревматоидном артрите». Анналы ревматических болезней. 60 (8): 729–35. Дои:10.1136 / ard.60.8.729. ЧВК 1753808. PMID 11454634.
- ^ Montaudié H, Sbidian E, Paul C, Maza A, Gallini A, Actingi S, Aubin F, Bachelez H, Cribier B, Joly P, Jullien D, Le Maître M, Misery L, Richard MA, Ortonne JP (май 2011 г.). «Метотрексат при псориазе: систематический обзор методов лечения, заболеваемости, факторов риска и мониторинга токсичности для печени». Журнал Европейской академии дерматологии и венерологии. 25 Дополнение 2: 12–8. Дои:10.1111 / j.1468-3083.2011.03991.x. PMID 21388454. S2CID 13015911.
- ^ а б Чен Дж., Верас М.М., Лю Ц., Лин Дж. (Февраль 2013 г.). Чен Дж (ред.). «Метотрексат при анкилозирующем спондилите». Кокрановская база данных систематических обзоров. 2 (2): CD004524. Дои:10.1002 / 14651858.CD004524.pub4. PMID 23450553.
- ^ а б Грей О, МакДоннелл Г.В., Форбс РБ (2004). Серый О. (ред.). «Метотрексат от рассеянного склероза». Кокрановская база данных систематических обзоров (2): CD003208. Дои:10.1002 / 14651858.CD003208.pub2. PMID 15106195.
- ^ а б Gray OM, McDonnell GV, Forbes RB (август 2006 г.). «Систематический обзор перорального метотрексата при рассеянном склерозе». Рассеянный склероз. 12 (4): 507–10. Дои:10.1191 / 1352458506ms1299oa. PMID 16900766. S2CID 46120577.
- ^ Нтали С., Берциас Г., Бумпас Д. Т. (июнь 2011 г.). «Циклофосфамид и волчаночный нефрит: когда, как, как долго?». Клинические обзоры по аллергии и иммунологии. 40 (3): 181–91. Дои:10.1007 / s12016-009-8196-0. PMID 20107927. S2CID 11902371.
- ^ «Рекомендации NCCN: системный амилоидоз легких цепей» (PDF). Национальная комплексная онкологическая сеть.
- ^ Бачигалупо А., Баллен К., Риццо Д., Гиралт С., Лазарус Х., Хо В., Апперли Дж., Славин С., Паскини М., Сандмайер Б.М., Барретт Дж., Блез Д., Ловски Р., Горовиц М. (декабрь 2009 г.). «Определение интенсивности режимов кондиционирования: рабочие определения». Биология трансплантации крови и костного мозга. 15 (12): 1628–33. Дои:10.1016 / j.bbmt.2009.07.004. ЧВК 2861656. PMID 19896087.
- ^ Сорса М., Хямейла М., Ярвилуома Е. (сентябрь 2006 г.). «Обращение с противоопухолевыми препаратами: от выявления опасностей до управления рисками?». Летопись Нью-Йоркской академии наук. 1076 (1): 628–34. Bibcode:2006НЯСА1076..628С. Дои:10.1196 / Анналы.1371.008. PMID 17119240. S2CID 7081365.
- ^ а б c d е Томас х. Коннор, доктор философии (март 2014 г.). «Химиотерапия: биомаркеры воздействия, воздействия, репродуктивной опасности и рака». Фармацевт-онколог.
- ^ а б «Средства индивидуальной защиты для медицинских работников, работающих с опасными лекарственными средствами». 2008. Дои:10.26616 / NIOSHPUB2009106. Цитировать журнал требует
| журнал =(помощь) - ^ Противоопухолевые препараты: профессиональное воздействие и риски для здоровья. 2006. ISBN 978-90-393-4331-9.
- ^ а б c «предотвращение профессионального воздействия противоопухолевых и других опасных препаратов в медицинских учреждениях» (PDF).
- ^ «Руководства по программе по опасным наркотикам». www.lni.wa.gov. Получено 22 ноября 2018.
- ^ Рейнхардт, Питер А. (29 ноября 2017 г.). Управление инфекционными и медицинскими отходами. ISBN 9781315894430.[страница нужна ]
- ^ «Безопасное обращение с отходами медицинской деятельности» (PDF). ВОЗ.
- ^ ДеДжой Д.М., Смит Т.Д., Вольду Х., Дьял М.А., Стидж А.Л., Бойано Дж. М. (июль 2017 г.). «Влияние организационной практики безопасности и воспринимаемого климата безопасности на использование СИЗ, технический контроль и неблагоприятные события, связанные с жидкими противоопухолевыми препаратами среди медсестер». Журнал гигиены труда и окружающей среды. 14 (7): 485–493. Дои:10.1080/15459624.2017.1285496. PMID 28326998. S2CID 3879822.
- ^ Ян Олвер (19 октября 2010 г.). Учебник MASCC по поддерживающей терапии и выживанию при раке. Springer Science & Business Media. п. 351. ISBN 978-1-4419-1225-1.
- ^ Холланд Дж. Ф., Поллок Р. Е. (2010). Онкологическая медицина Holland-Frei 8. PMPH-США. п. 1758. ISBN 978-1-60795-014-1.
- ^ Крумбхаар Е.Б. (1919). «Роль крови и костного мозга в некоторых формах отравления газами». JAMA. 72: 39–41. Дои:10.1001 / jama.1919.26110010018009f.
- ^ а б c Фенн Дж. Э., Удельсман Р. (март 2011 г.). «Первое применение внутривенной химиотерапии для лечения рака: исправление рекордов». Журнал Американского колледжа хирургов. 212 (3): 413–7. Дои:10.1016 / j.jamcollsurg.2010.10.018. PMID 21247779.
- ^ Чабнер Б.А., Робертс Т.Г. (январь 2005 г.). «Хронология: химиотерапия и война с раком». Обзоры природы. Рак. 5 (1): 65–72. Дои:10.1038 / nrc1529. PMID 15630416. S2CID 205467419.
- ^ Фаге ГБ (2005). Война с раком. Springer. п.71. ISBN 978-1-4020-3618-7.
- ^ Йоэнсуу H (март 2008 г.). «Системная химиотерапия рака: от оружия к лечению». Ланцет. Онкология. 9 (3): 304. Дои:10.1016 / S1470-2045 (08) 70075-5. PMID 18308256.
- ^ а б ДеВита В.Т., Чу Э. (ноябрь 2008 г.). «История химиотерапии рака». Исследования рака. 68 (21): 8643–53. Дои:10.1158 / 0008-5472.CAN-07-6611. PMID 18974103.
- ^ Николс HJ, Уокер JE (март 1923 г.). «Экспериментальные наблюдения по профилактике и лечению сифилиса». Журнал экспериментальной медицины. 37 (4): 525–42. Дои:10.1084 / jem.37.4.525. ЧВК 2128372. PMID 19868743.
- ^ 10 самых продаваемых противораковых препаратов 2013 года; 29 мая, 2014
- ^ а б Чидамбарам М., Манавалан Р., Катиресан К. (2011). «Нанотерапевтические средства для преодоления ограничений традиционной химиотерапии рака». Журнал фармации и фармацевтических наук. 14 (1): 67–77. Дои:10.18433 / J30C7D. PMID 21501554.
- ^ а б Тейчер Б.А., Чари Р.В. (октябрь 2011 г.). «Терапевтические препараты на основе конъюгатов антител: проблемы и потенциал». Клинические исследования рака. 17 (20): 6389–97. Дои:10.1158 / 1078-0432.CCR-11-1417. PMID 22003066.
- ^ Сиверс Е.Л., Линенбергер М. (ноябрь 2001 г.). «Милотарг: химиотерапия, нацеленная на антитела, достигла совершеннолетия». Текущее мнение в области онкологии. 13 (6): 522–7. Дои:10.1097/00001622-200111000-00016. PMID 11673694. S2CID 27827980.
- ^ FDA. «Милотарг (гемтузумаб озогамицин): уход с рынка». Получено 18 августа 2013.
- ^ Вайнс Т, Фаунс Т (май 2009 г.). «Оценка безопасности и экономической эффективности ранних нанопрепаратов». Журнал права и медицины. 16 (5): 822–45. PMID 19554862.
- ^ Хеллер Р., Гилберт Р., Ярошески М.Дж. (январь 1999 г.). «Клинические применения электрохимиотерапии». Расширенные обзоры доставки лекарств. 35 (1): 119–129. Дои:10.1016 / S0169-409X (98) 00067-2. PMID 10837693.
- ^ Ларкин Дж.О., Коллинз К.Г., Ааронс С., Тангни М., Уилан М., О'Рейли С., Бретнах О, Соден Д.М., О'Салливан Г.К. (март 2007 г.). «Электрохимиотерапия: аспекты доклинической разработки и ранний клинический опыт». Анналы хирургии. 245 (3): 469–79. Дои:10.1097 / 01.sla.0000250419.36053.33. ЧВК 1877027. PMID 17435555.
- ^ а б Marty M, Sersa G, Garbay JR, Gehl J, Collins CG, Snoj M, Billard V, Geertsen PF, Larkin JO, Miklavcic D, Pavlovic I, Paulin-Kosir SM, Cemazar M, Morsli N, Soden DM, Rudolf Z, Роберт К., О'Салливан Г.К., Мир Л.М. (2006). «Электрохимиотерапия - простое, высокоэффективное и безопасное лечение кожных и подкожных метастазов». Eur J Cancer Suppl. 4 (11): 3–13. Дои:10.1016 / j.ejcsup.2006.08.002.
- ^ Мёллер М.Г., Салва С., Соден Д.М., О'Салливан Г.К. (ноябрь 2009 г.). «Электрохимиотерапия в качестве дополнения или альтернативы другим методам лечения неоперабельной или транзитной меланомы». Экспертный обзор противоопухолевой терапии. 9 (11): 1611–30. Дои:10.1586 / эра.09.129. PMID 19895245. S2CID 1630835.
- ^ Тестори А., Тости Дж., Мартиноли С., Спадола Дж., Катальдо Ф, Верреккья Ф, Бальдини Ф, Москони М, Сотельдо Дж, Тедески I, Пассони С., Пари С., Ди Пьетро А., Ферруччи П. Ф. (2010). «Электрохимиотерапия кожных и подкожных опухолевых поражений: новый терапевтический подход». Дерматологическая терапия. 23 (6): 651–61. Дои:10.1111 / j.1529-8019.2010.01370.x. PMID 21054709. S2CID 46534637.
- ^ Хэмптон Т. (февраль 2011 г.). «Электрические импульсы помогают при химиотерапии, могут открыть новые пути для других агентов». JAMA. 305 (6): 549–51. Дои:10.1001 / jama.2011.92. PMID 21304073.
- ^ Мир Л.М., Гейл Дж., Серса Дж., Коллинз К.Г., Гарбай Дж. Р., Биллард В., Герцен П.Ф., Рудольф З., О'Салливан Г.К., Марти М. (2006). «Стандартные операционные процедуры электрохимиотерапии: инструкции по применению блеомицина или цисплатина, вводимого системно или местно, и электрические импульсы, доставляемые Cliniporator ™ с помощью инвазивных или неинвазивных электродов». Eur J Cancer Suppl. 4 (11): 14–25. Дои:10.1016 / j.ejcsup.2006.08.003.
- ^ Соден Д.М., Ларкин Дж.О., Коллинз К.Г., Тэнни М., Ааронс С., Пигготт Дж., Моррисси А., Данн С., О'Салливан Г.К. (февраль 2006 г.). «Успешное применение целевой электрохимиотерапии с использованием новых гибких электродов и низких доз блеомицина для солидных опухолей». Письма о раке. 232 (2): 300–10. Дои:10.1016 / j.canlet.2005.03.057. PMID 15964138.
- ^ Miklavcic D, Snoj M, Zupanic A, Kos B, Cemazar M, Kropivnik M, Bracko M, Pecnik T., Gadzijev E, Sersa G (февраль 2010 г.). «К планированию лечения и лечению глубоких солидных опухолей с помощью электрохимиотерапии». Биомедицинская инженерия онлайн. 9 (1): 10. Дои:10.1186 / 1475-925X-9-10. ЧВК 2843684. PMID 20178589.
- ^ Исселс Р. (1999). «Гипертермия в сочетании с химиотерапией - биологическое обоснование, клиническое применение и результаты лечения» (PDF). Онкология. 22 (5): 374–381. Дои:10.1159/000026986. S2CID 37581171.
- ^ Макнайт Дж. А. (май 2003 г.). «Принципы химиотерапии». Клинические методы в практике мелких животных. 18 (2): 67–72. Дои:10.1053 / svms.2003.36617. PMID 12831063. S2CID 39060053.
