Генотоксичность - Genotoxicity
В генетика, генотоксичность описывает свойство химических агентов, которые повреждают генетическую информацию внутри клетки, вызывая мутации, что может привести к рак. Хотя генотоксичность часто путают с мутагенностью, все мутагены генотоксичны, в то время как не все генотоксические вещества являются мутагенными. Изменение может иметь прямое или косвенное воздействие на ДНК: индукцию мутаций, активацию несвоевременного события и прямое повреждение ДНК, ведущее к мутациям. Постоянные наследственные изменения могут повлиять на соматические клетки организма или стволовые клетки для передачи будущим поколениям.[1] Клетки предотвращают экспрессию генотоксической мутации либо Ремонт ДНК или апоптоз; однако повреждения не всегда можно устранить, что приведет к мутагенез.
Чтобы проба Что касается генотоксичных молекул, исследователи исследуют повреждения ДНК в клетках, подвергшихся воздействию токсичных субстратов. Это повреждение ДНК может быть в форме одно- и двухцепочечных разрывов, потери эксцизионной репарации, перекрестного сшивания, щелочно-лабильных участков, точечных мутаций, а также структурных и числовых хромосомных аберраций.[2] Известно, что нарушение целостности генетического материала вызывает рак. Как следствие, многие сложные методы, включая анализ Эймса, in vitro и in vivo Были разработаны токсикологические тесты и анализ комет для оценки способности химических веществ вызывать повреждение ДНК, которое может привести к раку.
Механизмы

Генотоксические вещества вызывают повреждение генетического материала в клетках за счет взаимодействия с последовательностью и структурой ДНК. Например, переходный металл хром взаимодействует с ДНК в своей высоковалентной степени окисления, вызывая повреждения ДНК, приводящие к канцерогенез. Метастабильная степень окисления Cr (V) достигается за счет восстановительной активации. Исследователи провели эксперимент по изучению взаимодействия ДНК с канцерогенным хромом с использованием комплекса Cr (V) -Salen в определенной степени окисления.[3] Взаимодействие было характерно для гуанин нуклеотид в генетической последовательности. Чтобы сузить взаимодействие комплекса Cr (V) -Salen с основанием гуанина, исследователи модифицировали основания до 8-оксо-G, чтобы обеспечить сайт-специфическое окисление. Реакция между двумя молекулами вызвала повреждения ДНК; два поражения, наблюдаемые на модифицированном участке основания, были гуанидиногидантоином и спироиминодигидантоином. Для дальнейшего анализа участка поражения было замечено, что полимераза остановилась на этом участке и аденин был неправильно включен в последовательность ДНК, противоположную основанию 8-оксо-G. Следовательно, эти поражения преимущественно содержат G -> T трансверсии. Считается, что высоковалентный хром действует как канцероген, поскольку исследователи обнаружили, что «механизм повреждения и продукты окисления оснований для взаимодействия между высоковалентным хромом и ДНК ... имеют отношение к in vivo образование повреждений ДНК, ведущих к раку, в человеческих популяциях, подвергшихся воздействию хроматов ".[3] Следовательно, это показывает, как высокомалентный хром может действовать как канцероген с образованием 8-оксо-G. ксенобиотики.[3]
Другой пример генотоксического вещества, вызывающего повреждение ДНК: пирролизидиновые алкалоиды (ПА). Эти вещества содержатся в основном в растениях и ядовиты для животных, включая человека; около половины из них были идентифицированы как генотоксичные, а многие - как канцерогенные. В результате тестирования исследователи пришли к выводу, что при метаболической активации «ПА продуцируют аддукты ДНК, сшивание ДНК, разрывы ДНК, обмен сестринскими хроматидами, микроядра, хромосомные аберрации, генные мутации и хромосомные мутации. in vivo и in vitro."[4] Наиболее частыми мутациями в генах являются трансформации G: C -> T: A и тандемная замена оснований. Пирролизидиновые алкалоиды обладают мутагенным действием. in vivo и in vitro и, следовательно, ответственны за канцерогенез в печени.[4] Окопник является примером вида растений, который содержит четырнадцать различных PA. Активные метаболиты взаимодействуют с ДНК, вызывая повреждение ДНК, индукцию мутации и развитие рака печени. эндотелиальные клетки и гепатоциты. В конце концов, исследователи обнаружили, что «окопник оказывает мутагенное действие на печень, а PA, содержащийся в окопнике, по-видимому, ответственен за токсичность, вызванную окопником, и за индукцию опухоли».[5]
Методы испытаний
Целью тестирования на генотоксичность является определение того, будет ли субстрат влиять на генетический материал или может вызвать рак. Их можно проводить в клетках бактерий, дрожжей и млекопитающих.[2] Обладая знаниями, полученными в ходе испытаний, можно контролировать раннее развитие организмов, уязвимых к генотоксическим веществам.[1]
Бактериальный анализ обратной мутации
Бактериальный анализ обратной мутации, также известный как Анализ Эймса, используется в лабораториях для проверки на мутации гена. В методе используется множество различных бактериальных штаммов, чтобы сравнить различные изменения в генетическом материале. Результат теста обнаруживает большинство генотоксичных канцерогены и генетические изменения; типы обнаруженных мутаций кадровые сдвиги и замены оснований.[6]
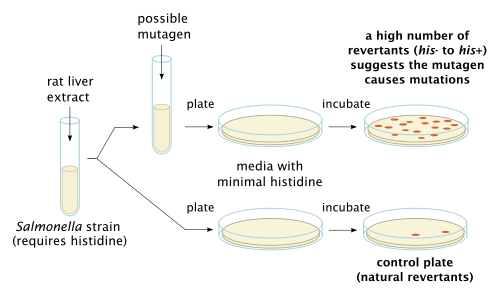
in vitro токсикологические испытания
Цель in vitro Тестирование предназначено для определения того, вызывает ли субстрат, продукт или фактор окружающей среды генетический ущерб. Один из методов включает цитогенетические анализы с использованием различных клеток млекопитающих.[6] Типы аберрации В клетках, пораженных генотоксическим веществом, обнаруживаются хроматидные и хромосомные разрывы, хромосомные разрывы, делеции хроматид, фрагментация, транслокация, сложные перестройки и многое другое. В кластогенный или аневгенический последствия генотоксического повреждения вызовут увеличение частоты структурных или числовых аберраций генетического материала.[6] Это похоже на микроядерный тест и анализ хромосомных аберраций, который обнаруживает структурные и числовые хромосомные аберрации в клетках млекопитающих.[1]
В конкретной ткани млекопитающего можно выполнить мышь лимфома TK +/- анализ для проверки изменений в генетическом материале.[6] Генные мутации обычно представляют собой точечные мутации, изменяющие только одно основание в генетической последовательности, чтобы изменить последующий транскрипт и аминокислотную последовательность; эти точечные мутации включают замены оснований, делеции, сдвиги рамки считывания и перестройки. Также, хромосомы ' целостность может быть нарушена из-за потери хромосом и кластогенного поражения вызывая множественные генные и мультилокусные делеции. Конкретный тип повреждения определяется размером колоний, различая генетические мутации (мутагены) и хромосомные аберрации (кластогены).[6]
В Тест SOS / umu assay оценивает способность вещества вызывать повреждение ДНК; он основан на изменениях индукции SOS-ответа из-за повреждения ДНК. Преимущества этого метода заключаются в том, что это быстрый и простой метод, удобный для многих веществ. Эти методы применяются для воды и сточных вод в окружающей среде.[7]
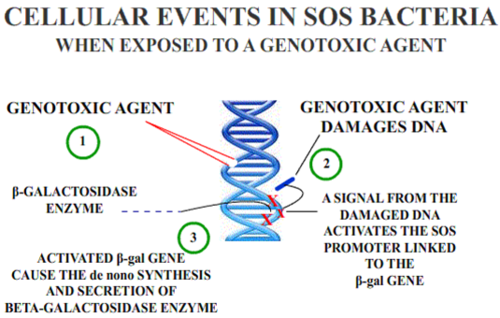
in vivo тестирование
Цель для in vivo Тестирование предназначено для определения возможности повреждения ДНК, которое может повлиять на структуру хромосомы или нарушить митотический аппарат что меняет число хромосом; Факторами, которые могут повлиять на генотоксичность, являются ADME и репарация ДНК. Он также может обнаруживать генотоксические агенты, пропущенные в in vitro тесты. Положительный результат индуцированного хромосомного повреждения - увеличение частоты микронуцеллированных PCE.[6] А микронуклеус представляет собой небольшую структуру, отдельную от ядра, содержащую ядерную ДНК, возникшую из фрагментов ДНК или целых хромосом, которые не были включены в дочернюю клетку во время митоза. Причинами этой структуры являются митотическая потеря ацентрических хромосомных фрагментов (кластогенность), механические проблемы из-за разрыва и обмена хромосом, митотическая потеря хромосом (аневгенность) и апоптоз. Микроядерный тест in vivo похож на in vitro один, потому что он проверяет структурные и численные хромосомные аберрации в клетках млекопитающих, особенно в клетках крови крыс.[6]
Кометный анализ
Анализ комет - один из наиболее распространенных тестов на генотоксичность. Методика включает лизис клеток с использованием детергентов и солей. ДНК, высвобожденную из лизированной клетки, подвергают электрофорезу в агарозном геле в условиях нейтрального pH. Клетки, содержащие ДНК с увеличенным количеством двухцепочечных разрывов, будут быстрее перемещаться к аноду. Преимущество этого метода состоит в том, что он обнаруживает низкие уровни повреждений ДНК, требует очень небольшого количества клеток, дешевле, чем многие методы, прост в применении и быстро отображает результаты. Однако он не определяет механизм, лежащий в основе генотоксического эффекта, или точный химический или химический компонент, вызывающий разрывы.[8]
Рак
Генотоксические эффекты, такие как делеции, разрывы и / или перестройки, могут привести к раку, если повреждение не приводит сразу к гибели клеток. Области, чувствительные к поломке, называются хрупкие сайты, может быть результатом действия генотоксичных агентов (например, пестицидов). Некоторые химические вещества обладают способностью вызывать хрупкие участки в тех областях хромосомы, где онкогены присутствуют, что может привести к канцерогенным эффектам. В соответствии с этим выводом, профессиональное воздействие некоторых смесей пестицидов положительно коррелирует с повышенным генотоксическим повреждением людей, подвергшихся воздействию. Повреждение ДНК неодинаково по степени тяжести в разных популяциях, потому что люди различаются по своей способности активировать или детоксифицировать генотоксичные вещества, что приводит к вариабельности заболеваемости раком среди людей. Разница в способности выводить токсины из определенных соединений обусловлена наследственными особенностями человека. полиморфизмы генов, участвующих в метаболизме химического вещества. Различия также можно объяснить индивидуальными различиями в эффективности механизмов репарации ДНК.[9]
В метаболизм некоторых химикатов приводит к производству активные формы кислорода, что является возможным механизмом генотоксичности. Это видно в метаболизме мышьяк, который производит гидроксильные радикалы, которые, как известно, вызывают генотоксические эффекты.[10] Точно так же ROS участвуют в генотоксичности, вызванной частицами и волокнами. Генотоксичность неволокнистых и волокнистых частиц характеризуется высокой продукцией АФК из воспалительные клетки.[11]
Генотоксическая химиотерапия
Генотоксическая химиотерапия - это лечение рака с использованием одного или нескольких генотоксических препаратов. Лечение традиционно является частью стандартизированный режим. Используя разрушительные свойства генотоксинов, лечение направлено на то, чтобы вызвать повреждение ДНК в раковых клетках. Любой ущерб, нанесенный раку, передается потомкам раковых клеток в виде распространение продолжается. Если это повреждение достаточно серьезное, оно заставит клетки подвергнуться апоптоз.[12]
Риски
Недостатком лечения является то, что многие генотоксические препараты одинаково эффективны как на раковые, так и на нормальные клетки. Селективность действия того или иного лекарства основана на чувствительности самих клеток. Таким образом, хотя быстро делящиеся раковые клетки особенно чувствительны ко многим лекарственным препаратам, часто поражаются нормально функционирующие клетки.[12]
Еще один риск лечения заключается в том, что многие препараты не только генотоксичны. мутагенный и цитотоксический. Таким образом, действие этих препаратов не ограничивается только повреждением ДНК. Кроме того, некоторые из этих препаратов, предназначенных для лечения рака, также канцерогены сами по себе, повышая риск вторичного рака, такого как лейкемия.[12]
Различные методы лечения
В этой таблице показаны различные методы лечения рака на основе генотоксичности с примерами.[12]
| лечение | Механизм | Примеры |
|---|---|---|
| Алкилирующие агенты | вмешиваться в репликацию и транскрипцию ДНК путем модификации оснований ДНК. | Бусульфан, Кармустин, Мехлорэтамин |
| Интеркалирующие агенты | мешают репликации и транскрипции ДНК, вклиниваясь в промежутки между нуклеотидами ДНК | Даунорубицин, Доксорубицин, Эпирубицин |
| Ингибиторы ферментов | подавляют ферменты, которые имеют решающее значение для репликации ДНК | Децитабин, Этопозид, Иринотекан |
Смотрите также
использованная литература
- ^ а б c Kolle S (01.06.2012). «Генотоксичность и канцерогенность». BASF Химическая компания. Архивировано из оригинал на 2013-06-28. Получено 2013-03-16.
- ^ а б «Генотоксичность: проверенные альтернативы неживотного происхождения». AltTox.org. 2011-06-20. Получено 2013-03-16.
- ^ а б c Сугден К.Д., Кампо С.К., Мартин Б.Д. (сентябрь 2001 г.). «Прямое окисление гуанина и 7,8-дигидро-8-оксогуанина в ДНК комплексом высокомалентного хрома: возможный механизм генотоксичности хромата». Химические исследования в токсикологии. 14 (9): 1315–22. Дои:10.1021 / tx010088 +. PMID 11559048.
- ^ а б Чен Т., Мей Н, Фу П.П. (апрель 2010 г.). «Генотоксичность пирролизидиновых алкалоидов». Журнал прикладной токсикологии. 30 (3): 183–96. Дои:10.1002 / jat.1504. ЧВК 6376482. PMID 20112250.
- ^ Мэй Н, Го Л., Фу П.П., Фуско Дж. К., Луан И., Чен Т. (октябрь 2010 г.). «Метаболизм, генотоксичность и канцерогенность окопника». Журнал токсикологии и гигиены окружающей среды. Часть B, Критические обзоры. 13 (7–8): 509–26. Дои:10.1080/10937404.2010.509013. ЧВК 5894094. PMID 21170807.
- ^ а б c d е ж г Фурман Г (17 апреля 2008 г.). «Тестирование на генотоксичность фармацевтических препаратов в современной и развивающейся практике» (PDF). Paracelsus, Inc. Архивировано с оригинал (PDF) на 2014-01-16. Получено 2013-03-16.
- ^ Кончар Х (2011). «Тестирование генотоксичности in vitro». Национальный институт биологии. Архивировано из оригинал на 2013-03-07. Получено 2013-03-16.
- ^ Тайс Р.Р., Агурелл Э., Андерсон Д., Бурлинсон Б., Хартманн А., Кобаяши Х. и др. (2000). «Анализ одноклеточного геля / кометы: руководство по генетическому токсикологическому тестированию in vitro и in vivo» (PDF). Экологический и молекулярный мутагенез. 35 (3): 206–21. Дои:10.1002 / (SICI) 1098-2280 (2000) 35: 3 <206 :: AID-EM8> 3.0.CO; 2-J. PMID 10737956.
- ^ Болоньези, Клаудиа (июнь 2003 г.). «Генотоксичность пестицидов: обзор исследований биомониторинга человека». Мутационные исследования. 543 (3): 251–272. Дои:10.1016 / S1383-5742 (03) 00015-2.
- ^ Лю С.Х., Атар М., Липпаи И., Уолдрен К., Хей Т.К. (февраль 2001 г.). «Индукция оксирадикалов мышьяком: значение механизма генотоксичности». Труды Национальной академии наук Соединенных Штатов Америки. 98 (4): 1643–8. Дои:10.1073 / pnas.98.4.1643. ЧВК 29310. PMID 11172004.
- ^ Щинс Р.П. (январь 2002 г.). «Механизмы генотоксичности частиц и волокон». Ингаляционная токсикология. 14 (1): 57–78. Дои:10.1080/089583701753338631. PMID 12122560.
- ^ а б c d Уолш Д. (2011-11-18). «Генотоксические препараты». Cancerquest.org. Архивировано из оригинал на 2013-03-02. Получено 2013-03-16.
дальнейшее чтение
- Jha AN, Cheung VV, Foulkes ME, Hill SJ, Depledge MH (январь 2000 г.). «Обнаружение генотоксинов в морской среде: принятие и оценка комплексного подхода с использованием эмбрионально-личиночных стадий морской мидии Mytilus edulis». Мутационные исследования. 464 (2): 213–28. Дои:10.1016 / с 1383-5718 (99) 00188-6. PMID 10648908.
- Сигель А, Сигель Х, Сигель РК (2011). «Ионы металлов в токсикологии: эффекты, взаимодействия, взаимозависимости». Ионы металлов в науках о жизни. Ионы металлов в науках о жизни. 8: vii – viii. Дои:10.1039/9781849732512. ISBN 978-1-84973-094-5. PMID 21473373.
- Бал В., Протас А.М., Каспрзак К.С. (2011). «Глава 13. Генотоксичность ионов металлов: химические взгляды». В Sigel R, Sigel, Sigel H (ред.). Ионы металлов в токсикологии: эффекты, взаимодействия, взаимозависимости (ионы металлов в науках о жизни). Ионы металлов в науках о жизни. 8. Кембридж, англ .: Королевское химическое общество. С. 319–373. Дои:10.1039/9781849732116-00319. ISBN 978-1-84973-091-4.
- Смит М.Т. (декабрь 1996 г.). «Механизм лейкемии, вызванной бензолом: гипотеза и предположения о причинах лейкемии». Перспективы гигиены окружающей среды. 104 Дополнение 6: 1219–25. Дои:10.1289 / ehp.961041219. ЧВК 1469721. PMID 9118896.
