Гранулоцит - Granulocyte
| Гранулоцит | |
|---|---|
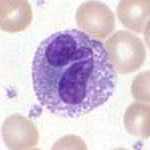 Базофильный гранулоцит. | |
| Подробности | |
| Система | Иммунная система |
| Идентификаторы | |
| MeSH | D006098 |
| FMA | 62854 |
| Анатомические термины микроанатомии | |
Гранулоциты являются категорией белые кровяные клетки в врожденная иммунная система характеризуется наличием специфические гранулы в их цитоплазма.[1] Их еще называют полиморфноядерные лейкоциты (PMN, PML, или же PMNL) из-за различной формы ядро, который обычно делится на три сегмента. Это отличает их от одноядерных агранулоциты. Период, термин полиморфноядерный лейкоцит часто ссылается конкретно на "нейтрофил гранулоциты »,[2] самый обильный из гранулоцитов; другие типы (эозинофилы, базофилы, и тучные клетки ) имеют меньшее количество долей. Гранулоциты производятся гранулопоэз в Костный мозг.
Типы
Существует четыре типа гранулоцитов (полное название полиморфноядерные гранулоциты):[3]
За исключением тучных клеток, их названия происходят от их окрашивание характеристики; например, самый распространенный гранулоцит - это нейтрофильный гранулоцит, имеющий нейтральную окраску цитоплазматический гранулы.
Нейтрофилов

Нейтрофилы обычно находятся в кровоток и являются наиболее распространенным типом фагоцит, составляющие от 60% до 65% от общего количества циркулирующих лейкоцитов,[4] и состоящий из двух субпопуляции: нейтрофилы-киллеры и нейтрофилы-клетки. В одном литре человеческой крови содержится около пяти миллиардов (5х109) нейтрофилы,[5] которые примерно 12–15 микрометры в диаметре.[6] Как только нейтрофилы получили соответствующие сигналы, им требуется около тридцати минут, чтобы покинуть кровь и достичь места инфекции.[7] Нейтрофилы не возвращаются в кровь; они превращаются в гной клетки и умирают.[7] Зрелые нейтрофилы меньше моноцитов и имеют сегментированный ядро с несколькими секциями (от двух до пяти сегментов); каждый раздел связан хроматин нити. Нейтрофилы обычно не выходят из костного мозга до зрелости, но во время инфекции предшественники нейтрофилов, называемые миелоциты и промиелоциты выпущены.[8]
У нейтрофилов есть три стратегии для прямого нападения на микроорганизмы: фагоцитоз (проглатывание), высвобождение растворимых антимикробных средств (включая белки гранул) и образование внеклеточные ловушки нейтрофилов (NET).[9]Нейтрофилы профессиональные фагоциты:[10] они свирепые поедатели и быстро поглощают захватчиков, покрытые антитела и дополнять, а также поврежденные клетки или клеточный мусор. Внутриклеточные гранулы нейтрофилов человека давно известны своими разрушающими белки и бактерицидными свойствами.[11] Нейтрофилы могут секретировать продукты, стимулирующие моноциты и макрофаги; эти выделения увеличивают фагоцитоз и образование активных кислородных соединений, участвующих во внутриклеточном уничтожении.[12]
Нейтрофилы имеют два типа гранул; первичные (азурофильные) гранулы (обнаруживаются в молодых клетках) и вторичные (специфические) гранулы (которые находятся в более зрелых клетках). Первичные гранулы содержат катионные белки и дефенсины которые используются для уничтожения бактерий, протеолитических ферментов и катепсина G для расщепления (бактериальных) белков, лизоцима для расщепления бактериальных клеточные стенки, и миелопероксидаза (используется для производства токсичных веществ, убивающих бактерии).[13] Кроме того, выделения из первичные гранулы нейтрофилов стимулируют фагоцитоз IgG бактерии, покрытые антителами.[14] Вторичные гранулы содержат соединения, которые участвуют в образовании токсичных веществ. кислородные соединения, лизоцим и лактоферрин (раньше принимал необходимые утюг от бактерий).[13] Внеклеточные ловушки нейтрофилов (NET) представляют собой сеть волокон, состоящих из хроматин и сериновые протеазы которые захватывают и убивают микробы внеклеточно. Улавливание бактерий является особенно важной ролью NET при сепсисе, когда NET образуются внутри кровеносных сосудов.[15]
Эозинофилы
Эозинофилы также имеют почковидную форму. дольчатый ядра (от двух до четырех долей). Количество гранул в эозинофиле может варьироваться, поскольку они имеют тенденцию к дегранулировать находясь в кровотоке.[16] Эозинофилы играют решающую роль в уничтожении паразитов (например, кишечных нематод), поскольку их гранулы содержат уникальный токсичный основной белок и катионный белок (например, катепсин[13]);[17] рецепторы, которые связываются с IgE используются, чтобы помочь с этой задачей.[18] Эти клетки также имеют ограниченную способность участвовать в фагоцитозе,[19] они являются профессиональными антигенпрезентирующими клетками, они регулируют другие функции иммунных клеток (например, CD4 + Т-клетки, дендритная клетка, В клетка, тучная клетка, нейтрофил, и базофил функции),[20] они участвуют в разрушении опухолевых клеток,[16] и они способствуют восстановлению поврежденных тканей.[21] Полипептид под названием интерлейкин-5 взаимодействует с эозинофилами и заставляет их расти и дифференцироваться; этот полипептид продуцируется базофилами и Т-хелперами 2 (TH2).[17]
Базофилы

Базофилы - одни из наименее распространенных клеток в Костный мозг и кровь (встречается менее чем в двух процентах всех ячеек). Как нейтрофилы и эозинофилы, они лопастные. ядра; однако у них всего две доли, и хроматин нити, которые их соединяют, не очень заметны. Базофилы имеют рецепторы, которые могут связываться с IgE, IgG, дополнять, и гистамин. В цитоплазма базофилов содержит различное количество гранул; этих гранул обычно достаточно, чтобы частично скрыть ядро. Гранула содержимое базофилов богато гистамином, гепарин, сульфат хондроитина, пероксидаза, фактор активации тромбоцитов, и другие вещества.
Когда происходит инфекция, зрелые базофилы высвобождаются из костного мозга и отправляются к месту инфекции.[22] Когда базофилы повреждены, они выделяют гистамин, который способствует воспалительная реакция что помогает бороться с вторгающимися организмами. Гистамин вызывает расширение и повышенную проницаемость капилляры близок к базофилу. Травмированные базофилы и др. лейкоциты выпустит другое вещество, называемое простагландины что способствует усилению притока крови к месту инфекции. Оба этих механизма позволяют доставлять элементы, свертывающие кровь, в инфицированную область (это запускает процесс восстановления и блокирует перемещение микробы к другим частям тела). Повышенная проницаемость воспаленной ткани также позволяет фагоцит миграция к месту заражения, чтобы они могли потреблять микробы.[19]
Тучные клетки
Тучные клетки представляют собой тип гранулоцитов, присутствующих в тканях;[3] они опосредуют защиту хозяина от патогены (например., паразиты ) и аллергические реакции, особенно анафилаксия.[3] Тучные клетки также участвуют в посредничестве воспаление и аутоиммунитет а также посредничество и регулирование нейроиммунная система ответы.[3][23][24]
Разработка
Гранулоциты получают из стволовых клеток, находящихся в костном мозге. Дифференциация этих стволовых клеток от плюрипотентных гемопоэтические стволовые клетки в гранулоциты называется гранулопоэз. В этом процессе дифференциации существует несколько промежуточных типов клеток, в том числе миелобласты и промиелоциты.
Функция
Содержание гранул
Примеры токсичных материалов, произведенных или выпущенных дегрануляция Гранулоцитами при попадании в организм микроорганизмов являются:
- Противомикробный агенты (Defensins и Катионный белок эозинофилов )
- Ферменты
- Кислотные гидролазы: дальнейшее переваривание бактерий
- Лизоцим: растворяет клеточные стенки некоторых грамположительные бактерии
- Низкий pH пузырьки (3.5-4.0)
- Токсичный азот оксиды (оксид азота )
- Токсичный кислород производные продукты (например, супероксид, пероксид водорода, гидрокси радикалы, синглетный кислород, гипогалит )
Клиническое значение
Гранулоцитопения - аномально низкая концентрация гранулоцитов в крови. Это состояние снижает сопротивляемость организма ко многим инфекциям. Тесно связанные термины включают агранулоцитоз (этимологически «без гранулоцитов»; клинически уровень гранулоцитов менее 5% от нормы) и нейтропения (дефицит нейтрофильные гранулоциты ). Гранулоциты живут в обращении всего один-два дня (четыре дня в селезенка или другой ткани), поэтому переливание гранулоцитов в качестве терапевтической стратегии принесет очень краткосрочный эффект. Кроме того, с такой процедурой связано множество осложнений.
Обычно присутствует гранулоцит хемотаксический дефект у лиц, страдающих сахарный диабет 1 типа.
Исследования показывают, что переливание гранулоцитов для предотвращения инфекций снижает количество людей с бактериальной или грибковой инфекцией в крови.[25] Дальнейшие исследования показывают, что участники, получающие терапевтические трансфузии гранулоцитов, не показывают разницы в клиническом излечении сопутствующей инфекции.[26]
Дополнительные изображения

Гемопоэз
Смотрите также
Рекомендации
- ^ WebMD (2009). «гранулоцит». Медицинский словарь нового мира Вебстера (3-е изд.). Houghton Mifflin Harcourt. п. 181. ISBN 978-0-544-18897-6.
- ^ WebMD (2009). «лейкоцитарный полиморфноядерный». Медицинский словарь нового мира Вебстера (3-е изд.). Houghton Mifflin Harcourt. п. 244. ISBN 978-0-544-18897-6.
- ^ а б c d Breedveld A, Groot Kormelink T, van Egmond M, de Jong EC (октябрь 2017 г.). «Гранулоциты как модуляторы функции дендритных клеток». Журнал биологии лейкоцитов. 102 (4): 1003–1016. Дои:10.1189 / jlb.4MR0217-048RR. PMID 28642280.
- ^ Ствртинова, Вьера; Ян Якубовский и Иван Хулин (1995). «Нейтрофилы, центральные клетки при остром воспалении». Воспаление и лихорадка от патофизиологии: принципы болезни. Вычислительный центр Словацкой академии наук: Academic Electronic Press. ISBN 80-967366-1-2. Архивировано из оригинал 31 декабря 2010 г.. Получено 28 марта, 2009.
- ^ Хоффбранд п. 331
- ^ Аббас, Глава 12, 5-е издание[требуется полная цитата ][страница нужна ]
- ^ а б Sompayrac p. 18
- ^ Линдеркамп О., Рюф П., Бреннер Б., Гулбинс Э., Ланг Ф. (декабрь 1998 г.). «Пассивная деформируемость зрелых, незрелых и активных нейтрофилов у здоровых новорожденных и новорожденных с сепсисом». Педиатрические исследования. 44 (6): 946–50. Дои:10.1203/00006450-199812000-00021. PMID 9853933.
- ^ Хики MJ, Кубес P (май 2009 г.). «Внутрисосудистый иммунитет: встреча возбудителя и хозяина в кровеносных сосудах». Обзоры природы. Иммунология. 9 (5): 364–75. Дои:10.1038 / nri2532. PMID 19390567.
- ^ Робинсон П. 187 и Эрнст, стр. 7–10.
- ^ Паолетти П. 62
- ^ Soehnlein O, Kenne E, Rotzius P, Eriksson EE, Lindbom L (январь 2008 г.). «Продукты секреции нейтрофилов регулируют антибактериальную активность моноцитов и макрофагов». Клиническая и экспериментальная иммунология. 151 (1): 139–45. Дои:10.1111 / j.1365-2249.2007.03532.x. ЧВК 2276935. PMID 17991288.
- ^ а б c Майер, Джин (2006). «Иммунология - Глава первая: Врожденный (неспецифический) иммунитет». Электронный учебник микробиологии и иммунологии. Медицинская школа USC. Получено 12 ноября, 2008.
- ^ Soehnlein O, Kai-Larsen Y, Frithiof R, Sorensen OE, Kenne E, Scharffetter-Kochanek K, et al. (Октябрь 2008 г.). «Нейтрофильные первичные гранулярные белки HBP и HNP1-3 усиливают бактериальный фагоцитоз макрофагами человека и мыши». Журнал клинических исследований. 118 (10): 3491–502. Дои:10.1172 / JCI35740. ЧВК 2532980. PMID 18787642.
- ^ Кларк С.Р., Ма А.С., Тавенер С.А., Макдональд Б., Гударзи З., Келли М.М. и др. (Апрель 2007 г.). «TLR4 тромбоцитов активирует внеклеточные ловушки нейтрофилов, чтобы заманить бактерии в септическую кровь». Природа Медицина. 13 (4): 463–9. Дои:10,1038 / нм 1565. PMID 17384648.
- ^ а б Hess CE. «Сегментированный эозинофил». Система здравоохранения Университета Вирджинии. Получено 2009-04-10.
- ^ а б Барон, Сэмюэл (редактор) (1996). Медицинская микробиология (4-е издание). Издание Медицинское отделение Техасского университета в Галвестоне. ISBN 978-0-9631172-1-2.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Gleich GJ, Адольфсон CR (1986). «Эозинофильный лейкоцит: структура и функция». Успехи в иммунологии Том 39. Успехи иммунологии. 39. С. 177–253. Дои:10.1016 / S0065-2776 (08) 60351-X. ISBN 978-0-12-022439-5.
- ^ а б Кэмпбелл П. 903
- ^ Акутота П., Ван Х. Б., Спенсер Л. А., Веллер П. Ф. (август 2008 г.). «Иммунорегуляторные роли эозинофилов: новый взгляд на знакомую клетку». Клиническая и экспериментальная аллергия. 38 (8): 1254–63. Дои:10.1111 / j.1365-2222.2008.03037.x. ЧВК 2735457. PMID 18727793.
- ^ Кариявасам Х. Х., Робинсон Д. С. (апрель 2006 г.). «Эозинофил: клетка и ее оружие, цитокины, ее расположение». Семинары по респираторной медицине и реанимации. 27 (2): 117–27. Дои:10.1055 / с-2006-939514. PMID 16612762.
- ^ Hess CE. «Зрелый базофил». Система здравоохранения Университета Вирджинии. Получено 2009-04-10.
- ^ Ли Д.М., Друг Д.С., Гуриш М.Ф., Бенуа С., Матис Д., Бреннер МБ (сентябрь 2002 г.). «Тучные клетки: клеточная связь между аутоантителами и воспалительным артритом». Наука. 297 (5587): 1689–92. Дои:10.1126 / science.1073176. PMID 12215644.
- ^ Polyzoidis S, Koletsa T, Panagiotidou S, Ashkan K, Theoharides TC (сентябрь 2015 г.). «Тучные клетки при менингиомах и воспалении головного мозга». Журнал нейровоспаления. 12 (1): 170. Дои:10.1186 / s12974-015-0388-3. ЧВК 4573939. PMID 26377554.
MC происходят от предшественника костного мозга и впоследствии развивают различные фенотипические характеристики локально в тканях. Их спектр функций широк и включает участие в аллергических реакциях, врожденном и адаптивном иммунитете, воспалении и аутоиммунитете [34]. В головном мозге человека MC могут располагаться в различных областях, таких как гипофиз, эпифиз, постремная зона, сосудистое сплетение, таламус, гипоталамус и срединное возвышение [35]. В мозговых оболочках они обнаруживаются в слое твердой мозговой оболочки вместе с сосудами и окончаниями ноцицепторов менингеальных сосудов [36]. MC имеют отличительную особенность по сравнению с другими гематопоэтическими клетками в том, что они находятся в головном мозге [37]. MC содержат множество гранул и секретируют множество предварительно сохраненных медиаторов, таких как кортикотропин-рилизинг-гормон (CRH), нейротензин (NT), вещество P (SP), триптаза, химаза, вазоактивный кишечный пептид (VIP), фактор роста эндотелия сосудов (VEGF) , TNF, простагландины, лейкотриены и разновидности хемокинов и цитокинов, некоторые из которых, как известно, нарушают целостность гематоэнцефалического барьера (BBB) [38-40].
Ключевая роль MC в воспалении [34] и нарушении ГЭБ [41–43] указывает на важность областей для новых исследований в области терапии. Все больше данных также указывает на то, что MC участвуют в нейровоспалении напрямую [44–46] и через стимуляцию микроглии [47], внося свой вклад в патогенез таких состояний, как головные боли [48] аутизм [49] и синдром хронической усталости [50]. Фактически, недавний обзор показал, что периферические воспалительные стимулы могут вызывать активацию микроглии [51], таким образом, возможно, вовлекая MC вне мозга. - ^ Estcourt LJ, Stanworth S, Doree C, Blanco P, Hopewell S, Trivella M, Massey E (июнь 2015 г.). «Переливание гранулоцитов для предотвращения инфекций у людей с нейтропенией или дисфункцией нейтрофилов». Кокрановская база данных систематических обзоров (6): CD005341. Дои:10.1002 / 14651858.cd005341.pub3. ЧВК 4538863. PMID 26118415.
- ^ Estcourt LJ, Stanworth SJ, Hopewell S, Doree C, Trivella M, Massey E (апрель 2016 г.). «Переливание гранулоцитов для лечения инфекций у людей с нейтропенией или дисфункцией нейтрофилов». Кокрановская база данных систематических обзоров. 4: CD005339. Дои:10.1002 / 14651858.cd005339.pub2. ЧВК 4930145. PMID 27128488.
Библиография
- Кэмпбелл Н. А., Рис Дж. Б. (2002). Биология (6-е изд.). Pearson Education, Inc. ISBN 978-0-8053-6624-2.
- Делвес П.Дж., Мартин С.Дж., Бертон Д.Р., Ройт И.М. (2006). Основная иммунология Ройтта (11-е изд.). Блэквелл Паблишинг. ISBN 978-1-4051-3603-7.
- Эрнст Дж. Д., Стендаль О (2006). Фагоцитоз бактерий и патогенность бактерий. Издательство Кембриджского университета. ISBN 0-521-84569-6.
- Хоффбранд А.В., Петтит Дж. Э., Мосс ПА (2005). Эссенциальная гематология (4-е изд.). Blackwell Science. ISBN 978-0-632-05153-3.
- Паолетти Р., Notario A, Ricevuti G, ред. (1997). Фагоциты: биология, физиология, патология и фармакотерапия. Нью-Йоркская академия наук. ISBN 978-1-57331-102-1.
- Робинсон Дж. П., Бэбкок Г. Ф., ред. (1998). Функция фагоцитов - руководство для исследований и клинической оценки. Wiley – Liss. ISBN 978-0-471-12364-4.
- Сомпайрак Л. (2008). Как работает иммунная система (3-е изд.). Блэквелл Паблишинг. ISBN 978-1-4051-6221-0.
внешняя ссылка
 СМИ, связанные с Гранулозит в Wikimedia Commons
СМИ, связанные с Гранулозит в Wikimedia Commons

