Вакцина - Vaccine
| Вакцина | |
|---|---|
 В Вакцина против оспы и оборудование для его администрирования | |
| MeSH | D014612 |
А вакцина биологический препарат, обеспечивающий активную приобретенный иммунитет к конкретному инфекционное заболевание.[1] Вакцина обычно содержит агент, напоминающий болезнетворный микроорганизм, и часто состоит из ослабленных или убитых форм микроба, его токсинов или одного из его поверхностных белков. Средство стимулирует иммунная система распознавать агент как угрозу, уничтожать его, а также распознавать и уничтожать любые микроорганизмы, связанные с этим агентом, с которыми он может столкнуться в будущем. Вакцины могут быть профилактический (чтобы предотвратить или смягчить последствия будущего инфекционное заболевание естественным или "диким" возбудитель ), или же терапевтический (для борьбы с уже возникшей болезнью, например рак ).[2][3][4][5]
Введение вакцин называется вакцинация. Вакцинация - самый эффективный метод профилактики инфекционных заболеваний;[6] широко распространенный иммунитет из-за вакцинации в значительной степени ответственен за искоренение во всем мире из оспа и ограничение таких заболеваний, как полиомиелит, корь, и столбняк из большей части мира. Эффективность вакцинации широко изучена и проверена;[7] например, вакцины, которые доказали свою эффективность, включают вакцина против гриппа,[8] то Вакцина против ВПЧ,[9] и вакцина против ветряной оспы.[10] В Всемирная организация здоровья (ВОЗ) сообщает, что в настоящее время лицензированные вакцины доступны для двадцати пяти различных предотвратимые инфекции.[11]
Условия вакцина и вакцинация получены из Variolae Vacinae (оспа коров), термин, изобретенный Эдвард Дженнер (которые разработали концепцию вакцин и создали первую вакцину) для обозначения коровья оспа. Он использовал эту фразу в 1798 году для длинного названия своей Изучение Variolae Vacinae, известного как коровья оспа, в котором он описал защитный эффект коровьей оспы против оспа.[12] В 1881 году в честь Дженнер Луи Пастер предложили, чтобы эти сроки были расширены, чтобы охватить новые защитные прививки, которые разрабатываются в то время.[13]

Последствия
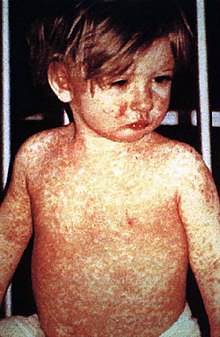
Существует огромное научное мнение о том, что вакцины - очень безопасный и эффективный способ борьбы с инфекционными заболеваниями и их искоренения.[15][16][17][18] В иммунная система распознает вакцины как чужеродные, уничтожает их и «запоминает». Когда ядовитый версия агента, организм распознает белковую оболочку вируса и, таким образом, готов к ответным действиям, сначала нейтрализуя целевой агент до того, как он сможет проникнуть в клетки, а во-вторых, распознавая и уничтожая инфицированные клетки до того, как этот агент сможет размножиться до огромное количество.
Тем не менее, ограничения их эффективности существуют.[19] Иногда защита не срабатывает из-за сбоя, связанного с вакциной, такого как сбой в ослаблении вакцины, режимов вакцинации или введения, или сбой, связанный с хозяином, из-за того, что иммунная система хозяина просто не отвечает адекватно или вообще. Отсутствие реакции обычно является следствием генетики, иммунного статуса, возраста, состояния здоровья или питания.[20] Он также может потерпеть неудачу по генетическим причинам, если иммунная система хозяина не включает штаммы В-клетки который может генерировать антитела подходит для эффективного реагирования и привязки к антигены связанный с возбудитель.
Даже если у хозяина вырабатываются антитела, защиты может быть недостаточно; иммунитет может развиваться слишком медленно, чтобы быть эффективным со временем, антитела могут не выводить патоген полностью из строя, или может существовать несколько штаммов патогена, не все из которых одинаково восприимчивы к иммунной реакции. Однако даже частичный, поздний или слабый иммунитет, например, возникающий в результате перекрестного иммунитета к штамму, отличному от штамма-мишени, может смягчить инфекцию, что приведет к снижению смертность, ниже болезненность, и более быстрое восстановление.[нужна цитата ]
Адъюванты обычно используются для усиления иммунного ответа, особенно у пожилых людей (50–75 лет и старше), чей иммунный ответ на простую вакцину, возможно, ослаб.[21]
В эффективность или эффективность вакцины зависит от ряда факторов:
- сама болезнь (от некоторых болезней вакцинация проходит лучше, чем от других)
- штамм вакцины (некоторые вакцины специфичны или, по крайней мере, наиболее эффективны против определенных штаммов заболевания)[22]
- будь то график вакцинации был должным образом соблюден.
- идиосинкразический ответ на вакцинацию; некоторые люди не реагируют на определенные вакцины, что означает, что они не вырабатывают антитела даже после правильной вакцинации.
- различные факторы, такие как этническая принадлежность, возраст или генетическая предрасположенность.
Если вакцинированный человек действительно заболевает вакциной против (прорывная инфекция ), болезнь, вероятно, будет менее опасной, чем у непривитых жертв.[23]
Следующие важные факторы влияют на эффективность программы вакцинации:[24]
- тщательное моделирование для прогнозирования влияния кампании иммунизации на эпидемиологию заболевания в среднесрочной и долгосрочной перспективе
- постоянный надзор за соответствующей болезнью после внедрения новой вакцины
- поддержание высоких показателей иммунизации, даже если болезнь стала редкой.
В 1958 г. было зарегистрировано 763 094 случая кори в Соединенные Штаты; В результате погибло 552 человека.[25][26] После внедрения новых вакцин число случаев заболевания упало до менее 150 в год (в среднем 56).[26] В начале 2008 года было 64 случая подозрения на корь. Пятьдесят четыре из этих инфекций были связаны с завозом из другой страны, хотя фактически только 13% были инфицированы за пределами Соединенных Штатов; 63 из 64 человек либо никогда не были вакцинированы против кори, либо не были уверены, были ли они вакцинированы.[26]
Вакцины привели к искоренению оспа, одно из самых заразных и смертельных заболеваний человека.[27] Другие болезни, такие как краснуха, полиомиелит, корь, свинка, ветряная оспа, и брюшной тиф не так распространены, как сто лет назад, благодаря широко распространенным программам вакцинации. Пока подавляющее большинство людей вакцинировано, вспышка болезни может возникнуть, не говоря уже о распространении. Этот эффект называется коллективный иммунитет. Полиомиелит, который передается только от человека, является мишенью для обширных кампания по искоренению эндемический полиомиелит ограничен лишь некоторыми частями трех стран (Афганистан, Нигерия, и Пакистан ).[28] Однако из-за сложности охвата всех детей, а также из-за недопонимания культурных традиций предполагаемая дата искоренения несколько раз пропускалась.
Вакцины также помогают предотвратить развитие устойчивости к антибиотикам. Например, за счет значительного снижения заболеваемости пневмонией, вызванной: Пневмококк программы вакцинации значительно снизили распространенность инфекций, устойчивых к пенициллину или другим антибиотикам первого ряда.[29]
По оценкам, вакцина против кори предотвращает 1 миллион смертей ежегодно.[30]
Побочные эффекты
Вакцинация детей, подростков или взрослых в целом безопасна.[31][32] Побочные эффекты, если таковые имеются, обычно умеренные.[33] Скорость побочных эффектов зависит от вакцины, о которой идет речь.[33] Некоторые распространенные побочные эффекты включают жар, боль вокруг места инъекции и мышечные боли.[33] Кроме того, у некоторых людей может быть аллергия на ингредиенты вакцины.[34] Вакцина MMR редко ассоциируется с фебрильные судороги.[32]
Серьезные побочные эффекты возникают крайне редко.[32] Вакцина против ветряной оспы редко ассоциируется с осложнениями иммунодефицитный частные лица и ротавирусные вакцины умеренно связаны с инвагинация.[32]
По крайней мере, 19 стран имеют программы компенсации без вины, чтобы обеспечить компенсацию тем, кто страдает от серьезных побочных эффектов вакцинации.[35] В Соединенные Штаты 'Программа известна как Национальный закон о детских вакцинах и объединенное Королевство нанимает Выплата за повреждение вакцины.
Типы

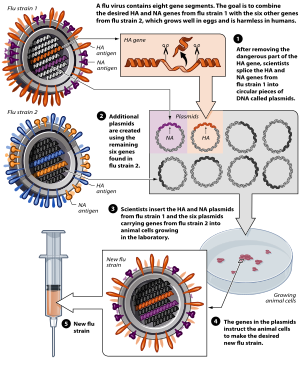
Вакцины содержат мертвые или инактивированные организмы или очищенные продукты, полученные из них.
Есть несколько типов вакцин.[36] Они представляют собой различные стратегии, используемые для снижения риска заболевания, сохраняя при этом способность вызывать положительный иммунный ответ.
Инактивировано
Некоторые вакцины содержат инактивированные, но ранее вирулентные микроорганизмы, уничтоженные химическими веществами, нагреванием или радиацией.[37] Примеры включают IPV вакцина от полиомиелита, вакцина против гепатита А, вакцина против бешенства и большинство вакцины против гриппа.[38]
Ослабленный
Некоторые вакцины содержат живые, ослабленный микроорганизмы. Многие из них активны вирусы которые были культивированы в условиях, лишающих их вирулентных свойств, или в которых используются близкородственные, но менее опасные организмы для выработки широкого иммунного ответа. Хотя большинство аттенуированных вакцин являются вирусными, некоторые из них имеют бактериальную природу. Примеры включают вирусные заболевания. желтая лихорадка, корь, свинка, и краснуха, и бактериальное заболевание брюшной тиф. Жизнь Микобактерии туберкулез вакцина, разработанная Кальметтом и Гереном, не состоит из заразительный штамм, но содержит вирулентно модифицированный штамм под названием "BCG «используется для индукции иммунного ответа на вакцину. Штамм, содержащий живую аттенуированную вакцину. Yersinia pestis EV используется для иммунизации против чумы. У ослабленных вакцин есть некоторые преимущества и недостатки. Ослабленные или живые, ослабленные вакцины обычно вызывают более стойкие иммунологические ответы. Но они могут быть небезопасными для использования у лиц с ослабленным иммунитетом, а в редких случаях мутируют в вирулентную форму и вызывают заболевание.[39]
Анатоксин
Анатоксин вакцины сделаны из инактивированных токсичных соединений, которые вызывают болезнь, а не микроорганизмы.[40] Примеры вакцин на основе токсоидов включают: столбняк и дифтерия. Анатоксиновые вакцины известны своей эффективностью.[38] Не все токсоиды предназначены для микроорганизмов; Например, Crotalus atrox анатоксин используется для вакцинации собак от гремучая змея укусы.[41]
Подразделение
Вместо того, чтобы вводить инактивированный или ослабленный микроорганизм в иммунную систему (которая составляла бы вакцину «цельного агента»), a подразделение вакцина использует ее фрагмент для создания иммунного ответа. Примеры включают субъединичную вакцину против вирус гепатита В который состоит только из поверхностных белков вируса (ранее извлеченных из сыворотка крови хронически инфицированных пациентов, но теперь производятся рекомбинация вирусных генов в дрожжи )[42] или как съедобная вакцина против водорослей, то вирусоподобная частица (VLP) вакцина против вирус папилломы человека (ВПЧ), состоящий из основного вирусного капсид белок[43] и гемагглютинин и нейраминидаза подразделения грипп вирус.[38] Субъединичная вакцина используется для иммунизации против чумы.[44]
Конъюгировать
Некоторые бактерии имеют полисахарид внешние покрытия, которые плохо иммуногенный. Связывая эти внешние оболочки с белками (например, токсинами), иммунная система можно заставить распознавать полисахарид, как если бы он был белковым антигеном. Этот подход используется в Haemophilus influenzae Вакцина типа B.[45]
Гетеротипический
Также известный как гетерологичный или вакцины Дженнера, это вакцины, которые являются патогенами других животных, которые либо не вызывают заболевания, либо вызывают легкое заболевание в организме, подвергаемом лечению. Классический пример - использование Дженнером коровьей оспы для защиты от оспы. Текущий пример - использование Вакцина БЦЖ сделан из Mycobacterium bovis для защиты от туберкулеза человека.[46]
Экспериментальный

Ряд инновационных вакцин также находится в разработке и используется:
- Комбинированные вакцины на основе дендритных клеток дендритные клетки с антигенами, чтобы представить антигены лейкоцитам организма, тем самым стимулируя иммунную реакцию. Эти вакцины показали некоторые положительные предварительные результаты при лечении опухолей головного мозга. [47] и также проходят испытания при злокачественной меланоме.[48]
- ДНК-вакцинация - Предлагаемый механизм - это вставка и выражение вирусной или бактериальной ДНК в клетках человека или животных (усилено использованием электропорация ), вызывая распознавание иммунной системой. Некоторые клетки иммунной системы, распознающие экспрессированные белки, будут атаковать эти белки и клетки, экспрессирующие их. Потому что эти клетки живут очень долго, если возбудитель который обычно экспрессирует эти белки, встречается позже, они будут немедленно атакованы иммунной системой. Одним из потенциальных преимуществ ДНК-вакцин является то, что их очень легко производить и хранить.
- Рекомбинантный вектор - сочетая физиологию одного микроорганизма и ДНК с другой стороны, можно создать иммунитет против болезней, которые имеют сложные инфекционные процессы. Примером может служить Вакцина РВСВ-ЗЕБОВ лицензирован Merck, который используется в 2018 году для борьбы с Эбола в Конго.[49]
- РНК-вакцина представляет собой новый тип вакцины, которая состоит из РНК нуклеиновой кислоты, упакованной в вектор, такой как липидные наночастицы. Ряд РНК-вакцин находится в стадии разработки для борьбы с COVID-19 пандемия.
- Рецептор Т-клеток пептидные вакцины разрабатываются для нескольких заболеваний с использованием моделей Valley Fever, стоматит, и атопический дерматит. Было показано, что эти пептиды модулируют цитокин производство и повышение клеточного иммунитета.
- Нацеливание на идентифицированные бактериальные белки, которые участвуют в ингибировании комплемента, нейтрализует ключевой механизм бактериальной вирулентности.[50]
- Использование плазмиды был подтвержден в доклинических исследованиях в качестве защитной стратегии вакцины против рака и инфекционных заболеваний. Однако в исследованиях на людях этот подход не принес клинически значимой пользы. Общая эффективность иммунизации плазмидной ДНК зависит от увеличения концентрации плазмиды. иммуногенность при этом также корректируя факторы, участвующие в специфической активации иммунных эффекторных клеток.[51]
Хотя большинство вакцин создаются с использованием инактивированных или ослабленных соединений микроорганизмов, синтетические вакцины состоят в основном или полностью из синтетических пептидов, углеводов или антигенов.
Валентность
Вакцины могут быть одновалентный (также называемый однозначный) или же многовалентный (также называемый поливалентный). Моновалентная вакцина предназначена для иммунизации против одного антигена или одного микроорганизма.[52] Мультивалентная или поливалентная вакцина предназначена для иммунизации против двух или более штаммов одного и того же микроорганизма или против двух или более микроорганизмов.[53] Валентность поливалентной вакцины может быть обозначена греческим или латинским префиксом (например, четырехвалентный или же четырехвалентный). В некоторых случаях моновалентная вакцина может быть предпочтительнее для быстрого развития сильного иммунного ответа.[54]
Когда две или более вакцины смешиваются вместе в одном составе, эти две вакцины могут мешать. Чаще всего это происходит с живыми аттенуированными вакцинами, где один из компонентов вакцины более устойчив, чем другие, и подавляет рост и иммунный ответ на другие компоненты. Это явление впервые было замечено у трехлетнего Сабина. вакцина от полиомиелита, где количество вируса серотипа 2 в вакцине должно быть уменьшено, чтобы он не мешал «захвату» вирусов серотипа 1 и 3 в вакцине.[55] Это явление также оказалось проблемой денге вакцины в настоящее время исследуются,[когда? ] где было обнаружено, что серотип DEN-3 преобладает и подавляет ответ на серотипы DEN-1, -2 и -4.[56]
Другое содержание
Адъюванты
Вакцины обычно содержат один или несколько адъюванты, используется для усиления иммунного ответа. Например, столбнячный анатоксин обычно адсорбируется на квасцы. Это представляет антиген таким образом, чтобы оказывать большее действие, чем простой водный столбнячный анатоксин. Людям, у которых наблюдается неблагоприятная реакция на адсорбированный столбнячный анатоксин, можно сделать простую вакцину, когда придет время для ревакцинации.[57]
При подготовке к кампании 1990 г. в Персидском заливе вся ячейка коклюш вакцина использовалась в качестве адъюванта для сибирская язва вакцина. Это вызывает более быстрый иммунный ответ, чем введение только вакцины против сибирской язвы, что дает определенные преимущества, если заражение может быть неизбежным.[58]
Консерванты
Вакцины также могут содержать консерванты для предотвращения заражения бактерии или же грибы. До последних лет консервант тиомерсал (А.К.А. Тимеросал в США и Японии) использовался во многих вакцинах, не содержащих живых вирусов. По состоянию на 2005 год единственная детская вакцина в США, которая содержит тиомерсал в количествах, превышающих следовые количества, - это вакцина против гриппа,[59] который в настоящее время рекомендуется только детям с определенными факторами риска.[60] Однодозовые вакцины против гриппа, поставляемые в Великобританию, не содержат тиомерсала в составе. Консерванты могут использоваться на различных этапах производства вакцин, и самые сложные методы измерения могут обнаружить их следы в готовом продукте, как и в окружающей среде и среди населения в целом.[61]
Многие вакцины нуждаются в консервантах для предотвращения серьезных побочных эффектов, таких как Стафилококк инфекция, в результате которой в одном инциденте 1928 г. погибли 12 из 21 ребенка, инфицированного дифтерия вакцина без консерванта.[62] Доступны несколько консервантов, в том числе тиомерсал, феноксиэтанол, и формальдегид. Тиомерсал более эффективен против бактерий, имеет более длительный срок хранения и улучшает стабильность, эффективность и безопасность вакцины; но в США Евросоюз, и в некоторых других богатых странах, он больше не используется в качестве консерванта в детских вакцинах в качестве меры предосторожности из-за его Меркурий содержание.[63] Несмотря на то что спорные претензии было установлено, что тиомерсал способствует аутизм, никакие убедительные научные доказательства не подтверждают эти утверждения.[64] Кроме того, 10–11-летнее исследование 657 461 ребенка показало, что вакцина MMR не вызывает аутизм и фактически снижает риск аутизма на 7 процентов.[65][66]
Вспомогательные вещества
Помимо самой активной вакцины, следующие вспомогательные вещества и остаточные производственные соединения присутствуют или могут присутствовать в препаратах вакцины:[67]
- Алюминий соли или гели добавляются как адъюванты. Добавляются адъюванты, чтобы способствовать более раннему, более сильному и более стойкому иммунному ответу на вакцину; они позволяют снизить дозировку вакцины.
- Антибиотики добавляются в некоторые вакцины для предотвращения роста бактерий во время производства и хранения вакцины.
- Яйцо белок присутствует в вакцинах против гриппа и желтой лихорадки, поскольку они приготовлены с использованием куриных яиц. Могут присутствовать другие белки.
- Формальдегид используется для инактивации бактериальных продуктов для анатоксиновых вакцин. Формальдегид также используется для инактивации нежелательных вирусов и уничтожения бактерий, которые могут заразить вакцину во время производства.
- Глутамат натрия (MSG) и 2-феноксиэтанол используются в качестве стабилизаторов в некоторых вакцинах, чтобы вакцина оставалась неизменной при воздействии тепла, света, кислотности или влажности.
- Тиомерсал представляет собой ртутьсодержащий противомикробный препарат, который добавляют во флаконы с вакциной, содержащие более одной дозы, для предотвращения заражения и роста потенциально вредных бактерий. Из-за разногласий вокруг тиомерсала он был исключен из большинства вакцин, за исключением вакцины против гриппа многоразового использования, где он был снижен до уровня, при котором разовая доза содержала менее 1 микрограмма ртути, что соответствует уровню потребления 10 г консервированного тунца. .[68]
Номенклатура
Были разработаны различные достаточно стандартизированные сокращения названий вакцин, хотя стандартизация отнюдь не является централизованной или глобальной. Например, названия вакцин, используемые в Соединенных Штатах, имеют общепринятые сокращения, которые также широко известны и используются в других странах. Их обширный список, представленный в виде сортируемой таблицы и свободно доступный, доступен в США. Центры по контролю и профилактике заболеваний страница в Интернете.[69] На странице объясняется, что «Аббревиатуры [в] этой таблице (столбец 3) были стандартизированы совместно сотрудниками Центров по контролю и профилактике заболеваний, ACIP Рабочие группы, редактор журнала Еженедельный отчет о заболеваемости и смертности (MMWR), редактор Эпидемиология и профилактика заболеваний, предупреждаемых с помощью вакцин (Розовая книга), члены ACIP и организации по связям с ACIP ».[69]
Некоторыми примерами являются "DTaP" для анатоксинов дифтерии и столбняка и бесклеточной коклюшной вакцины, "DT" для анатоксинов дифтерии и столбняка и "Td" для токсоидов столбняка и дифтерии. На своей странице о вакцинации от столбняка,[70] CDC далее поясняет, что «заглавные буквы в этих сокращениях обозначают полные дозы токсоидов дифтерии (D) и столбняка (T), а также коклюшной (P) вакцины. Строчные буквы« d »и« p »обозначают уменьшенные дозы дифтерия и коклюш, используемые в составах для подростков / взрослых. «a» в DTaP и Tdap означает «бесклеточный», что означает, что компонент коклюша содержит только часть организма коклюша ».[70]
Еще один список общепринятых сокращений вакцин находится на странице CDC под названием «Акронимы и сокращения вакцин», с сокращениями, используемыми в записях об иммунизации в США.[71] В Название, принятое в США система имеет некоторые соглашения для порядок слов названий вакцин, размещение главные существительные первый и прилагательные постположительно. Вот почему USAN для "ОПВ «есть» вакцина против полиовируса, живая оральная, а не «оральная вакцина против полиомиелита».
График
Для обеспечения наилучшей защиты детям рекомендуется делать прививки, как только их иммунная система станет достаточно развитой, чтобы реагировать на определенные вакцины, с дополнительными «бустерными» прививками, часто необходимыми для достижения «полного иммунитета». Это привело к разработке сложных графиков вакцинации. В Соединенных Штатах Консультативный комитет по практике иммунизации, который рекомендует добавления в расписание для Центры по контролю и профилактике заболеваний, рекомендует плановую вакцинацию детей от[73] гепатит А, гепатит Б полиомиелит, эпидемический паротит, корь, краснуха, дифтерия, коклюш, столбняк, HiB, ветряная оспа, ротавирус, грипп, менингококковая инфекция и пневмония.[74]
Большое количество рекомендованных вакцин и бустеров (до 24 инъекций к двум годам) привело к проблемам с достижением полного соблюдения. Чтобы бороться со снижением показателей соблюдения, были созданы различные системы уведомлений, и в настоящее время продается ряд комбинированных инъекций (например, Пневмококковая конъюгированная вакцина и Вакцина MMRV ), которые обеспечивают защиту от множества заболеваний.
Помимо рекомендаций по вакцинации младенцев и ревакцинации, многие специальные вакцины рекомендуются для других возрастов или для повторных инъекций на протяжении всей жизни - чаще всего от кори, столбняка, гриппа и пневмонии. Беременные женщины часто проходят скрининг на стойкость к краснухе. В вирус папилломы человека вакцина рекомендована в США (по состоянию на 2011 г.)[75] и Великобритания (по состоянию на 2009 г.).[76] Рекомендации по вакцинации пожилых людей сосредоточены на пневмонии и гриппе, которые более опасны для этой группы. В 2006 году была введена вакцина против опоясывающий лишай, заболевание, вызванное вирусом ветряной оспы, которое обычно поражает пожилых людей.
Экономика развития
Одна из проблем при разработке вакцины носит экономический характер: вакцина требует многих болезней, в том числе ВИЧ, малярия и туберкулез существуют в основном в бедных странах. Фармацевтические фирмы и биотехнология у компаний нет особых стимулов разрабатывать вакцины от этих болезней, потому что у них небольшой потенциал дохода. Даже в более богатых странах финансовая отдача обычно минимальна, а финансовые и другие риски велики.[77]
На сегодняшний день большая часть разработок вакцин опирается на «проталкивающее» финансирование со стороны правительства, университетов и некоммерческих организаций.[78] Многие вакцины были очень рентабельными и полезными для здравоохранение.[79] Количество фактически вводимых вакцин резко возросло за последние десятилетия.[80] Это увеличение, особенно количества различных вакцин, вводимых детям до поступления в школу, может быть связано с правительственными мандатами и поддержкой, а не с экономическими стимулами.[81]
Патенты
Подача патенты о процессах разработки вакцин также можно рассматривать как препятствие для разработки новых вакцин. Из-за слабой защиты, предлагаемой патентом на конечный продукт, защита инноваций в отношении вакцин часто обеспечивается за счет патентования процессов, используемых при разработке новых вакцин, а также защиты секретность.[82]
По данным Всемирной организации здравоохранения, самым большим препятствием для местного производства вакцин в менее развитых странах были не патенты, а значительные финансовые, инфраструктурные и кадровые требования, необходимые для выхода на рынок. Вакцины представляют собой сложные смеси биологических соединений, и, в отличие от лекарств, настоящих генерических вакцин не существует. Вакцина, произведенная на новом предприятии, должна пройти полное клиническое испытание на безопасность и эффективность, аналогичное тому, которое было проведено вакциной, произведенной первоначальным производителем. Для большинства вакцин запатентованы определенные процессы. Их можно обойти с помощью альтернативных методов производства, но для этого требовалась инфраструктура НИОКР и квалифицированная рабочая сила. В случае нескольких относительно новых вакцин, таких как вакцина против вируса папилломы человека, патенты могут создать дополнительный барьер.[83]
Производство

Производство вакцины проходит в несколько этапов. Во-первых, генерируется сам антиген. Вирусы выращиваются либо на первичных клетках, таких как куриные яйца (например, для гриппа) или на непрерывных клеточных линиях, таких как культивируемые клетки человека (например, для гепатит А ).[84] Бактерии выращиваются в биореакторы (например., Haemophilus influenzae тип б). Подобным образом рекомбинантный белок, полученный из вирусов или бактерий, может быть получен в дрожжах, бактериях или культурах клеток.[85][86]
После образования антигена его выделяют из клеток, использованных для его генерации.Может потребоваться инактивировать вирус, возможно, без дополнительной очистки. Рекомбинантные белки требуют множества операций, включая ультрафильтрацию и колоночную хроматографию. Наконец, вакцина создается путем добавления адъюванта, стабилизаторов и консервантов по мере необходимости. Адъювант усиливает иммунный ответ антигена, стабилизаторы увеличивают срок хранения, а консерванты позволяют использовать многодозовые флаконы.[85][86] Комбинированные вакцины труднее разрабатывать и производить из-за потенциальной несовместимости и взаимодействия между антигенами и другими вовлеченными ингредиентами.[87]
Заключительный этап производства вакцины перед распространением - заполнить и закончить, который представляет собой процесс наполнения флаконов вакцинами и их упаковки для распространения. Хотя это концептуально простая часть процесса производства вакцины, она часто является узким местом в процессе распределения и введения вакцин.[88][89][90]
Технологии производства вакцин развиваются. Ожидается, что культивируемые клетки млекопитающих будут приобретать все большее значение по сравнению с традиционными вариантами, такими как куриные яйца, из-за большей продуктивности и низкой частоты проблем с загрязнением. Ожидается, что технология рекомбинации, которая производит генетически детоксифицированную вакцину, станет все более популярной для производства бактериальных вакцин, в которых используются токсоиды. Ожидается, что комбинированные вакцины уменьшат количество содержащихся в них антигенов и, таким образом, уменьшат нежелательные взаимодействия за счет использования патоген-ассоциированные молекулярные паттерны.[87]
В 2010 году Индия произвела 60 процентов вакцины в мире на сумму около 900 миллионов долларов (670 миллионов евро).[91]
Системы доставки

Разработка новых систем доставки вселяет надежду на вакцины, которые будут более безопасными и более эффективными для доставки и введения. Направления исследований включают липосомы и ISCOM (иммуностимулирующий комплекс).[92]
Заметные достижения в технологиях доставки вакцин включают оральные вакцины. Ранние попытки применения пероральных вакцин показали различную степень обещания, начало в начале 20-го века, в то время, когда сама возможность эффективной пероральной антибактериальной вакцины была противоречивой.[93] К 1930-м годам возрос интерес к профилактической ценности перорального брюшной тиф вакцина например.[94]
Оральная вакцина против полиомиелита оказалась эффективной, когда вакцинацию проводили волонтеры без формального обучения; результаты также продемонстрировали повышенную легкость и эффективность введения вакцин. Эффективные пероральные вакцины имеют много преимуществ; например, нет риска заражения крови. Вакцины, предназначенные для перорального введения, не обязательно должны быть жидкими, а в твердом виде они обычно более стабильны и менее подвержены повреждению или порче при замораживании при транспортировке и хранении.[95] Такая стабильность снижает потребность в "холодная цепь ": ресурсы, необходимые для содержания вакцин в ограниченном температурном диапазоне от стадии производства до точки введения, что, в свою очередь, может снизить стоимость вакцин.
Подход с использованием микроигл, который все еще находится в стадии разработки, использует «заостренные выступы, изготовленные в виде массивов, которые могут создавать пути доставки вакцины через кожу».[96]
Экспериментальный безыгольный[97] Система доставки вакцины проходит испытания на животных.[98][99] Нашивка размером с марку, похожая на пластырь содержит около 20 000 микроскопических выступов на квадратный сантиметр.[100] Этот кожный введение потенциально увеличивает эффективность вакцинации, при этом требует меньше вакцины, чем инъекции.[101]
Ветеринария

Вакцинация животных используется как для предотвращения заражения ими болезней, так и для предотвращения передачи болезней людям.[102] Обычно вакцинируются как животные, содержащиеся в качестве домашних животных, так и животные, выращиваемые в качестве домашнего скота. В некоторых случаях можно вакцинировать дикие популяции. Иногда это достигается с помощью пищевых продуктов с вакциной, распространяемых в районах, подверженных болезням, и используется для борьбы с бешенство в еноты.
В случае возникновения бешенства по закону может потребоваться вакцинация собак от бешенства. Другие собачьи вакцины включают: собачья чума, собачий парвовирус, инфекционный гепатит собак, аденовирус-2, лептоспироз, бордателла, собачий вирус парагриппа, и Болезнь Лайма, среди прочего.
Были задокументированы случаи применения ветеринарных вакцин для людей, преднамеренных или случайных, с некоторыми случаями результирующего заболевания, особенно с бруцеллез.[103] Однако сообщения о таких случаях редки, и очень мало изучено о безопасности и результатах такой практики. С появлением в ветеринарных клиниках аэрозольной вакцинации домашних животных произошло воздействие на человека патогенов, которые не переносятся естественным путем, таких как Bordetella bronchiseptica, вероятно, увеличился в последние годы.[103] В некоторых случаях, особенно бешенство, параллельная ветеринарная вакцина против патогена может быть как порядки величины экономичнее человеческого.
DIVA вакцины
DIVA (дифференциация инфицированных от вакцинированных животных), также известная как SIVA (отделение инфицированных от вакцинированных животных), вакцины позволяют различать инфицированных и вакцинированных животных.
Вакцины DIVA содержат по крайней мере одну эпитоп меньше, чем циркулирующих в поле микроорганизмов. Сопутствующий диагностический тест, который обнаруживает антитела против этого эпитопа, позволяет нам действительно провести эту дифференциацию.
Первые вакцины DIVA (ранее называвшиеся маркерные вакцины и с 1999 г. придуманы как вакцины DIVA), а сопутствующие диагностические тесты были разработаны J.T. ван Оиршот и его коллеги из Центрального ветеринарного института в Лелистаде, Нидерланды.[104][105]Они обнаружили, что некоторые существующие вакцины против псевдобешенство (также называемая болезнью Ауески) имели делеции в вирусном геноме (среди которых был ген gE). Моноклональные антитела были получены против этой делеции и отобраны для разработки ELISA, который продемонстрировал антитела против gE. Кроме того, были созданы новые генно-инженерные gE-отрицательные вакцины.[106]В том же духе были разработаны вакцины DIVA и сопутствующие диагностические тесты против инфицирования вирусом герпеса 1 крупного рогатого скота.[105][107]
Стратегия DIVA применялась в разных странах и успешно искоренила вирус псевдобешенства. Популяции свиней были интенсивно вакцинированы и контролировались с помощью сопутствующего диагностического теста, после чего инфицированные свиньи были удалены из популяции. Вакцины DIVA от вируса герпеса 1 крупного рогатого скота также широко используются на практике.
Ученые приложили и продолжают прилагать много усилий для применения принципа DIVA к широкому спектру инфекционных заболеваний, таких как, например, классическая чума свиней,[108] птичий грипп,[109] Актинобацилла плевропневмония[110] и инфекции сальмонеллы у свиней.[111]
История
До внедрения вакцинации с использованием материалов, полученных от случаев коровьей оспы (гетеротипическая иммунизация), натуральную оспу можно было предотвратить с помощью преднамеренных прививка вируса оспы, позже именуемого вариоляция отличить это от вакцинация против оспы. Самые ранние намеки на прививку от оспы в Китае появились в 10 веке.[112] Китайцы также практиковали древнейшее документированное использование вариоляции, относящееся к пятнадцатому веку. Они реализовали метод «назального инсуффляция «вводятся путем вдувания порошкообразного материала оспы, обычно струпьев, в ноздри. Различные техники вдувания были зарегистрированы в течение шестнадцатого и семнадцатого веков в Китае.[113]:60Два отчета о китайской практике прививка были получены Королевское общество в Лондоне в 1700 г .; один доктор Мартин Листер получивший рапорт сотрудника Ост-Индская компания размещены в Китае, а другой - Clopton Havers.[114]

Независимо от отчета Ост-Индской компании, где-то в конце 1760-х годов, когда он проходил обучение в качестве хирурга / аптекаря. Эдвард Дженнер узнал об истории, распространенной в сельской местности, о том, что у молочных работников никогда не будет смертельной или уродливой болезни оспа, потому что они уже заключили контракт коровья оспа, который оказывает очень мягкое воздействие на человека. В 1796 году Дженнер взял гной из руки больной коровьей оспой доярки, поцарапал им руку 8-летнего мальчика, Джеймс Фиппс, а через шесть недель привиты (вариолированный ) мальчик, заболевший оспой, впоследствии заметил, что оспой он не заболел.[115][116] Дженнер расширил свои исследования и в 1798 году сообщил, что его вакцина безопасна для детей и взрослых и может передаваться из рук в руки, что снижает зависимость от ненадежных запасов от инфицированных коров.[12] Поскольку вакцинация от коровьей оспы была намного безопаснее, чем прививка от натуральной оспы,[117] последнее, хотя и по-прежнему широко практикуется в Англии, было запрещено в 1840 году.[118]

Следуя работе Дженнера, второе поколение вакцин было представлено в 1880-х гг. Луи Пастер кто разработал вакцины от куриной холеры и сибирская язва,[13] а с конца девятнадцатого века вакцины считались делом национального престижа, и были приняты законы об обязательной вакцинации.[115]
В двадцатом веке было введено несколько успешных вакцин, в том числе против дифтерия, корь, свинка, и краснуха. Основные достижения включали разработку вакцина от полиомиелита в 1950-х и искоренение оспы в течение 1960-х и 1970-х годов. Морис Хиллеман был самым плодовитым из разработчиков вакцин в двадцатом веке. По мере того как вакцины стали более распространенными, многие люди стали воспринимать их как должное. Однако вакцины по-прежнему недоступны для многих важных заболеваний, включая простой герпес, малярия, гонорея, и ВИЧ.[115][119]
Вакцины устранили естественные оспа, и почти исключено полиомиелит, в то время как другие заболевания, такие как тиф, ротавирус, гепатит A, B и другие хорошо контролируются. Обычные вакцины охватывают небольшое количество болезней, но неэффективны при борьбе со многими другими инфекциями.
Поколения вакцин
Вакцины первого поколения - это вакцины для всего организма - живые и ослабленный, или убитые формы.[120] Живые аттенуированные вакцины, такие как вакцины против оспы и полиомиелита, способны вызывать киллерные Т-клетки (ТC или CTL) ответы, вспомогательная Т-клетка (ТЧАС) ответы и антитело иммунитет. Однако ослабленные формы возбудитель может перейти в опасную форму и вызвать заболевание в с ослабленным иммунитетом получатели вакцины (например, с СПИД ). Хотя убитые вакцины не имеют такого риска, они не могут генерировать специфические ответы Т-киллеров и могут вообще не работать при некоторых заболеваниях.[120]
Вакцины второго поколения были разработаны для снижения рисков, связанных с живыми вакцинами. Это субъединичные вакцины, состоящие из специфических белок антигены (Такие как столбняк или же дифтерия анатоксин ) или же рекомбинантный белковые компоненты (например, поверхностный антиген гепатита В). Они могут генерировать TЧАС и ответы антител, но не ответы Т-киллеров.
ДНК-вакцины являются примерами вакцин третьего поколения.[120][121] В 2016 году ДНК-вакцина от Вирус Зика начал тестирование в Национальные институты здоровья. Отдельно компании Inovio Pharmaceuticals и GeneOne Life Science начали испытания другой ДНК-вакцины против вируса Зика в Майами. Объем производства вакцин остается нерешенным.[122] Клинические испытания ДНК-вакцин для предотвращения ВИЧ продолжаются.[123]
График
Тенденции
Этот раздел должен быть обновлено. (Июнь 2018 г.) |
Разработка вакцин имеет несколько направлений:[124]
- До не давнего времени,[когда? ] большинство вакцин были нацелены на младенцев и детей, но подростки и взрослые становятся мишенью все чаще.[124][125]
- Комбинации вакцин становятся все более распространенными; вакцины, содержащие пять или более компонентов используются во многих частях мира.[124]
- Разрабатываются новые методы введения вакцин,[когда? ] такие как пятна на коже, аэрозоли через ингаляционные устройства и употребление в пищу генно-инженерных растений.[124]
- Вакцины разрабатываются для стимуляции врожденного иммунного ответа, а также адаптивного.[124]
- Предпринимаются попытки разработать вакцины для лечения хронических инфекций, а не для предотвращения болезней.[124]
- Вакцины разрабатываются для защиты от биотеррористических атак, таких как сибирская язва, чума и оспа.[124]
- Понимание различий в ответах на вакцины по признаку пола и беременности «может изменить стратегии, используемые официальными лицами здравоохранения».[126]
- Сейчас ученые пытаются разработать синтетические вакцины, реконструируя внешнюю структуру вирус, это поможет предотвратить устойчивость к вакцинам.[127]
Принципы, управляющие иммунным ответом, теперь могут быть использованы в специально разработанных вакцинах против многих неинфекционных заболеваний человека, таких как рак и аутоиммунные заболевания.[128] Например, экспериментальная вакцина CYT006-AngQb был исследован как возможное лечение высокое кровяное давление.[129] Факторы, которые влияют на тенденции разработки вакцин, включают прогресс в трансляционной медицине, демография, нормативная наука, политические, культурные и социальные реакции.[130]
Растения как биореакторы для производства вакцин
Трансгенные растения были определены как многообещающие системы экспрессии для производства вакцин. Сложные растения, такие как табак, картофель, томат и банан, могут иметь встроенные гены, которые заставляют их производить вакцины, пригодные для использования людьми.[131] Были разработаны бананы, из которых производится человеческая вакцина против гепатит Б.[132] Другим примером является экспрессия слитого белка в трансгенных растениях люцерны для селективного направления к антигенпрезентирующим клеткам, тем самым повышая эффективность вакцины против Вирусная диарея крупного рогатого скота Вирус (BVDV).[133][134]
Смотрите также
- Охладитель вакцин
- Коалиция за инновации в обеспечении готовности к эпидемиям
- Экономика вакцин
- Летающий шприц
- Лошадь по имени Джим
- Регистр иммунизации
- Иммунотерапия
- Список ингредиентов вакцины
- Список тем о вакцинах
- Неспецифический эффект вакцин
- Гипотеза ОПВ о СПИДе
- Профилактическое здравоохранение
- Обратная вакцинология
- TA-CD
- Виросома
- Отказ вакцины
- Неуверенность в вакцине
- Вацинов
- Вирусоподобная частица
Рекомендации
- ^ «Болезни, предупреждаемые с помощью вакцин». Министерство здравоохранения Австралии.
- ^ Мелиф С.Дж., ван Холл Т., Аренс Р., Оссендорп Ф., ван дер Бург С.Х. (сентябрь 2015 г.). «Лечебные противораковые вакцины». Журнал клинических исследований. 125 (9): 3401–12. Дои:10.1172 / JCI80009. ЧВК 4588240. PMID 26214521.
- ^ Bol KF, Aarntzen EH, Pots JM, Olde Nordkamp MA, van de Rakt MW, Scharenborg NM, de Boer AJ, van Oorschot TG, Croockewit SA, Blokx WA, Oyen WJ, Boerman OC, Mus RD, van Rossum MM, van der Graaf CA, Punt CJ, Adema GJ, Figdor CG, de Vries IJ, Schreibelt G (март 2016 г.). «Профилактические вакцины являются мощными активаторами дендритных клеток, происходящих из моноцитов, и вызывают эффективные противоопухолевые реакции у пациентов с меланомой за счет токсичности».. Иммунология рака, Иммунотерапия. 65 (3): 327–39. Дои:10.1007 / s00262-016-1796-7. ЧВК 4779136. PMID 26861670.
- ^ Brotherton J (2015). «Профилактические вакцины против ВПЧ: уроки, извлеченные из 10-летнего опыта». Будущая вирусология. 10 (8): 999–1009. Дои:10.2217 / fvl.15.60.
- ^ Frazer IH (май 2014 г.). «Разработка и внедрение профилактических вакцин против папилломавируса». Журнал иммунологии. 192 (9): 4007–11. Дои:10.4049 / jimmunol.1490012. PMID 24748633.
- ^ * Центры США по контролю и профилактике заболеваний (2011 г.). Структура CDC для предотвращения инфекционных заболеваний. В архиве 2017-08-29 в Wayback Machine По состоянию на 11 сентября 2012 г. «Вакцины - это наши самые эффективные и экономичные инструменты для предотвращения болезней, предотвращения невыразимых страданий и спасения десятков тысяч жизней и ежегодного снижения затрат на здравоохранение на миллиарды долларов».
- Американская медицинская ассоциация (2000). Вакцины и инфекционные болезни: взгляд в перспективу. В архиве 2015-02-05 в Wayback Machine По состоянию на 11 сентября 2012 г. «Вакцины - самый эффективный инструмент общественного здравоохранения из когда-либо созданных».
- Агентство общественного здравоохранения Канады. Болезни, предупреждаемые с помощью вакцин. В архиве 2015-03-13 на Wayback Machine По состоянию на 11 сентября 2012 г. «Вакцины по-прежнему являются наиболее эффективным и долговременным методом профилактики инфекционных заболеваний во всех возрастных группах».
- Национальный институт аллергии и инфекционных заболеваний США (NIAID). Программа исследований NIAID Biodefense для приоритетных патогенов категорий B и C. В архиве 2016-03-04 в Wayback Machine По состоянию на 11 сентября 2012 г. «Вакцины - самый эффективный метод защиты населения от инфекционных заболеваний».
- ^ Циммер, Карл (20 ноября 2020 г.). «Две компании заявляют, что их вакцины эффективны на 95%. Что это значит? Можно предположить, что 95 из каждых 100 вакцинированных людей будут защищены от Covid-19. Но математика работает не так».. Нью-Йорк Таймс. Получено 21 ноября 2020.
- ^ Fiore AE, Bridges CB, Cox NJ (2009). «Вакцины против сезонного гриппа». Вакцины от пандемического гриппа. Curr. Вершина. Microbiol. Иммунол. Актуальные темы микробиологии и иммунологии. 333. С. 43–82. Дои:10.1007/978-3-540-92165-3_3. ISBN 978-3-540-92164-6. PMID 19768400.
- ^ Чанг Й., Брюэр Н.Т., Ринас А.С., Шмитт К., Смит Дж. С. (июль 2009 г.). «Оценка воздействия вакцин против вируса папилломы человека». Вакцина. 27 (32): 4355–62. Дои:10.1016 / j.vaccine.2009.03.008. PMID 19515467.
- ^ Лизеганг Т.Дж. (август 2009 г.). «Вакцины против вируса ветряной оспы: эффективны, но проблемы сохраняются». Канадский журнал офтальмологии. 44 (4): 379–84. Дои:10.3129 / i09-126. PMID 19606157. S2CID 662998.
- ^ Всемирная организация здоровья, Глобальный план действий в отношении вакцин на 2011-2020 гг. В архиве 2014-04-14 в Wayback Machine Женева, 2012 г.
- ^ а б Бэксби Д. (январь 1999 г.). "Запрос Эдварда Дженнера; двухсотлетний анализ". Вакцина. 17 (4): 301–7. Дои:10.1016 / s0264-410x (98) 00207-2. PMID 9987167.
- ^ а б Пастер Л. (1881). «Обращение к теории зародыша». Ланцет. 118 (3024): 271–72. Дои:10.1016 / с0140-6736 (02) 35739-8.
- ^ «Корь | Вакцинация | CDC». 2018-02-05.
- ^ Оренштейн В.А., Бернье Р.Х., Дондеро Т.Дж., Хинман А.Р., Маркс Дж.С., Барт К.Дж., Сироткин Б. (1985). «Полевая оценка эффективности вакцины». Бюллетень Всемирной организации здравоохранения. 63 (6): 1055–68. ЧВК 2536484. PMID 3879673.
- ^ 11 января, отчет сотрудников хаба / Опубликован; 2017 (2017-01-11). «Наука ясна: вакцины безопасны, эффективны и не вызывают аутизм». Концентратор. Получено 2019-04-16.CS1 maint: числовые имена: список авторов (связь)
- ^ Элленберг СС, Чен Р.Т. (1997). «Сложная задача мониторинга безопасности вакцины». Отчеты общественного здравоохранения. 112 (1): 10–20, обсуждение 21. ЧВК 1381831. PMID 9018282.
- ^ «Безопасность вакцин: факты». HealthyChildren.org. Получено 2019-04-16.
- ^ Грамматикос А.П., Мантадакис Э., Фалагас М.Э. (июнь 2009 г.). «Мета-анализы педиатрических инфекций и вакцин». Клиники инфекционных болезней Северной Америки. 23 (2): 431–57. Дои:10.1016 / j.idc.2009.01.008. PMID 19393917.
- ^ Видерманн, Урсула; Гарнер-Спитцер, Эрика; Вагнер, Анжелика (январь 2016 г.). «Отказ от первичной вакцины по сравнению с обычными вакцинами: почему и что делать?». Человеческие вакцины и иммунотерапевтические препараты. 12 (1): 239–243. Дои:10.1080/21645515.2015.1093263. ЧВК 4962729. PMID 26836329.
- ^ Нигмонд П. (07.02.2010). «Адаптация вакцин для нашей иммунной системы старения». Утренний выпуск. ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР. В архиве из оригинала от 16.12.2013. Получено 2014-01-09.

- ^ Шлегель М., Остервальдер Дж. Дж., Галеацци Р.Л., Вернацца П.Л. (август 1999 г.). «Сравнительная эффективность трех вакцин против эпидемического паротита во время вспышки болезни в Восточной Швейцарии: когортное исследование». BMJ. 319 (7206): 352. Дои:10.1136 / bmj.319.7206.352. ЧВК 32261. PMID 10435956.
- ^ Préziosi MP, Halloran ME (сентябрь 2003 г.). «Влияние вакцинации против коклюша на болезнь: эффективность вакцины в снижении клинической тяжести». Клинические инфекционные болезни. 37 (6): 772–9. Дои:10.1086/377270. PMID 12955637.
- ^ Miller, E .; Beverley, P. C. L .; Солсбери, Д. М. (01.07.2002). «Программы и политика в отношении вакцин». Британский медицинский бюллетень. 62 (1): 201–211. Дои:10.1093 / bmb / 62.1.201. ISSN 0007-1420. PMID 12176861.
- ^ Оренштейн В.А., Папания М.Дж., Уортон М.Э. (май 2004 г.). «Ликвидация кори в США». Журнал инфекционных болезней. 189 Дополнение 1 (Дополнение 1): S1-3. Дои:10.1086/377693. PMID 15106120.
- ^ а б c «Корь - США, 1 января - 25 апреля 2008 г.». MMWR. Еженедельный отчет о заболеваемости и смертности. 57 (18): 494–8. Май 2008 г. PMID 18463608. В архиве с оригинала от 11 октября 2017 года.

- ^ "ВОЗ | Оспа". ВОЗ. Всемирная организация здоровья. Получено 2019-04-16.
- ^ «Регион Юго-Восточной Азии ВОЗ сертифицирован как свободный от полиомиелита». ВОЗ. 27 марта 2014 г. В архиве из оригинала 27 марта 2014 г.. Получено 3 ноября, 2014.
- ^ «19 июля 2017 г. Вакцины продвигаются как ключ к искоренению устойчивых к лекарствам микробов «Иммунизация может остановить устойчивые инфекции до того, как они начнутся, - говорят ученые из промышленных и академических кругов."". Архивировано из оригинал 22 июля 2017 г.
- ^ Салливан П. (13 апреля 2005 г.). «Морис Р. Хиллеман умер; создал вакцины». Мыть. Опубликовать. В архиве с оригинала от 20.10.2012. Получено 2014-01-09.

- ^ Дадли, Мэтью Зи; Холзи, Нил А; Омер, Саад Б.; Оренштейн, Вальтер А; О'Лири, Шон Т; Limaye, Rupali J; Лосось, Даниэль А (май 2020 г.). «Состояние науки о безопасности вакцин: систематические обзоры доказательств». Ланцетные инфекционные болезни. 20 (5): e80 – e89. Дои:10.1016 / с 1473-3099 (20) 30130-4. ISSN 1473-3099.
- ^ а б c d Маглионе М.А., Дас Л., Рааен Л., Смит А., Чари Р., Ньюберри С., Шанман Р., Перри Т., Гетц МБ, Гиденджил С. (август 2014 г.). «Безопасность вакцин, используемых для плановой иммунизации детей в США: систематический обзор». Педиатрия. 134 (2): 325–37. Дои:10.1542 / пед.2014-1079. PMID 25086160.
- ^ а б c «Возможные побочные эффекты от вакцин». Центры по контролю и профилактике заболеваний. 2018-07-12. В архиве из оригинала 17 марта 2017 г.. Получено 24 февраля 2014.
- ^ «Сезонная прививка от гриппа - сезонный грипп (грипп)». CDC. 2018-10-02. Архивировано из оригинал на 2015-10-01. Получено 2017-09-17.
- ^ Looker C, Heath K (2011). «Компенсация без вины после побочных эффектов, связанных с вакцинацией: обзор международных программ». Бюллетень Всемирной организации здравоохранения. Слово организации здравоохранения. 89 (5): 371–8. Дои:10.2471 / BLT.10.081901. ЧВК 3089384. PMID 21556305.
- ^ «Типы вакцин». Национальный институт аллергии и инфекционных заболеваний. 2012-04-03. В архиве из оригинала от 05.09.2015. Получено 2015-01-27.
- ^ «Типы вакцин». В архиве из оригинала от 29.07.2017. Получено 19 октября, 2017.
- ^ а б c «Различные типы вакцин | История вакцин». www.historyofvaccines.org. Получено 2019-06-14.
- ^ Синха Дж. К., Бхаттачарья С. Учебник иммунологии (Предварительный просмотр книги Google). Академические издательства. п. 318. ISBN 978-81-89781-09-5. Получено 2014-01-09.
- ^ «Различные типы вакцин | История вакцин». www.historyofvaccines.org. Получено 2019-05-03.
- ^ «Типы вакцин». Coastalcarolinaresearch.com. Получено 2019-05-03.
- ^ Филадельфия, Детская больница (18.08.2014). «Взгляд на каждую вакцину: вакцина против гепатита B». www.chop.edu. Получено 2019-06-14.
- ^ "Вакцина против ВПЧ | Вирус папилломы человека | CDC". www.cdc.gov. 2019-05-13. Получено 2019-06-14.
- ^ Williamson, E.D .; Eley, S.M .; Гриффин, К. Ф .; Грин, М .; Russell, P .; Лири, С. Э .; Oyston, P.C .; Истербрук, Т .; Реддин, К. М. (декабрь 1995 г.). «Новая улучшенная субъединичная вакцина против чумы: основа защиты». FEMS Иммунология и медицинская микробиология. 12 (3–4): 223–230. Дои:10.1111 / j.1574-695X.1995.tb00196.x. ISSN 0928-8244. PMID 8745007.
- ^ «Вакцины конъюгированные с полисахаридным белком». www.globalhealthprimer.emory.edu. Получено 2019-06-14.
- ^ Скотт (апрель 2004 г.). «Классификация вакцин» (PDF). BioProcesses International: 14–23. В архиве (PDF) из оригинала 12.12.2013. Получено 2014-01-09.
- ^ Ким В., Ляу Л.М. (январь 2010 г.). «Дендритно-клеточные вакцины от опухолей головного мозга». Клиники нейрохирургии Северной Америки. 21 (1): 139–57. Дои:10.1016 / j.nec.2009.09.005. ЧВК 2810429. PMID 19944973.
- ^ Anguille S, Smits EL, Lion E, van Tendeloo VF, Berneman ZN (июнь 2014 г.). «Клиническое использование дендритных клеток для лечения рака». Ланцет. Онкология. 15 (7): e257-67. Дои:10.1016 / S1470-2045 (13) 70585-0. PMID 24872109.
- ^ Маккензи, Дэвид (26 мая 2018 г.). «Страх и неудача: как Эбола вызвала глобальную революцию в области здравоохранения». CNN. Получено 26 мая 2018.
- ^ Мери С., Йорденс М., Ярва Х. (декабрь 2008 г.). «Ингибиторы микробного комплемента как вакцины». Вакцина. 26 Дополнение 8: I113-7. Дои:10.1016 / j.vaccine.2008.11.058. PMID 19388175.
- ^ Лоу (2008). «Плазмидная ДНК как профилактические и лечебные вакцины против рака и инфекционных заболеваний». Плазмиды: текущие исследования и будущие тенденции. Caister Academic Press. ISBN 978-1-904455-35-6.
- ^ "Моновалентный " в Медицинский словарь Дорланда
- ^ Поливалентная вакцина в Медицинский словарь Дорландса В архиве 7 марта 2012 г. Wayback Machine
- ^ «Вопросы и ответы о моновалентной пероральной вакцине против полиомиелита типа 1 (мОПВ1)», выпущенные совместно ВОЗ и ЮНИСЕФ'". Вызов педиатра. 2 (8). 3. Какие преимущества у мОПВ1 перед трехвалентной пероральной вакциной против полиомиелита (тОПВ)? 2005-01-08. Архивировано из оригинал на 2012-02-29.
- ^ Саттер Р. У., Кочи С. Л., Мельник Д. Л. (1999). «Живые аттенуированные вакцины против полиомиелита». В Плоткин С.А., Оренштейн В.А. (ред.). Вакцина. Филадельфия: В. Б. Сондерс. С. 364–408.
- ^ Канеса-тасан Н., Сан В., Ким-Ан Дж., Ван Альберт С., Путнак-младший, Кинг А., Раенгсакульсрах Б., Крист-Шмидт Г., Гилсон К., Заградник Дж. М., Вон Д. В., Иннис Б. Л., Салуццо Дж. Ф., Хок СН (апрель 2001). «Безопасность и иммуногенность аттенуированных вакцин против вируса денге (Aventis Pasteur) для людей-добровольцев». Вакцина. 19 (23–24): 3179–88. CiteSeerX 10.1.1.559.8311. Дои:10.1016 / S0264-410X (01) 00020-2. PMID 11312014.
- ^ Энглер, Рената Дж. М .; Гринвуд, Джон Т .; Pittman, Phillip R .; Грабенштейн, Джон Д. (1 августа 2006 г.). «Иммунизация для защиты вооруженных сил США: наследие, текущая практика и перспективы». Эпидемиологические обзоры. 28 (1): 3–26. Дои:10.1093 / эпирев / mxj003. ISSN 0193-936X. PMID 16763072.
- ^ Sox, Harold C .; Liverman, Catharyn T .; Фулько, Кэролайн Э .; Война, Комитет Медицинского института (США) по последствиям для здоровья, связанным с облучением в Персидском заливе (2000 г.). Вакцина. Национальная академия прессы (США).
- ^ «Институт безопасности вакцин - таблица тимеросала». В архиве из оригинала от 10.12.2005.
- ^ Wharton, Melinda E .; Национальный консультативный комитет по вакцинам «Национальный план вакцинации США» В архиве 2016-05-04 в Wayback Machine
- ^ «Измерение негазообразных загрязнителей воздуха> Металлы». npl.co.uk. Национальная физическая лаборатория. Архивировано из оригинал 29 сентября 2007 г.. Получено 28 июн 2020.
- ^ «Тимеросал в вакцинах». Центр оценки и исследований биологических препаратов, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 2007-09-06. В архиве из оригинала от 06.01.2013. Получено 2007-10-01.
- ^ Бигхэм М., Копы Р. (2005). «Тиомерсал в вакцинах: баланс между риском побочных эффектов и риском заболеваний, предупреждаемых с помощью вакцин». Безопасность лекарств. 28 (2): 89–101. Дои:10.2165/00002018-200528020-00001. PMID 15691220. S2CID 11570020.
- ^ Offit PA (Сентябрь 2007 г.). «Тимеросал и вакцины - поучительная история». Медицинский журнал Новой Англии. 357 (13): 1278–9. Дои:10.1056 / NEJMp078187. PMID 17898096. S2CID 36318722.
- ^ 5 марта, обновленное агентство Reuters; 2019 (2019-03-05). «Другое исследование, проведенное среди 657 тысяч детей, показывает, что вакцина MMR не вызывает аутизм | Montreal Gazette». Получено 2019-03-13.CS1 maint: числовые имена: список авторов (связь)
- ^ Хоффман Дж (2019-03-05). «Еще раз, с большими данными: вакцина от кори не вызывает аутизм». Нью-Йорк Таймс. ISSN 0362-4331. Получено 2019-03-13.
- ^ CDC (12 июля 2018 г.). «Ингредиенты вакцин - информационный бюллетень». В архиве с оригинала 17 декабря 2009 г.. Получено 20 декабря, 2009.
- ^ Уровни содержания ртути в таблице, если не указано иное, взяты из: Уровни ртути в промысловой рыбе и моллюсках (1990-2010 гг.) В архиве 2015-05-03 в Wayback Machine Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. По состоянию на 8 января 2012 г.
- ^ а б Центры по контролю и профилактике заболеваний, Названия вакцин в США, в архиве из оригинала от 26.05.2016, получено 2016-05-21.
- ^ а б Центры по контролю и профилактике заболеваний (2018-08-07), Вакцинация от столбняка (столбняка), в архиве из оригинала от 16.05.2016, получено 2016-05-21.
- ^ Центры по контролю и профилактике заболеваний (2018-02-02), Акронимы и аббревиатуры вакцин [аббревиатуры, используемые в записях о вакцинации в США], в архиве из оригинала на 2017-06-02, получено 2017-05-22.
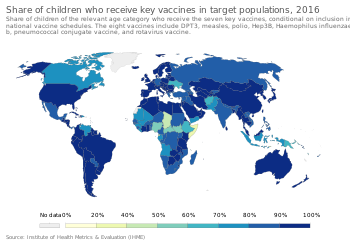
- ^ «Доля детей, получивших ключевые вакцины, в целевых группах». Наш мир в данных. Получено 5 марта 2020.
- ^ «Домашняя страница рекомендаций по вакцинам ACIP». CDC. 2013-11-15. В архиве из оригинала 31.12.2013. Получено 2014-01-10.
- ^ «Таблица статуса вакцины». Красная книга онлайн. Американская академия педиатрии. 26 апреля 2011 г. В архиве с оригинала 27 декабря 2013 г.. Получено 9 января, 2013.
- ^ «Безопасность вакцины против ВПЧ». Центры по контролю и профилактике заболеваний (CDC). 2013-12-20. В архиве из оригинала от 10.11.2009. Получено 2014-01-10.
- ^ «Вакцина против ВПЧ в чистом виде». Выбор NHS. 2009-10-02. В архиве из оригинала 10.01.2014. Получено 2014-01-10.

- ^ Гудман JL (2005-05-04). "Заявление Джесси Л. Гудмана, доктора медицины, директора MPH Центра биологических, оценки и исследований, Управления по контролю за продуктами и лекарствами США, Министерства здравоохранения и социальных служб США о поставках и препаратах против гриппа в США для предстоящего сезона гриппа перед Подкомитетом по надзору и расследованиям Палата представителей США по вопросам энергетики и торговли ". В архиве из оригинала 21.09.2008. Получено 2008-06-15.
- ^ Олесен О.Ф., Лоннрот А., Маллиган Б. (январь 2009 г.). «Исследование вакцин для человека в Европейском Союзе». Вакцина. 27 (5): 640–5. Дои:10.1016 / j.vaccine.2008.11.064. ЧВК 7115654. PMID 19059446.
- ^ Jit M, Newall AT, Beutels P (апрель 2013 г.). «Ключевые вопросы оценки воздействия и экономической эффективности стратегий вакцинации против сезонного гриппа». Человеческие вакцины и иммунотерапевтические препараты. 9 (4): 834–40. Дои:10.4161 / hv.23637. ЧВК 3903903. PMID 23357859.
- ^ Ньюолл А. Т., Рейес Дж. Ф., Вуд Дж. Г., Макинтайр П., Мензис Р., Бейтелс П. (февраль 2014 г.). «Экономические оценки внедренных программ вакцинации: ключевые методологические проблемы ретроспективного анализа». Вакцина. 32 (7): 759–65. Дои:10.1016 / j.vaccine.2013.11.067. PMID 24295806.
- ^ Розер, Макс; Вандерслотт, Саманта (2013-05-10). «Вакцинация». Наш мир в данных.
- ^ Хардман Рейс Т (2006). «Роль интеллектуальной собственности в глобальной проблеме иммунизации». J World Intellect Prop. 9 (4): 413–25. Дои:10.1111 / j.1422-2213.2006.00284.x.
- ^ "www.who.int" (PDF). В архиве (PDF) из оригинала от 23.11.2015.
- ^ «Три способа сделать вакцину» (инфографика). В архиве из оригинала от 23.12.2015. Получено 2015-08-05, в Стейн, Роб (24 ноября 2009 г.). «Система вакцины остается устаревшей». Вашингтон Пост. В архиве из оригинала от 19 октября 2017 года.
- ^ а б Музумдар Дж. М., Клайн Р. Р. (2009). «Предложение, спрос и политика в отношении вакцин: учебник». Журнал Американской ассоциации фармацевтов. 49 (4): e87-99. Дои:10.1331 / ЯФА.2009.09007. ЧВК 7185851. PMID 19589753.
- ^ а б «Компоненты вакцины». В архиве из оригинала от 13.06.2017.
- ^ а б Bae K, Choi J, Jang Y, Ahn S, Hur B (апрель 2009 г.). «Инновационные технологии производства вакцин: эволюция и ценность технологий производства вакцин». Архив фармакологических исследований. 32 (4): 465–80. Дои:10.1007 / s12272-009-1400-1. PMID 19407962. S2CID 9066150.
- ^ «Цели целевой группы по вакцинам» (PDF). assets.publishing.service.gov.uk. 6 апреля 2020 г.. Получено 2020-07-26.
- ^ Паглюси, Соня; Джарретт, Стивен; Хейман, Бенуа; Крейса, Ульрике; Прасад, Саи Д .; Рирс, Мартин; Хонг Тай, Фам; Ву, Кэ; Чжан, Юнь Тао; Пэк, Ён Ок; Кумар, Ананд (июль 2020 г.). «Новые производители участвуют в исследованиях, разработке и поставках вакцины COVID-19». Вакцина. 38 (34): 5418–5423. Дои:10.1016 / j.vaccine.2020.06.022. ЧВК 7287474. PMID 32600908.
- ^ Миллер, Джо; Кучлер, Ханна (2020-04-28). «Производители лекарств стремятся увеличить производство вакцин». www.ft.com. Получено 2020-07-26.
- ^ Персонал (15 ноября 2011 г.). «Индия производит 60 процентов вакцин в мире». Индонезия. Антара. В архиве из оригинала 19 сентября 2015 г.. Получено 2015-08-05.
- ^ Морейн Б., Ху К.Ф., Абусугра I. (июнь 2004 г.). «Текущее состояние и возможности применения ISCOM в ветеринарии». Расширенные обзоры доставки лекарств. 56 (10): 1367–82. Дои:10.1016 / j.addr.2004.02.004. PMID 15191787.
- ^ Американская медицина. Издательство "Америкэн-Медицина". 1926 г.
- ^ Южноафриканский институт медицинских исследований (1929). Годовой отчет [Jaarverslag]. Южноафриканский институт медицинских исследований - Suid-Afrikaanse Instituut vir Mediese Navorsing.
- ^ Хан Ф.А. (20.09.2011). Основы биотехнологии. CRC Press. п. 270. ISBN 978-1-4398-2009-4.
- ^ Джудис Е.Л., Кэмпбелл Д.Д. (апрель 2006 г.). «Безыгольная доставка вакцины». Расширенные обзоры доставки лекарств. 58 (1): 68–89. Дои:10.1016 / j.addr.2005.12.003. PMID 16564111.
- ^ ВОЗ протестируют систему безыгольной доставки Nanopatch | ABC News, 16 сен 2014 г. | "Безыгольная вакцина против полиомиелита" меняет правила игры'". 2014-09-16. В архиве из оригинала от 02.04.2015. Получено 2015-09-15.
- ^ «Австралийские ученые разрабатывают вакцинацию без иглы». Sydney Morning Herald. 18 августа 2013 г. В архиве из оригинала 25 сентября 2015 г.
- ^ «Vaxxas собирает 25 миллионов долларов, чтобы вывести Nanopatch в Брисбене на мировой рынок». Еженедельный обзор бизнеса. 2015-02-10. Архивировано из оригинал на 2015-03-16. Получено 2015-03-05.
- ^ «Австралийские ученые разрабатывают вакцинацию без иглы». Индуистский. Ченнаи, Индия. 28 сентября 2011 г. В архиве из оригинала от 1 января 2014 г.
- ^ «Безыгольная система доставки вакцины с нанопатчем». Новости медицины. 3 августа 2011 г. В архиве из оригинала 11 мая 2012 г.
- ^ Патель Дж. Р., Хелденс Дж. Г. (март 2009 г.). «Иммунопрофилактика против серьезных вирусных заболеваний лошадей, сельскохозяйственных животных и птиц». Вакцина. 27 (12): 1797–1810. Дои:10.1016 / j.vaccine.2008.12.063. ЧВК 7130586. PMID 19402200.
- ^ а б Беркельман Р.Л. (август 2003 г.). «Заболевания человека, связанные с использованием ветеринарных вакцин». Клинические инфекционные болезни. 37 (3): 407–14. Дои:10.1086/375595. PMID 12884166.
- ^ ван Оиршот Дж. Т., Рзиха Х. Дж., Мунен П. Дж., Пол Дж. М., ван Заане Д. (июнь 1986 г.). «Дифференциация сывороточных антител от свиней, вакцинированных или инфицированных вирусом болезни Ауески, с помощью конкурентного иммуноферментного анализа». Журнал общей вирусологии. 67 (Pt 6) (6): 1179–82. Дои:10.1099/0022-1317-67-6-1179. PMID 3011974.
- ^ а б ван Оиршот Дж. Т. (август 1999 г.). «Вакцины Diva, снижающие передачу вируса». Журнал биотехнологии. 73 (2–3): 195–205. Дои:10.1016 / S0168-1656 (99) 00121-2. PMID 10486928.
- ^ ван Оиршот Дж. Т., Гилкенс А. Л., Мурманн Р. Дж., Бернс А. Дж. (июнь 1990 г.). «Маркерные вакцины, анализы вирусных белков-специфических антител и контроль болезни Ауески». Ветеринарная микробиология. 23 (1–4): 85–101. Дои:10.1016 / 0378-1135 (90) 90139-М. PMID 2169682.
- ^ Каашук М.Дж., Моэрман А., Мадич Дж., Райсевик Ф.А., Квак Дж., Гилкенс А.Л., ван Оиршот Дж. Т. (апрель 1994 г.). «Традиционно аттенуированный гликопротеин-отрицательный штамм герпесвируса крупного рогатого скота типа 1 - эффективная и безопасная вакцина». Вакцина. 12 (5): 439–44. Дои:10.1016 / 0264-410X (94) 90122-8. PMID 8023552.
- ^ Хульст М.М., Вестра Д.Ф., Венсвоорт Г., Мурманн Р.Дж. (сентябрь 1993 г.). «Гликопротеин E1 вируса холеры свиней, экспрессируемый в клетках насекомых, защищает свиней от холеры свиней». Журнал вирусологии. 67 (9): 5435–42. Дои:10.1128 / JVI.67.9.5435-5442.1993. ЧВК 237945. PMID 8350404.
- ^ Capua I, Terregino C, Cattoli G, Mutinelli F, Rodriguez JF (февраль 2003 г.). «Разработка стратегии DIVA (дифференциация инфицированных от вакцинированных животных) с использованием вакцины, содержащей гетерологичную нейраминидазу, для борьбы с птичьим гриппом». Патология птиц. 32 (1): 47–55. Дои:10.1080/0307945021000070714. PMID 12745380. S2CID 22827454.
- ^ Маас А., Минс Дж., Балтес Н., Хенниг-Паука И., Герлах Г.Ф. (ноябрь 2006 г.). «Разработка субъединичной вакцины DIVA против инфекции Actinobacillus pleuropneumoniae». Вакцина. 24 (49–50): 7226–37. Дои:10.1016 / j.vaccine.2006.06.047. PMID 17027123.
- ^ Leyman B, Boyen F, Van Parys A, Verbrugghe E, Haesebrouck F, Pasmans F (май 2011 г.). «Мутации LPS Salmonella Typhimurium для использования в вакцинах, позволяющие дифференцировать инфицированных и вакцинированных свиней». Вакцина. 29 (20): 3679–85. Дои:10.1016 / j.vaccine.2011.03.004. HDL:1854 / LU-1201519. PMID 21419163. В архиве из оригинала от 28.10.2017.
- ^ Нидхэм, Джозеф. (2000). Наука и цивилизация в Китае: Том 6, Биология и биологические технологии, Часть 6, Медицина. Кембридж: Издательство Кембриджского университета. стр.154
- ^ Уильямс G (2010). ангел смерти. Бейзингстоук: Пэлгрейв Макмиллан. ISBN 978-0-230-27471-6.
- ^ Сильверштейн AM (2009). История иммунологии (2-е изд.). Академическая пресса. п. 293. ISBN 978-0-08-091946-1..
- ^ а б c Стерн А.М., Маркель Х (2005). «История вакцин и иммунизации: знакомые модели, новые проблемы». По вопросам здравоохранения. 24 (3): 611–21. Дои:10.1377 / hlthaff.24.3.611. PMID 15886151.
- ^ Данн PM (январь 1996 г.). «Доктор Эдвард Дженнер (1749-1823) из Беркли и вакцинация от оспы» (PDF). Архивы болезней детства: издание для плода и новорожденного. 74 (1): F77-8. Дои:10.1136 / fn.74.1.F77. ЧВК 2528332. PMID 8653442. Архивировано из оригинал (PDF) на 2011-07-08.
- ^ Ван Сант Дж. Э. (2008). «Вакцинаторы: оспа, медицинские знания и« открытие »Японии». J Hist Med Allied Sci. 63 (2): 276–79. Дои:10.1093 / jhmas / jrn014.
- ^ Диджен Дж. А. (май 1963 г.). «Разработка противооспенной вакцины в Англии в восемнадцатом и девятнадцатом веках». Британский медицинский журнал. 1 (5342): 1367–72. Дои:10.1136 / bmj.1.5342.1367. ЧВК 2124036. PMID 20789814.
- ^ Баарда Б.И., Сикора А.Е. (2015). «Протеомика Neisseria gonorrhoeae: охота за сокровищами для противодействия старой болезни». Границы микробиологии. 6: 1190. Дои:10.3389 / fmicb.2015.01190. ЧВК 4620152. PMID 26579097; Доступ предоставляется Питтсбургский университет.
- ^ а б c Аларкон Дж. Б., Уэйн Г. В., Макманус Д. П. (1999). «ДНК-вакцины: технология и применение в качестве антипаразитарных и антимикробных агентов». Успехи в паразитологии Том 42. Успехи паразитологии. 42. С. 343–410. Дои:10.1016 / S0065-308X (08) 60152-9. ISBN 9780120317424. PMID 10050276.
- ^ Робинсон Х.Л., Пертмер TM (2000). ДНК-вакцины от вирусных инфекций: основные исследования и применение. Достижения в вирусных исследованиях. 55. С. 1–74. Дои:10.1016 / S0065-3527 (00) 55001-5. ISBN 9780120398553. PMID 11050940.
- ^ Регаладо, Антонио. «Правительство США начало испытания своей первой вакцины против вируса Зика на людях». Получено 2016-08-06.
- ^ Чен Й, Ван С., Лу С. (февраль 2014 г.). «Иммунизация ДНК для разработки вакцины против ВИЧ». Вакцина. 2 (1): 138–59. Дои:10.3390 / вакцины2010138. ЧВК 4494200. PMID 26344472.
- ^ а б c d е ж грамм Плоткин С.А. (апрель 2005 г.). «Вакцины: прошлое, настоящее и будущее». Природа Медицина. 11 (4 Прил.): S5-11. Дои:10,1038 / нм1209. ЧВК 7095920. PMID 15812490.
- ^ Карлсон Б (2008). «Взрослые сейчас являются движущей силой роста рынка вакцин». Gen. Eng. Biotechnol. Новости. 28 (11). С. 22–3. В архиве из оригинала 10.01.2014.

- ^ Кляйн С.Л., Едличка А., Пекош А. (май 2010 г.). «X и Y иммунных ответов на вирусные вакцины». Ланцет. Инфекционные заболевания. 10 (5): 338–49. Дои:10.1016 / S1473-3099 (10) 70049-9. ЧВК 6467501. PMID 20417416.
- ^ Персонал (28 марта 2013 г.). «Создана более безопасная вакцина без вирусов». The Japan Times. Агентство Франс-Пресс - Jiji Press. В архиве из оригинала 30 марта 2013 г.. Получено 2013-03-28.
- ^ Spohn G, Bachmann MF (февраль 2008 г.). «Использование вирусных свойств для рационального дизайна современных вакцин». Экспертный обзор вакцин. 7 (1): 43–54. Дои:10.1586/14760584.7.1.43. PMID 18251693. S2CID 40130001.
- ^ Самуэльссон О., Херлитц Х (март 2008 г.). «Вакцинация от высокого кровяного давления: новая стратегия». Ланцет. 371 (9615): 788–9. Дои:10.1016 / S0140-6736 (08) 60355-4. PMID 18328909. S2CID 38323966.
- ^ Польша Г.А., Якобсон Р.М., Овсянникова И.Г. (май 2009 г.). «Тенденции, влияющие на будущее разработки и доставки вакцин: роль демографии, нормативной науки, движения против вакцин и вакциномики». Вакцина. 27 (25–26): 3240–4. Дои:10.1016 / j.vaccine.2009.01.069. ЧВК 2693340. PMID 19200833.
- ^ Зала Ф, Мануэла Ригано М, Барбанте А, Бассо Б, Уолмсли А.М., Кастильоне S (январь 2003 г.). «Продукция вакцинного антигена в трансгенных растениях: стратегии, генные конструкции и перспективы». Вакцина. 21 (7–8): 803–8. Дои:10.1016 / s0264-410x (02) 00603-5. PMID 12531364.
- ^ Кумар Г.Б., Ганапати Т.Р., Ревати С.Дж., Шринивас Л., Бапат В.А. (октябрь 2005 г.). «Экспрессия поверхностного антигена гепатита В в трансгенных растениях банана». Planta. 222 (3): 484–93. Дои:10.1007 / s00425-005-1556-у. PMID 15918027. S2CID 23987319.
- ^ Остачук А.И., Кьявенна С.М., Гомес С., Пекора А., Перес-Филгейра М.Д., Эскрибано Дж.М., Ардила Ф., Дус М.Дж., Сантос А.В. (2009). «Экспрессия слитого белка ScFv-E2T в клетках CHO-K1 и трансгенных растениях люцерны для селективного направления к антигенпрезентирующим клеткам». Ветеринарная иммунология и иммунопатология. 128 (1): 315. Дои:10.1016 / j.vetimm.2008.10.224. В архиве из оригинала на 2018-05-01.
- ^ Peréz Aguirreburualde MS, Gómez MC, Ostachuk A, Wolman F, Albanesi G, Pecora A, Odeon A, Ardila F, Escribano JM, Dus Santos MJ, Wigdorovitz A (февраль 2013 г.). «Эффективность вакцины субъединицы BVDV, произведенной в трансгенных растениях люцерны». Ветеринарная иммунология и иммунопатология. 151 (3–4): 315–24. Дои:10.1016 / j.vetimm.2012.12.004. PMID 23291101.
внешняя ссылка
| Внешнее видео | |
|---|---|
- Вакцины и антисыворотки в Керли
- ВОЗ болезни, предотвращаемые с помощью вакцин, и иммунизация
- Документы с изложением позиции Всемирной организации здравоохранения по вакцинам
- История вакцин, от Колледж врачей Филадельфии
- Этот сайт был отмечен Новости генной инженерии и биотехнологии в разделе «Лучшее в Интернете» в январе 2015 года. См.: «История вакцин». Лучшее из Интернета. Новости генной инженерии и биотехнологии. 35 (2). 15 января 2015. с. 38.
- Программа вакцинологии Оксфордского университета: серия коротких курсов по вакцинологии

