Вакцина против Эболы - Ebola vaccine
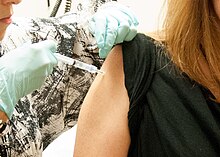 Кандидат Вакцина против Эболы дается | |
| Описание вакцины | |
|---|---|
| Целевая болезнь | Вирус Эбола |
| Тип | Ослабленный вирус |
| Клинические данные | |
| Торговые наименования | Эрвебо, Забдено, Мвабеа |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
Вакцины против Эболы находятся вакцина либо одобрено, либо в разработке, чтобы предотвратить Эбола. Первая вакцина, одобренная в США, была рВСВ-ЗЕБОВ в декабре 2019 года.[1][2] Он широко использовался в Эпидемия Эболы в Киву под сострадательное использование протокол.[3] В начале 21 века несколько вакцин-кандидатов продемонстрировали эффективность для защиты нечеловеческих приматов (обычно макаки ) против смертельной инфекции.[4][5][6]
Вакцины включают репликация -дефицитный аденовирус векторы, репликационно-компетентные везикулярный стоматит (VSV) и парагрипп человека (HPIV-3) векторы и вирусоподобные наночастица препараты. Обычные испытания по изучению эффективности воздействия на человека патогена после иммунизации в этом случае неэтичны. Для таких ситуаций США Управление по контролю за продуктами и лекарствами (FDA) установило "правило эффективности животных "разрешение на утверждение лицензии на основании модель животных исследования, которые воспроизводят человеческое заболевание, в сочетании с доказательствами безопасности и потенциально мощным иммунная реакция (антитела в крови) от людей, которым была введена вакцина. Клинические испытания включают введение вакцины здоровым людям для оценки иммунного ответа, выявления любых побочных эффектов и определения подходящей дозировки.[7]
Утверждено
рВСВ-ЗЕБОВ
VSV-EBOV или рВСВ-ЗЕБОВ, продаваемая под торговой маркой Ervebo, представляет собой вакцину на основе везикулярный стоматит вирус, который был генетически модифицирован для экспрессии поверхности гликопротеин из Заирский вирус Эбола.[8][9] В ноябре 2019 года Европейская комиссия выдала условное разрешение на продажу.[10] Предварительная квалификация ВОЗ была проведена менее чем через 48 часов, что сделало ее самым быстрым процессом предварительной квалификации, когда-либо проводившимся ВОЗ.[11] Он был одобрен для медицинского применения в Европейском Союзе в ноябре 2019 года.[12] Он был одобрен для медицинского применения в США в декабре 2019 года.[1][13]
Наиболее частые побочные эффекты включают боль, отек и покраснение в месте инъекции, головную боль, жар, мышечную боль, усталость и боль в суставах.[12] Как правило, эти реакции возникают в течение семи дней после вакцинации, от легкой до умеренной по интенсивности и проходят менее чем за неделю.[12]
Он был разработан Агентство общественного здравоохранения Канады, с последующим развитием Merck Inc.[14] В октябре 2014 г. Wellcome Trust, который также был одним из крупнейших основателей Великобритании,[15] объявила о начале нескольких испытаний на здоровых добровольцах в Европе, Габоне, Кении и США.[16] Безопасность вакцины была подтверждена в нескольких центрах в Северной Америке, Европе и Африке, но у нескольких добровольцев в одном исследовательском центре в Женеве, Швейцария, примерно через две недели развился связанный с вакциной артрит, и около 20–30% добровольцев в пунктах регистрации. развилась поствакцинальная лихорадка легкой степени тяжести, которая прошла в течение одного-двух дней. Другими частыми побочными эффектами были боль в месте инъекции, миалгия и утомляемость.[17] Судебное разбирательство было временно приостановлено в декабре 2014 года из-за возможных побочных эффектов, но впоследствии возобновилось.[18] По состоянию на апрель 2015 г.[Обновить], исследование фазы III с однократной дозой VSV-EBOV началось в Либерии после успешного исследования фазы II в стране Западной Африки.[19] 31 июля 2015 г. предварительные результаты испытаний фазы III в Гвинее показали, что вакцина оказалась «высокоэффективной и безопасной».[20] Испытание использовало кольцевая вакцинация протокол, согласно которому в первый раз вакцинировались все самые близкие люди, контактировавшие с новыми случаями инфекции Эбола, сразу или через 21 день. Благодаря продемонстрированной эффективности немедленной вакцинации все реципиенты будут немедленно иммунизированы.[21][22] Кольцевая вакцинация - это метод, используемый в программе для искоренения оспа в 1970-е гг. Испытание будет продолжено для оценки эффективности вакцины в создании коллективный иммунитет заражению вирусом Эбола.[23] В декабре 2016 года исследование показало, что вакцина VSV-EBOV эффективна против вируса Эбола на 95–100%, что делает ее первой проверенной вакциной против этого заболевания.[24][25][26]
Это одобрение было подтверждено исследованием, проведенным в Гвинее во время Вспышка 2014–2016 гг. у лиц в возрасте 18 лет и старше.[1] Исследование представляло собой рандомизированное кластерное (кольцевое) исследование вакцинации, в котором 3 537 человек, контактировавших и контактировавших с людьми с лабораторно подтвержденной болезнью, вызванной вирусом Эбола (БВВЭ), получили либо «немедленную», либо «отсроченную» вакцинацию на 21 день.[1] Этот дизайн был предназначен для охвата социальной сети людей и мест, которые могут включать жилища или рабочие места, где пациент проводил время при симптомах, или семьи людей, которые контактировали с пациентом во время болезни или смерти этого человека.[1] При сравнении случаев БВВЭ среди 2108 человек в группе «немедленной» вакцинации и 1429 человек в группе «отсроченной» вакцинации было установлено, что Ervebo на 100% эффективен в предотвращении случаев заболевания Эболой с появлением симптомов более чем через десять дней после вакцинации.[1] Ни одного случая БВВЭ с появлением симптомов более чем через десять дней после вакцинации не наблюдалось в группе «немедленного» кластера, по сравнению с десятью случаями БВВЭ в группе «отсроченного» 21 дня.[1]
В дополнительных исследованиях антительный ответ был оценен у 477 человек в Либерии, около 500 человек в Сьерра-Леоне и около 900 человек в Канаде, Испании и США.[1] Ответы антител среди участников исследования, проведенного в Канаде, Испании и США, были аналогичны таковым среди лиц в исследованиях, проведенных в Либерии и Сьерра-Леоне.[1]
Безопасность была оценена примерно у 15 000 человек в Африке, Европе и Северной Америке.[1] Наиболее частыми побочными эффектами были боль, отек и покраснение в месте инъекции, а также головная боль, жар, боли в суставах и мышцах и усталость.[1]
В декабре 2016 года исследование показало, что вакцина VSV-EBOV эффективна против вируса Эбола на 70–100%, что делает ее первой проверенной вакциной против этого заболевания.[24][25][26] Однако дизайн этого исследования и высокая эффективность вакцины были поставлены под сомнение.[27] В ноябре 2019 года Европейская комиссия предоставила Ervebo условное разрешение на продажу (rVSV∆G-ZEBOV-GP, live)[28] и ВОЗ впервые провела предварительную квалификацию вакцины против Эболы.[11]
Ad26.ZEBOV / MVA-BN-Filo
Схема приема двух доз Ad26.ZEBOV и MVA-BN-Filo, продаваемых под торговыми марками Zabdeno и Mvabea,[29][30] был разработан Джонсон и Джонсон на своем Janssen Pharmaceutical Компания. Он был одобрен для медицинского использования в Европейском Союзе в июле 2020 года.[31][29][30]
Схема состоит из двух компонентов вакцины (первая вакцина является первичной, а затем вторая вакцина. увеличение )[32] - первый на базе технологии AdVac от Crucell Holland B.V. (входит в состав Janssen), второй основан на технологии MVA-BN от Баварский нордический. Ad26.ZEBOV происходит от аденовируса человека серотипа 26 (Ad26), экспрессирующего вариантный гликопротеин Mayinga вируса Эбола, в то время как второй компонент MVA-BN представляет собой Модифицированный вирус осповакцины Анкара - Баварский нордический (MVA-BN) фило-вектор.[33] Этот продукт начал фазу I клиническое испытание на Институт Дженнера в Оксфорде в январе 2015 года.[34][35] Предварительные данные показали, что режим первичной бустерной вакцины вызывал временный иммунологический ответ у добровольцев, как и ожидалось от вакцинации. В исследовании фазы II приняли участие 612 взрослых добровольцев, и оно началось в июле 2015 года в Великобритании и Франции. Второе испытание фазы II с участием 1200 добровольцев было начато в Африке.[32] при этом первое судебное разбирательство началось в Сьерра-Леоне в октябре 2015 года.[36]
В сентябре 2019 г. Комитет по лекарственным средствам для человека (CHMP) Европейское агентство по лекарствам (EMA) предоставила компании Janssen ускоренную оценку Ad26.ZEBOV и MVA-BN-Filo,[37] а в ноябре 2019 года Janssen представила Заявление на получение разрешения на маркетинг (MAA) в EMA для утверждения Ad26.ZEBOV и MVA-BN-Filo.[37][38]
В мае 2020 года EMA CHMP рекомендовало предоставить разрешение на продажу комбинации вакцин Ad26.ZEBOV (Zabdeno) и MVA-BN-Filo (Mvabea).[39][40][41] Забдено вводят первым, а Мвабеа вводят примерно через восемь недель в качестве ревакцинации.[39] Таким образом, этот профилактический двухдозовый режим не подходит для реагирования на вспышку, когда необходима немедленная защита.[39] В качестве меры предосторожности для лиц, подвергающихся непосредственному риску заражения вирусом Эбола (например, медицинских работников и тех, кто живет или посещает районы с продолжающейся вспышкой болезни, вызванной вирусом Эбола), следует рассмотреть возможность дополнительной ревакцинации Забдено для лиц, завершивших Забдено- Схема вакцинации двумя дозами мвабеа более четырех месяцев назад.[39] Эффективность для людей еще не известна, поскольку эффективность экстраполирована из исследований на животных.[42]
В развитии
| Статьи, относящиеся к |
| Западноафриканский Эпидемия вируса Эбола |
|---|
 |
| Обзор |
| Страны с широко распространенными случаями |
| Другие пострадавшие страны |
| Другие вспышки |
| Вакцина | Ассоциированные организации | Статус |
|---|---|---|
| Вектор гликопротеина аденовируса шимпанзе 3 (cAd3-EBO Z) | GSK & НИАИД | Этап III Февраль 2016 г.[7] |
| rVSV-векторный гликопротеин (VSV-EBOV) | Newlink Genetics и Merck | В использовании[43][44][28][1] |
| Вставка гликопротеина 2014 с вектором аденовируса 5 человека (Ad5-EBOV) | BIT & CanSino | Фаза I завершена[45] |
| Вектор гликопротеина аденовируса 26 / MVA-BN (Ad26.ZEBOV / | Джонсон и Джонсон | В использовании[33][46] |
| Вектор гликопротеина HPIV-3 | Минздрав (Россия) | Фаза I запланирована[47] |
| Вектор гликопротеина бешенства | Университет Томаса Джефферсона И НИАИД | Вызов приматов, не являющихся людьми, завершен[48] |
| Очищенный гликопротеин | Белковые науки | Запущен вызов NHP[49] |
| Эбола ∆VP30 H2O2 лечится | Университет Висконсина | Вызов приматов, не являющихся людьми, завершен[50] |
cAd3-EBO Z

В сентябре 2014 г. начались два клинических испытания фазы I вакцины. cAd3-EBO Z, который основан на ослабленной версии шимпанзе аденовирус (cAd3), который был генетически изменен, поэтому он не может воспроизводиться у людей.[51] Вектор cAd3 имеет вставку фрагмента ДНК, который кодирует гликопротеин вируса Эбола, который экспрессируется на поверхности вириона и имеет решающее значение для прикрепления к клеткам-хозяевам и катализа слияния мембран.[52] Он был разработан НИАИД в сотрудничестве с Okairos, теперь подразделением GlaxoSmithKline. Для испытания, обозначенного как VRC 20, 20 добровольцев были набраны NIAID в Бетесде, штат Мэриленд, в то время как для испытания EBL01 Оксфордского университета, Великобритания, были набраны три группы по 20 добровольцев в каждой дозе. Первые результаты были опубликованы в ноябре 2014 года; у всех 20 добровольцев выработались антитела против лихорадки Эбола, и никаких серьезных опасений по поводу безопасности не возникало.[53][54] В декабре 2014 года Оксфордский университет расширил исследование, включив в него бустерную вакцину на основе штамма MVA-BN. Измененная осповакцина Анкара, разработан Баварский нордический, чтобы выяснить, может ли он способствовать дальнейшему усилению иммунного ответа.[55][56] В испытании, в котором приняли участие 60 добровольцев, будет 30 добровольцев, вакцинированных бустерной вакциной. По состоянию на апрель 2015 г.[Обновить]Испытание фазы III с однократной дозой cAd3-EBO Z начинается в Сьерра-Леоне после успешного исследования фазы 2 в странах Западной Африки.[19][57]
Вакцина против Эболы GP

На 8-й конференции по вакцинам и независимым вирусам (ISV) в Филадельфии 27-28 октября 2014 г. Новавакс Inc. сообщила о разработке за «несколько недель» гликопротеин (GP) наночастица Вакцина против вируса Эбола (EBOV GP) с использованием их собственной рекомбинантный технологии. Рекомбинантный белок - это белок, код которого переносится рекомбинантная ДНК. Вакцина основана на недавно опубликованной генетической последовательности.[58] 2014 года Гвинея Эбола (Makona), ответственный за эпидемию болезни Эбола в 2014 году в Западной Африке. В исследованиях на животных был индуцирован полезный иммунный ответ, который, как было обнаружено, был усилен от десяти до ста раз с помощью компании «Матрикс-М». иммунологический адъювант. Было начато исследование реакции нечеловеческих приматов на вакцину. По состоянию на февраль 2015 г.[Обновить]Компания Novavax завершила два исследования на приматах на бабуинах и макаках и начала клинические испытания фазы I в Австралии. Инкапсулированные липидные наночастицы (LNP) миРНК быстро адаптированы для воздействия на штамм EBOV, вызванного вспышкой эпидемии Макона, и способны защитить 100% макаки резус против летального заражения, когда лечение было начато через три дня после воздействия, когда животные были виремическими и клинически больными.[59]Основные результаты Фазы I испытаний на людях показали, что вакцина GP от Эболы с адъювантом обладала высокой иммуногенностью при всех уровнях доз.[требуется медицинская цитата ]
Назальная вакцина
5 ноября 2014 г. Хьюстон Хроникл сообщил, что исследовательская группа в Техасский университет в Остине занималась разработкой назального спрея вакцины против Эболы, над которым команда работала семь лет.[60] В 2014 году группа сообщила, что в проведенных ею исследованиях на приматах, кроме человека, вакцина имела большую эффективность при введении через назальный спрей, чем путем инъекции.[61] По состоянию на ноябрь 2014 г.[Обновить], дальнейшее развитие команды представлялось маловероятным из-за отсутствия финансирования.[60][62]
Ad5-EBOV
В конце 2014 - начале 2015 года было проведено двойное слепое рандомизированное исследование фазы I в Провинция Цзянсу Китая; в ходе испытания была изучена вакцина, содержащая гликопротеины штамма 2014 г., а не штамма 1976 г. Испытание выявило признаки эффективности и не вызывало серьезных проблем с безопасностью.[45]
В 2017 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов Китая (CFDA) объявила об одобрении вакцины против Эболы, совместно разработанной Институтом биотехнологии Академия военно-медицинских наук и частный производитель вакцин CanSino Biologics.[63] Он содержит человека аденовирус вектор серотипа 5 (Ad5) с геном гликопротеина от ZEBOV.[64] Их результаты согласуются с предыдущими тестами на rVSV-ZEBOV в Африке и Европе.[65]
Таблетка Vaxart
Vaxart Inc. разрабатывает технологию вакцины в форме термостабильной таблетки, которая может предложить такие преимущества, как уменьшенное холодная цепь требования, а также быстрое и масштабируемое производство. В январе 2015 года компания Vaxart объявила, что получила финансирование для разработки вакцины против Эболы для испытаний на этапе I.[66]
Аттенуированная вакцина против вируса Эбола
Исследование, опубликованное в Наука в марте 2015 г. продемонстрировал, что вакцинация ослабленной формой вируса Эбола обеспечивает некоторую защиту нечеловеческим приматам. Это исследование было проведено в соответствии с протоколом, утвержденным Комитетом по уходу и использованию животных Национального института здоровья.[67] Новая вакцина основана на штамме вируса Эбола EBOVΔVP30, который не может воспроизводиться.[50]
ГамЭвац-Комби
Исследование, опубликованное в Человеческие вакцины и иммунотерапевтические препараты в марте 2017 года, анализируя данные клинических испытаний вакцины GamEvac-Combi в России, пришел к выводу, что вакцина безопасна и эффективна, и рекомендовано перейти к III фазе испытаний.[68]
Перспективы
В сентябре 2019 года исследование опубликовано в Отчеты по ячейкам продемонстрировали роль белка VP35 вируса Эбола в его иммунном уклонении. Была разработана рекомбинантная форма вируса Эбола с мутантным белком VP35 (VP35m), которая показала положительные результаты в активации передачи сигналов RIG-I-подобного рецептора. Приматов, кроме человека, заражали разными дозами VP35. Эта проблема привела к активации врожденной иммунной системы и выработке антител против EBOV. Затем приматов снова заражали вирусом Эбола дикого типа, и они выжили. Это потенциально создает перспективу для разработки вакцины в будущем.[69]
Клинические испытания в Западной Африке
В январе 2015 года Мари-Поль Кени, Всемирная организация здоровья Заместитель генерального директора по системам здравоохранения и инновациям (ВОЗ) объявил, что вакцины cAd3-EBO Z и VSV-EBOV продемонстрировали приемлемые профили безопасности во время ранних испытаний и вскоре перейдут к крупномасштабным испытаниям в Либерии, Сьерра-Леоне. и Гвинея. В испытаниях примут участие до 27000 человек и будут задействованы три группы: члены первых двух групп получат две вакцины-кандидаты, а третья группа получит вакцину. плацебо.[70] Обе вакцины с тех пор успешно прошли Фаза 2 исследования. Большой масштаб Фаза 3 исследования начались с апреля 2015 г.[Обновить]в Либерии и Сьерра-Леоне,[19][57] и в Гвинее в марте 2016 года.[22]
Кроме того, медицинский антрополог в Université de Montréal, работал в Гвинее и поднял дополнительные вопросы о безопасности в кольцевом испытании после того, как в апреле провел время в одном из отделений лечения Эболы, куда забирают участников испытания, если они заболеют, центр в Коя, около 50 км от столицы Конакри.[17]
В МИД России объявила в 2016 году о намерении провести полевые испытания двух российских вакцин с участием 2000 человек.[71] По сообщениям местных СМИ, правительство Гвинеи санкционировало начало судебных процессов 9 августа 2017 г. Русал -строенный Научно-диагностический центр эпидемиологии и микробиологии в г. Киндия. Планируется, что испытания продлятся до 2018 года.[71][72] По состоянию на октябрь 2019 года Россия лицензировала вакцину местными регулирующими органами и, как сообщается, была готова отправлять вакцину в Африку.[73]
Национальный запас США
В 2014, Credit Suisse по оценкам, правительство США предоставит более 1 доллара миллиардов долларов в контрактах с компаниями на разработку лекарств и вакцин от болезни, вызванной вирусом Эбола.[74] В 2004 году Конгресс принял закон о финансировании национального запаса вакцин и лекарств на случай возможных вспышек болезней.[74] Ожидалось, что ряд компаний разработают вакцины против Эболы: GlaxoSmithKline, NewLink Genetics, Джонсон и Джонсон и Баварский нордический.[74] Другая компания, Новые биорешения, участвовал в производстве новых доз ZMapp,[нужна цитата ] препарат для лечения болезни, вызванной вирусом Эбола, первоначально разработанный Mapp Biopharmaceutical.[75] Поставки ZMapp закончились в августе 2014 года.[76] В сентябре 2014 г. Управление передовых биомедицинских исследований и разработок (BARDA) заключила многомиллионный контракт с Mapp Biopharmaceutical для ускорения разработки ZMapp.[77] Дополнительные контракты подписаны в 2017 году.[78]
Смотрите также
использованная литература
- ^ а б c d е ж г час я j k л «Первая вакцина, одобренная FDA для профилактики болезни, вызванной вирусом Эбола, знаменует собой важную веху в обеспечении готовности и ответных мер общественного здравоохранения». НАС. Управление по контролю за продуктами и лекарствами (FDA). 19 декабря 2019. В архиве с оригинала на 20 декабря 2019 г.. Получено 19 декабря 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ McKee S (23 декабря 2019 г.). «США одобряют вакцину Merck против Эболы». PharmaTimes Online. Суррей, Англия: PharmaTimes Media Limited. Получено 24 декабря 2019.
- ^ Бет Моул (16 апреля 2019 г.). «В условиях вспышки лихорадки Эбола эффективность вакцины составляет 97,5%, что позволяет защитить более 90 тыс. Человек». Ars Technica.
- ^ Хоенен Т., Гросет А., Фельдманн Х (июль 2012 г.). «Современные вакцины против Эболы». Мнение эксперта по биологической терапии. 12 (7): 859–72. Дои:10.1517/14712598.2012.685152. ЧВК 3422127. PMID 22559078.
- ^ Петерсон А.Т., Бауэр Дж. Т., Миллс Дж. Н. (январь 2004 г.). «Экологическое и географическое распространение филовирусной болезни». Возникающие инфекционные заболевания. 10 (1): 40–47. Дои:10.3201 / eid1001.030125. ЧВК 3322747. PMID 15078595.
- ^ Фаустер-Бовендо Х, Мулангу С., Салливан, штат Нью-Джерси (июнь 2012 г.). «Эболавирусные вакцины для людей и обезьян». Текущее мнение в области вирусологии. 2 (3): 324–29. Дои:10.1016 / j.coviro.2012.04.003. ЧВК 3397659. PMID 22560007.
- ^ а б Павот V (декабрь 2016 г.). «Вакцины против вируса Эбола: где мы находимся?». Клиническая иммунология. 173: 44–49. Дои:10.1016 / j.clim.2016.10.016. PMID 27910805.
- ^ Марци А., Хэнли П. У., Пикша Е., Мартелларо С., Кобингер Г., Фельдманн Г. (октябрь 2016 г.). «Эффективность лечения после контакта с вирусом везикулярного стоматита и вирусом Эбола у макак-резус, инфицированных вирусом Эбола Макона» (PDF). Журнал инфекционных болезней. 214 (приложение 3): S360–66. Дои:10.1093 / infdis / jiw218. ЧВК 5050468. PMID 27496978.
- ^ Марзи А., Робертсон С.Дж., Хэддок Э., Фельдманн Ф., Хэнли П.В., Скотт Д.П. и др. (Август 2015 г.). «Вакцина против Эболы. VSV-EBOV быстро защищает макак от заражения штаммом вируса Эбола 2014/15 г.». Наука. 349 (6249): 739–42. Дои:10.1126 / science.aab3920. PMID 26249231.
- ^ «Эрвебо компании Merck [вакцина против Эболы Заир (rVSVΔG-ZEBOV-GP) вживую] получила условное одобрение в Европейском союзе» (Пресс-релиз). Merck. 11 ноября 2019. В архиве из оригинала 11 ноября 2019 г.. Получено 11 ноября 2019 - через Business Wire.
- ^ а б «ВОЗ преквалифицирует вакцину против Эболы, открывая путь к ее использованию в странах с высоким риском» (Пресс-релиз). Всемирная организация здоровья. 12 ноября 2019. В архиве с оригинала 15 ноября 2019 г.. Получено 13 ноября 2019.
- ^ а б c "Эрвебо ЕПАР". Европейское агентство по лекарствам (EMA). 12 декабря 2019 г.. Получено 1 июля 2020. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ "Эрвебо". НАС. Управление по контролю за продуктами и лекарствами (FDA). 19 декабря 2019 г.. Получено 1 июля 2020.
- ^ «Канадская разработка вакцины против Эболы перешла во владение Merck». CBC Новости. 24 ноября 2014 г.. Получено 25 ноября 2014.
- ^ Энао-Рестрепо А.М., Лонгини И.М., Эггер М., Дин Н.Э., Эдмундс В.Дж., Камачо А. и др. (Август 2015 г.). «Эффективность и действенность вакцины с rVSV-вектором, экспрессирующей поверхностный гликопротеин вируса Эбола: промежуточные результаты кластерного рандомизированного исследования кольцевой вакцинации в Гвинее». Ланцет. 386 (9996): 857–66. Дои:10.1016 / с0140-6736 (15) 61117-5. HDL:10144/575218. PMID 26248676. S2CID 40830730.
- ^ «Множественные испытания вакцины VSV от Эболы ускорены международным сотрудничеством» (Пресс-релиз). Wellcome Trust. Получено 29 октября 2014.
- ^ а б Шучман М (май 2015). «Испытания вакцины против Эболы в Западной Африке подвергаются критике». Ланцет. 385 (9981): 1933–34. Дои:10.1016 / с0140-6736 (15) 60938-2. PMID 25979835. S2CID 40400570.
- ^ Чан М. «Генеральный директор ВОЗ открывает совещание высокого уровня по вакцинам против Эболы». Всемирная организация здоровья (КТО). Получено 10 января 2015.
- ^ а б c «Тестовые вакцины против Эболы кажутся безопасными в Либерийском клиническом испытании фазы 2» (Пресс-релиз). Национальные институты здоровья (НАЦИОНАЛЬНЫЕ ИНСТИТУТЫ ЗДРАВООХРАНЕНИЯ США). 26 марта 2015.
- ^ Энао-Рестрепо А.М., Лонгини И.М., Эггер М., Дин Н.Э., Эдмундс В.Дж., Камачо А. и др. (Август 2015 г.). «Эффективность и действенность вакцины с rVSV-вектором, экспрессирующей поверхностный гликопротеин вируса Эбола: промежуточные результаты кластерного рандомизированного исследования кольцевой вакцинации в Гвинее». Ланцет. 386 (9996): 857–66. Дои:10.1016 / S0140-6736 (15) 61117-5. HDL:10144/575218. PMID 26248676. S2CID 40830730.
- ^ «Последние данные по Эболе (93): положительные результаты испытаний вакцины». ProMED почта. Международное общество инфекционных болезней. Получено 2 августа 2015.
- ^ а б «ВОЗ координирует вакцинацию контактных лиц для сдерживания вспышки лихорадки Эбола в Гвинее». Всемирная организация здоровья (КТО). Март 2016 г.. Получено 14 мая 2016.
- ^ «Мир на пороге эффективной вакцины против Эболы» (Пресс-релиз). Всемирная организация здоровья (КТО). 31 июля 2015 г.
- ^ а б Энао-Рестрепо А.М., Камачо А., Лонгини И.М., Уотсон С.Х., Эдмундс В.Дж., Эггер М. и др. (Февраль 2017). «Эффективность и эффективность вакцины с rVSV-вектором в предотвращении болезни, вызванной вирусом Эбола: окончательные результаты кольцевой вакцинации в Гвинее, открытое, кластерно-рандомизированное исследование (Эбола Ça Suffit!)». Ланцет. 389 (10068): 505–18. Дои:10.1016 / S0140-6736 (16) 32621-6. ЧВК 5364328. PMID 28017403.
- ^ а б Berlinger J (22 декабря 2016 г.). «Вакцина против Эболы дает 100% защиту, как показывают исследования». CNN. Получено 27 декабря 2016.
- ^ а б «Окончательные результаты испытаний подтверждают, что вакцина против Эболы обеспечивает высокую защиту от болезней» (Пресс-релиз). Всемирная организация здоровья. 23 декабря 2016. В архиве из оригинала 11 ноября 2019 г.. Получено 11 ноября 2019.
- ^ Metzger WG, Vivas-Martínez S (март 2018 г.). «Сомнительная эффективность вакцины rVSV-ZEBOV против Эболы». Ланцет. 391 (10125): 1021. Дои:10.1016 / S0140-6736 (18) 30560-9. PMID 29565013.
- ^ а б «Эрвебо компании Merck [вакцина против Эболы Заир (rVSVΔG-ZEBOV-GP) вживую] получила условное одобрение в Европейском союзе» (Пресс-релиз). Merck. 11 ноября 2019. В архиве из оригинала 11 ноября 2019 г.. Получено 11 ноября 2019 - через Business Wire.
- ^ а б «Забдено ЕПАР». Европейское агентство по лекарствам (EMA). 26 мая 2020. Получено 23 июля 2020.
- ^ а б "Мвабеа ЕПАР". Европейское агентство по лекарствам (EMA). 26 мая 2020. Получено 23 июля 2020.
- ^ «Johnson & Johnson объявляет об одобрении Европейской комиссией профилактической вакцины Janssen от Эболы» (Пресс-релиз). Джонсон и Джонсон. 1 июля 2020 г.. Получено 16 июля 2020 - через Reuters.
- ^ а б Bavarian Nordic (15 июля 2015 г.). «Bavarian Nordic объявляет, что Oxford Vaccines Group приступила к Фазе 2 исследования схемы первичной буст-вакцинации против Эболы, сочетающей MVA-BN Filo и технологию Janssen's Advac» (Пресс-релиз). Копенгаген, Дания: баварская северная Европа. Получено 16 июля 2015.
- ^ а б Номер клинического исследования NCT02313077 за "Исследование безопасности и иммуногенности гетерологичных схем вакцины Prime-Boost против Эболы у здоровых участников" на ClinicalTrials.gov
- ^ Уолш Ф. (6 января 2015 г.). «Эбола: начинается испытание новой вакцины». BBC News Online. Получено 6 января 2015.
- ^ «Johnson & Johnson объявляет о своем твердом намерении ускорить разработку вакцины против Эболы и значительно расширить производство» (Пресс-релиз). Джонсон и Джонсон. Получено 6 января 2015.
- ^ Хиршлер Б. (9 октября 2015 г.). «J&J начинает испытания вакцины в Сьерра-Леоне, даже когда лихорадка Эбола угасает». Рейтер. Получено 15 октября 2015.
- ^ а б «Johnson & Johnson объявляет о подаче заявок на получение европейского регистрационного удостоверения на схему исследуемой вакцины от Эболы компании Janssen». Янссен. 17 ноября 2019. В архиве из оригинала 17 ноября 2019 г.. Получено 16 ноября 2019.
- ^ Harper R (12 ноября 2019 г.). «Европейское разрешение на продажу вакцины против Эболы подано». Европейский фармацевтический обзор. В архиве из оригинала 17 ноября 2019 г.. Получено 16 ноября 2019.
- ^ а б c d «Новая вакцина для профилактики болезни, вызванной вирусом Эбола, рекомендована к утверждению в Европейском Союзе». Европейское агентство по лекарствам (EMA) (Пресс-релиз). 29 мая 2020. Получено 29 мая 2020. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ «Забдено: Ожидается решение ЕС». Европейское агентство по лекарствам (EMA). 29 мая 2020. Получено 29 мая 2020. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ «Мвабеа: ожидает решения ЕС». Европейское агентство по лекарствам (EMA). 29 мая 2020. Получено 29 мая 2020. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ ЦАРСКА-ТОРЛИ, Дагмара (29 мая 2020 г.). «Новая вакцина для профилактики болезни, вызванной вирусом Эбола, рекомендована к утверждению в Европейском Союзе». Европейское агентство по лекарствам (EMA). Получено 7 июля 2020.
- ^ «ВОЗ координирует вакцинацию контактных лиц для сдерживания вспышки лихорадки Эбола в Гвинее». Всемирная организация здоровья (КТО). Получено 20 июля 2016.
- ^ «Альянс по вакцинам подписывает авансовый контракт на 5 миллионов долларов на вакцину Merck от Эболы». Рейтер. 20 января 2016 г.. Получено 20 июля 2016.
- ^ а б Zhu FC, Hou LH, Li JX, Wu SP, Liu P, Zhang GR и др. (Июнь 2015 г.). «Безопасность и иммуногенность новой рекомбинантной вакцины против Эболы на основе вектора аденовируса 5-го типа для здоровых взрослых в Китае: предварительный отчет о рандомизированном двойном слепом плацебо-контролируемом исследовании фазы 1». Ланцет. 385 (9984): 2272–79. Дои:10.1016 / S0140-6736 (15) 60553-0. PMID 25817373. S2CID 34636122.
- ^ Миллиган И.Д., Гибани М.М., Сьюэлл Р., Клаттербак Е.А., Кэмпбелл Д., Плестед Е. и др. (Апрель 2016 г.). «Безопасность и иммуногенность новых вакцин против вируса Эбола, аденовируса типа 26 и модифицированной осповакцины Анкара: рандомизированное клиническое испытание». JAMA. 315 (15): 1610–23. Дои:10.1001 / jama.2016.4218. PMID 27092831.
- ^ «Вакцины, методы лечения и диагностика Эболы». Всемирная организация здоровья (КТО). 6 июля 2015 г.. Получено 10 сентября 2015.
- ^ Blaney JE, Marzi A, Willet M, Papaneri AB, Wirblich C, Feldmann F и др. (30 мая 2015 г.). «Качество антител и защита от смертельного заражения вирусом Эбола у нечеловеческих приматов, иммунизированных бивалентной вакциной на основе вируса бешенства». Патогены PLOS. 9 (5): e1003389. Дои:10.1371 / journal.ppat.1003389. ЧВК 3667758. PMID 23737747.
- ^ «Лаборатория КТ надеется остановить распространение Эболы». 3 марта 2015 г.. Получено 10 сентября 2015.
- ^ а б Марци А., Халфманн П., Хилл-Баторски Л., Фельдманн Ф., Шуперт В. Л., Нойман Г. и др. (Апрель 2015 г.). «Вакцины. Цельная вакцина против вируса Эбола имеет защитный эффект у нечеловеческих приматов». Наука. 348 (6233): 439–42. Дои:10.1126 / science.aaa4919. ЧВК 4565490. PMID 25814063.
- ^ Центр исследования вакцин, НИАИД (2 октября 2014 г.). «Обзор клинических разработок вакцины против Эболы (презентация)» (PDF). Всемирная организация здоровья (КТО). Получено 21 октября 2014.
- ^ Номер клинического исследования NCT02344407 для "Партнерства по исследованиям вакцин против Эболы в Либерии (PREVAIL)" на ClinicalTrials.gov
- ^ Ledgerwood JE, DeZure AD, Stanley DA, Coates EE, Novik L, Enama ME и др. (Март 2017 г.). «Вакцина против вируса Эбола, аденовируса шимпанзе». Медицинский журнал Новой Англии. 376 (10): 928–38. Дои:10.1056 / NEJMoa1410863. PMID 25426834.
- ^ Стэнли Д.А., Хонко А.Н., Асиеду С., Трефри Дж. К., Лау-Килби А. В., Джонсон Дж. С. и др. (Октябрь 2014 г.). «Вакцина против аденовируса шимпанзе создает острый и прочный защитный иммунитет против заражения эболавирусом». Природа Медицина. 20 (10): 1126–29. Дои:10,1038 / нм. 3702. PMID 25194571. S2CID 20712490.
- ^ Номер клинического исследования NCT02240875 для «Исследования по оценке новых вакцин против Эболы, cAd3-EBO Z и MVA-BN Filo» на ClinicalTrials.gov
- ^ Оксфордский университет (4 декабря 2014 г.). «Бустерная вакцина против Эболы проходит первые испытания в Оксфордском университете». Получено 7 декабря 2014.
- ^ а б «В Сьерра-Леоне начинается испытание вакцины против Эболы» (Пресс-релиз). Центры по контролю и профилактике заболеваний (CDC). 14 апреля 2015 г.
- ^ Gire SK, Goba A, Andersen KG, Sealfon RS, Park DJ, Kanneh L, et al. (Сентябрь 2014 г.). «Геномный надзор выявляет происхождение и передачу вируса Эбола во время вспышки 2014 года». Наука. 345 (6202): 1369–72. Bibcode:2014Научный ... 345.1369G. Дои:10.1126 / science.1259657. ЧВК 4431643. PMID 25214632.
- ^ Thi EP, Mire CE, Lee AC, Geisbert JB, Zhou JZ, Agans KN, et al. (Май 2015 г.). "Лечение липидными наночастицами миРНК нечеловеческих приматов, инфицированных вирусом Эбола и Макона". Природа. 521 (7552): 362–65. Bibcode:2015Натура.521..362Т. Дои:10.1038 / природа14442. ЧВК 4467030. PMID 25901685.
- ^ а б Акерман Т. (5 ноября 2014 г.). «Вакцина в виде назального спрея от лихорадки Эбола, эффективная для обезьян». Хьюстон Хроникл. Получено 13 ноября 2014.
- ^ Choi JH, Jonsson-Schmunk K, Qiu X, Shedlock DJ, Strong J, Xu JX и др. (Август 2015 г.). «Единая доза респираторной рекомбинантной вакцины на основе аденовируса обеспечивает долгосрочную защиту нечеловеческих приматов от смертельной инфекции Эбола». Молекулярная фармацевтика. 12 (8): 2712–31. Дои:10.1021 / mp500646d. ЧВК 4525323. PMID 25363619.
- ^ Стэнтон Д. (12 ноября 2014 г.). «Назальная вакцина против Эболы находится под угрозой, поскольку финансирование иссякает». in-PharmaТехнолог. Кроули, Сассекс, Великобритания: William Reed Business Media. Получено 13 ноября 2014.
- ^ Feng C (20 октября 2017 г.). «Китай одобрил вакцину против Эболы». Caixin Global. Архивировано из оригинал 7 октября 2018 г.. Получено 7 октября 2018.
- ^ Вонг Дж., Мендоса Э. Дж., Пламмер Ф. А., Гао Г. Ф., Кобингер Г. П., Цю Х (февраль 2018 г.). «Со скамейки почти до постели: долгий путь к лицензированной вакцине против вируса Эбола». Мнение эксперта по биологической терапии. 18 (2): 159–73. Дои:10.1080/14712598.2018.1404572. ЧВК 5841470. PMID 29148858.
- ^ Hackett DW (31 марта 2018 г.). «Гонка по разработке вакцины против Эболы между США и Китаем». Прецизионные прививки.
- ^ «Vaxart завершает финансирование для расширения портфеля разработок». Ваксарт. Архивировано из оригинал 19 января 2015 г.. Получено 19 января 2015.
- ^ Марци А., Фельдманн Ф., Гейсберт Т.В., Фельдманн Х., Сафронец Д. (февраль 2015 г.). «Вакцины на основе вируса везикулярного стоматита против вирусов Ласса и Эбола». Возникающие инфекционные заболевания. 21 (2): 305–07. Дои:10.3201 / eid2102.141649. ЧВК 4313664. PMID 25625358.
- ^ Должикова И.В., Зубкова О.В., Тухватулин А.И., Джаруллаева А.С., Тухватулина Н.М., Щебляков Д.В. и др. (Март 2017 г.). «Безопасность и иммуногенность GamEvac-Combi, гетерологичной вакцины против Эболы с вектором VSV и Ad5: открытое исследование фазы I / II на здоровых взрослых в России». Человеческие вакцины и иммунотерапевтические препараты. 13 (3): 613–20. Дои:10.1080/21645515.2016.1238535. ЧВК 5360131. PMID 28152326.
- ^ Вулси С., Меникуччи А.Р., Кросс РВ, Лутра П., Аганс К.Н., Борисевич В. и др. (Сентябрь 2019 г.). «Мутантный вирус Эбола VP35 не обладает вирулентностью, но может вызывать защитный иммунитет против вируса дикого типа». Отчеты по ячейкам. 28 (12): 3032–46.e6. Дои:10.1016 / j.celrep.2019.08.047. ЧВК 6886687. PMID 31533029.
- ^ «Великобритания возглавляет многообещающую фармацевтическую компанию по испытаниям вакцины против Эболы, изучающую возможность крупномасштабного производства в случае успеха испытаний». Ars Technica. Получено 10 января 2015.
- ^ а б «Россия профинансирует испытания вакцины против Эболы». Получено 14 сентября 2017.
- ^ «Гвинея: вакцина против вируса Эбола - вакцина против вируса Эбола - Южная Африка, 7: актуальная история Африки и мира». www.afrique-sur7.fr (На французском). Получено 14 сентября 2017.
- ^ «Россия готова поставлять вакцину против Эболы в Африку». ТАСС. Получено 1 ноября 2019.
- ^ а б c Руни Б. (28 октября 2014 г.). «Эбола: создание лекарства на 1 миллиард долларов». CNN. Получено 19 ноября 2014.
- ^ Ганц С. (20 октября 2014 г.). «Новые биорешения среди трех рассматриваемых для производства лекарств от Эболы». Балтиморский деловой журнал. Получено 13 ноября 2014.
- ^ Бернштейн Л., Деннис Б. (11 августа 2014 г.). «Запасы тестового препарата против Эболы« исчерпаны »после поставок в Африку, - заявляет американская компания». Вашингтон Пост. Получено 17 ноября 2019.
- ^ Маккарти М (сентябрь 2014 г.). «США подписывают контракт с производителем ZMapp для ускорения разработки препарата от Эболы». BMJ. 349 (сен 04.10): g5488. Дои:10.1136 / bmj.g5488. PMID 25189475.
- ^ «MappBio объявляет о заключении контрактов с BARDA на ZMapp и дополнительные меры противодействия филовирусам» (Пресс-релиз). Mapp Biopharmaceutical. 29 сентября 2017. В архиве из оригинала 17 ноября 2019 г.. Получено 16 ноября 2019.
дальнейшее чтение
- Фарук Ф, Бек К., Паолино К.М., Филлипс Р., Уотерс, Северная Каролина, Регулес Дж. А., Бергманн-Лейтнер Э.С. (июнь 2016 г.). «Циркулирующие фолликулярные Т-хелперы и профиль цитокинов у людей после вакцинации вакциной против вируса Эбола rVSV-ZEBOV». Научные отчеты. 6: 27944. Bibcode:2016НатСР ... 627944F. Дои:10.1038 / srep27944. ЧВК 4914957. PMID 27323685.
- Салливан Н., Ян З.Й., Набель Г.Дж. (сентябрь 2003 г.). «Патогенез вируса Эбола: значение для вакцин и методов лечения». Журнал вирусологии. 77 (18): 9733–7. Дои:10.1128 / JVI.77.18.9733-9737.2003. ЧВК 224575. PMID 12941881.
- Diakite I, Mooring EQ, Velásquez GE, Murray MB (август 2016 г.). «Новые схемы упорядоченных кластерных испытаний с использованием ступенчатой клиновой схемы для определения эффективности вакцины против Эболы с использованием пространственно-структурированной математической модели». PLOS забытые тропические болезни. 10 (8): e0004866. Дои:10.1371 / journal.pntd.0004866. ЧВК 4979980. PMID 27509037.
- Cazares LH, Ward MD, Brueggemann EE, Kenny T., Demond P, Mahone CR и др. (5 сентября 2016 г.). «Разработка метода масс-спектрометрии высокого разрешения с жидкостной хроматографией для количественного определения гликопротеина оболочки вируса в препаратах вакцины вирусоподобных частиц Эбола». Клиническая протеомика. 13 (1): 18. Дои:10.1186 / s12014-016-9119-8. ЧВК 5011338. PMID 27597813.
- Кондуру К., Шуртлефф А.С., Брадфут С.Б., Накамура С., Бавари С., Каплан Г. (13 сентября 2016 г.). «Слитый белок Ebolavirus Glycoprotein Fc защищает морских свинок от смертельной угрозы». PLOS ONE. 11 (9): e0162446. Bibcode:2016PLoSO..1162446K. Дои:10.1371 / journal.pone.0162446. ЧВК 5021345. PMID 27622456.
- Ченг Ф., Мюррей Дж. Л., Чжао Дж., Шэн Дж., Чжао З., Рубин Д.Х. (сентябрь 2016 г.). «Исследование на основе системной биологии мишеней клеточных противовирусных препаратов, идентифицированных с помощью инсерционного мутагенеза генных ловушек». PLOS вычислительная биология. 12 (9): e1005074. Bibcode:2016PLSCB..12E5074C. Дои:10.1371 / journal.pcbi.1005074. ЧВК 5025164. PMID 27632082.
- Оловукере С.А., Абиойе-Кутейи Е.А., Адеканле О. (ноябрь 2016 г.). «Готовность участвовать в испытаниях вакцины против вируса Эбола и пройти вакцинацию медицинскими работниками в больнице третьего уровня в Иле-Ифе, юго-запад Нигерии». Вакцина. 34 (47): 5758–5761. Дои:10.1016 / j.vaccine.2016.10.004. PMID 27751640.
- Павот V (декабрь 2016 г.). «Вакцины против вируса Эбола: где мы находимся?». Клиническая иммунология. 173: 44–49. Дои:10.1016 / j.clim.2016.10.016. PMID 27910805.
- Wellcome Trust – CIDRAP Группа B по вакцинации против Эболы (январь 2017 г.). Завершение разработки вакцин против Эболы: текущее состояние, нерешенные проблемы и рекомендации. Центр исследований и политики в области инфекционных заболеваний (CIDRAP) и Wellcome Trust. В архиве (PDF) из оригинала 18 января 2017 г.. Получено 18 января 2017.
- Росалес-Мендоса С., Ньето-Гомес Р., Ангуло С. (1 января 2017 г.). "Перспектива разработки вакцин растительного происхождения в борьбе с вирусом Эбола". Границы иммунологии. 8: 252. Дои:10.3389 / fimmu.2017.00252. ЧВК 5344899. PMID 28344580.
внешние ссылки
- Вакцины против Эболы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
| Scholia имеет тема профиль для Вакцина против Эболы. |
