Пятивалентная вакцина - Pentavalent vaccine
| Комбинация | |
|---|---|
| Вакцина АКДС | Вакцина |
| Вакцина против гепатита В | Вакцина |
| Вакцина против гемофильной инфекции | Вакцина |
| Клинические данные | |
| Торговые наименования | Quinvaxem, Pentavac PFS, другие |
| Маршруты администрация | Внутримышечный инъекция |
| Код УВД | |
| Идентификаторы | |
| ChemSpider |
|
А пентавалентная вакцина, также известный как Вакцина 5-в-1, это комбинированная вакцина с пятью отдельными вакцина соединены в один, предназначены для активной защиты людей от множества болезней.
Наиболее широко используемый пример - вакцина, защищающая от Haemophilus influenzae тип B (a бактерия что вызывает менингит, пневмония и отит ), захлебывающийся кашель, столбняк, гепатит Б и дифтерия.[1][2] Общее название этой вакцины - вакцина против дифтерии, столбняка, коклюша (цельноклеточная), гепатита B (рДНК) и конъюгированная вакцина против Haemophilus influenzae типа B (абсорбированная) или АКДС -HepB -Hib. Эта пентавалентная вакцина в значительной степени вытеснила другие педиатрические комбинированные вакцины, особенно в странах со средним и низким уровнем доходов. К 2013 г. на пятивалентные вакцины приходилось 100% АКДС -содержащие вакцины, закупленные ЮНИСЕФ, которая поставляет вакцины для большей части детей в мире.[3]
Безопасность
Во время исследований и испытаний сопряженный жидкость DTPw -HepB -Hib Было обнаружено, что вакцина имеет положительную безопасность при введении в качестве усилитель для маленьких детей, которым был проведен курс вакцинации другой пятивалентной бустерной вакциной, которая требует изменения конституции и также оказалась адекватной иммуногенный.[4]
История
В октябре 2004 г. Европейское агентство по лекарствам получил разрешение на маркетинг в Европа к пентавалентной вакцине Quintanrix, производимой GlaxoSmithKline.[5] Кинтанрикс был добровольно отозван производителем в 2008 году.[6]
В сентябре 2006 г. первый состав пентавалентной вакцины получил предварительное одобрение от Всемирная организация здоровья.[7]
В 2012, ЮНИСЕФ и Всемирная организация здравоохранения выпустила и рекомендовала совместное заявление для Отдела иммунизации Министерства здравоохранения и благополучия семьи, Правительство Индии и другие развивающиеся страны в отдельных документах об использовании пентавалентных вакцин для защиты от пяти основных причин смерти детей, предотвращаемых с помощью вакцин.[8]
К 2013 г. на пятивалентные вакцины приходилось 100% АКДС -содержащие вакцины, закупленные ЮНИСЕФ, который поставляет вакцины значительной части детей в мире.[3]
В 2014 году Южный Судан стал последним из 73 ГАВИ -поддерживаемые страны для внедрения вакцины «пять в одном».[9]
Общество и культура
В мае 2010 г. Crucell N.V. объявила о присуждении премии в размере 110 млн долларов США ЮНИСЕФ поставлять свою пятивалентную педиатрическую вакцину Quinvaxem в развивающиеся страны.[10]
В ноябре 2010 года государственно-частный консорциум ГАВИ объявила, что стоимость пентавалентной вакцины для стран с формирующимся рынком упала ниже 3 долларов США за дозу.[11]
Страны с высоким уровнем дохода, как правило, используют альтернативные препараты с использованием бесклеточного коклюша (Pa), который имеет более благоприятный профиль побочных эффектов, чем цельноклеточные компоненты коклюша.[12][13] В Европе, шестивалентные вакцины которые также содержат инактивированную вакцину против полиомиелита (ИПВ ) широко используются.[14] В США две пентавалентные вакцины, получившие разрешение на продажу, содержат IPV, а не вакцину против гепатита B (Вакцина DTaP-IPV / Hib ) или вакцина против Hib (Вакцина DTaP-IPV-HepB ).[15]
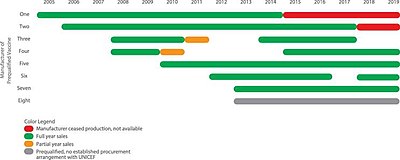
Количество производителей, производящих сертифицированную пятивалентную вакцину.[16]

Цены на все пентавалентные вакцины упали и ценовая дискриминация почти исчез. График ГАВИ; Цены, не относящиеся к ЮНИСЕФ, не показаны[16]
Индия
В 2013 году было обнаружено, что вакцины Pentavac PFS поставлялись в двух разных упаковках: один набор с датами изготовления и сроком годности был предоставлен частные больницы, в то время как другой комплект без даты изготовления и срока годности был распространен в государственные больницы.[17] Позже выяснилось, что недатированные вакцины были поставлены ЮНИСЕФ и выполнил Индийский Закон.
Шри-Ланка
Шри-Ланка представила Квинваксем в январе 2008 года. В течение 3 месяцев четыре сообщения о смерти и 24 сообщения о предполагаемых эпизодах гипотонического и гипореактивного действия вызвали внимание регулирующих органов и предупредительную приостановку первоначальной партии вакцины. Последующая смерть, которая произошла со следующей партией в апреле 2009 года, вынудила власти приостановить использование пентавалентной вакцины и возобновить DTwP и гепатит Б вакцинация. После расследования, проведенного независимыми национальными и международными экспертами, вакцина была повторно введена в употребление в 2010 году.[18]
Бутан
Бутан представила Easyfive-TT в сентябре 2009 года. Выявление 5 случаев энцефалопатии и / или менингоэнцефалита вскоре после пентавалентной вакцинации побудило власти приостановить вакцинацию 23 октября 2009 года. Впоследствии было выявлено еще 4 серьезных случая, связанных с вакциной, введенной до приостановки. исследованы. После всесторонней проверки, проведенной независимыми национальными и международными экспертами, вакцина была повторно введена в производство в 2011 году.[18]
Вьетнам
С декабря 2012 г. по март 2013 г. было зарегистрировано девять смертей в г. Вьетнам детей, которые недавно получили инъекции пятивалентной вакцины Квинваксем.[19] 4 мая 2013 года Министерство здравоохранения Вьетнама объявило о приостановке использования Квинваксема.[20]
После обзора случаев, проведенного национальными экспертами вместе с персоналом ВОЗ и ЮНИСЕФ и независимым клиницистом, связи с вакцинацией установить не удалось.[19] Случаи смерти, о которых сообщалось во Вьетнаме, были связаны со случайными проблемами со здоровьем, связанными со временем, но не связанными с применением Квинваксема, или случаями, по которым доступная информация не позволяла сделать однозначный вывод, но не было клинических признаков, соответствующих применению. вакцины. В отчете ВОЗ подчеркивается, что было введено более 400 миллионов доз квинваксема и что ни один летальный неблагоприятный эффект не был связан с приемом квинваксема или аналогичных вакцин.[20]
После дополнительных отчетов от Индия, Шри-Ланка и Бутан небольшого числа серьезных неблагоприятные события после иммунизации пентавалентными вакцинами ВОЗ обратилась к группе независимых экспертов по всему миру с просьбой провести обзор безопасности вакцины. Этот обзор проводился 12-13 июня 2013 г. и пришел к выводу, что пентавалентные вакцины не могут вызывать необычных реакций.[21] 20 июня 2013 года Министерство здравоохранения объявило, что Вьетнам возобновит использование Квинваксема. [18]
Сообщенные события в этих азиатских странах вызвали неуверенность общественности в отношении использования пятивалентных вакцин для распространения в других развивающихся странах.[22] В ответ на это и соответствующее распространение неточной информации о безопасности вакцины, Индийская академия педиатрии выпустила заявление в поддержку пятивалентных вакцин.[23]
Составы
Распространенные версии пентавалентных вакцин включают Quinvaxem, Pentavac PFS, Easyfive TT, ComBE Five, Shan5 и Pentabio.[24][25]
| Вакцина | Производитель | Дата предварительной квалификации ВОЗ[7] |
|---|---|---|
| Квинваксем | Crucell [а] | 26 сентября 2006 г. |
| Пентавак ПФС | Институт сыворотки Индии | 23 июня 2010 г. |
| Easyfive TT | Панацея Биотек | 2 октября 2013 г.[b] |
| ComBE Five | Биологический Э. Лимитед | 1 сентября 2011 г. |
| Shan5 | Шанта Биотехникс | 29 апреля 2014 г. |
| Пентабио | Био Фарма | 19 декабря 2014 г. |
Примечания
- ^ Вакцина была разработана и произведена компанией Crucell в г. Корея и совместно произведен Корпорация Chiron (позже куплен Novartis International AG 20 апреля 2006 г.), который обеспечивает четыре из пяти элементов вакцины в целом.[26][27]
- ^ Easyfive был удален из ВОЗ Список предварительно одобренных и преквалифицированных вакцин на середину 2011 года.[28] Он был повторно одобрен ВОЗ 2 октября 2013 г.[7]
Рекомендации
- ^ «Иммунизация и пятивалентная вакцина». ЮНИСЕФ.
- ^ Организация "Всемирное здравоохранение"; Биологические препараты, Департамент иммунизации, вакцин Всемирной организации здравоохранения и (2004 г.). Иммунизация на практике: практическое руководство для медицинского персонала. Всемирная организация здоровья. п. 20. ISBN 9789241546515. Получено 15 июля 2018.
- ^ а б «Обновленные данные о поставках вакцин против столбняка и коклюша» (PDF). ЮНИСЕФ. Октябрь 2016. Получено 28 июн 2018.
- ^ Суарес Э., Астуриас Э. Дж., Гильберт А. К., Херцог К., Эберхард Ю., Спайр С. (февраль 2010 г.). «Полностью жидкая комбинированная вакцина DTPw-HepB-Hib для ревакцинации детей ясельного возраста в Сальвадоре». Revista Panamericana de Salud Pública. 27 (2): 117–24. Дои:10.1590 / S1020-49892010000200005. PMID 20339615.
- ^ "Quintanrix: EPAR - Обзор для общественности" (PDF). Европейское агентство по лекарствам. Получено 15 июля 2018.
- ^ «Публичное заявление по Quintanrix: Отзыв разрешения на продажу в Европейском Союзе». Европейское агентство по лекарствам. 29 августа 2008 г.. Получено 15 июля 2018.
- ^ а б c «Преквалифицированные вакцины ВОЗ». Всемирная организация здоровья. Получено 29 июн 2018.
- ^ «Пятивалентная вакцина» (PDF). Всемирная организация здоровья.
- ^ «При поддержке ГАВИ пентавалентная вакцина доступна в 73 беднейших странах». ГАВИ Альянс.
- ^ "Crucell объявляет о новой награде в размере 110 миллионов долларов ..." PRNewswire (Пресс-релиз).
- ^ «Ожидается, что в 2011 году цена на спасительную вакцину значительно упадет». ГАВИ. 26 ноября 2010 г.. Получено 3 июля 2018.
- ^ «Рынок вакцин». Всемирная организация здоровья. Получено 28 июн 2018.
- ^ «Вакцина 5-в-1 (также называемая пятивалентной вакциной)». Проект знаний о вакцинах. 22 марта 2018 г.. Получено 3 июля 2018.
- ^ Обандо-Пачеко П., Риверо-Калле I, Гомес-Риал Дж., Родригес-Тенрейро Санчес К., Мартинон-Торрес Ф. (август 2018 г.). «Новые перспективы шестивалентных вакцин». Вакцина. 36 (36): 5485–5494. Дои:10.1016 / j.vaccine.2017.06.063. PMID 28676382.
- ^ «Вакцины, лицензированные для использования в США». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 28 июн 2018.
- ^ а б Malhame, M; Бейкер, Э; Ганди, G; Джонс, А; Kalpaxis, P; Икбал, Р; Момени, Y; Нгуен, А (9 августа 2019 г.). «Формирование рынков на благо глобального здравоохранения - 15-летняя история и уроки, извлеченные из рынка пятивалентных вакцин». Вакцина: X. 2: 100033. Дои:10.1016 / j.jvacx.2019.100033. ЧВК 6668221. PMID 31384748.
- ^ Раджив, Г. (13 декабря 2013 г.). «Производитель пентавалентной вакцины заявляет об исключении Unicef в отношении дат производства». Времена Индии. Получено 3 июля 2018.
- ^ а б c «Обновленная информация о качестве и безопасности пентавалентной вакцины Quinvaxem (DTwP-HepB-Hib)». Всемирная организация здоровья. 5 июля 2013 г.. Получено 3 июля 2018.
- ^ а б «Часто задаваемые вопросы (FAQ) по вакцине Quinvaxem» (PDF). Всемирная организация здоровья. Получено 30 июн 2018.
- ^ а б «Безопасность пентавалентной вакцины Quinvaxem (DTwP-HepB-Hib)». Всемирная организация здоровья. 10 мая 2013. Получено 30 июн 2018.
- ^ "Глобальный консультативный комитет по безопасности вакцин, отчет о заседании, проведенном 12-13 июня 2013 г.". Всемирная организация здоровья. 19 июля 2013 г.. Получено 3 июля 2018.
- ^ Datta PT (22 сентября 2013 г.). «Смертность младенцев бросает тень на расширение использования пентавалентной вакцины». Индусское направление бизнеса. Получено 3 июля 2018.
- ^ Служба экспресс-новостей (13 сентября 2013 г.). «Пентавалентная вакцина безопасна, - уверяет IAP». Индийский экспресс. Получено 3 июля 2018.
- ^ "Товары". Мир вакцин.
- ^ "'ВОЗ одобряет вакцину Shan5 ". Бизнес Стандарт. 2014-05-05.
- ^ "Quinvaxem компании Crucell проходит предварительную квалификацию ВОЗ". Фармацевтическое письмо.
- ^ «Crucell объявляет об одобрении продукта в Корее для вакцины Quinvaxem». Marketwired.
- ^ «Пятивалентная вакцина Easyfive удалена из списка преквалифицированных вакцин ВОЗ». ВОЗ.
дальнейшее чтение
- Доду А.Н., Реннер Л., ван Гроузест А.С., Лабади Дж., Антви-Агьеи К.О., Хайбор С. и др. (2007). «Мониторинг безопасности новой пентавалентной вакцины в расширенной программе иммунизации в Гане». Безопасность лекарств. 30 (4): 347–56. Дои:10.2165/00002018-200730040-00007. PMID 17408311. S2CID 37633844.
- Верма Р., Кханна П., Чавла С. (июль 2013 г.). «Пятивалентная вакцина АКДС: необходимо включить в программу вакцинации Индии». Человеческие вакцины и иммунотерапевтические препараты. 9 (7): 1497–9. Дои:10.4161 / hv.24382. PMID 23571225.
внешняя ссылка
- Куинн Б. (6 июня 2011 г.). «Фармацевтические компании снизят цены на вакцины в развивающихся странах». Хранитель.
- Дхар А (11 октября 2013 г.). «Пентавалентная вакцина получает чистую карту, готовится к масштабированию на национальном уровне». Индуистский.
- Синха V (10 июня 2011 г.). «Организация здравоохранения и Фонд Гейтса содействуют более широкому использованию вакцин». Голос Америки. Архивировано из оригинал 5 марта 2016 г.
- Левин О. «10 лет прогресса вакцины за 10 дней». Huffington Post.


