Новообразование - Neoplasm
| Новообразование | |
|---|---|
| Другие имена | Опухоль, опухоль, карциноциты |
 | |
| Колэктомия образец, содержащий злокачественное новообразование, а именно инвазивный пример колоректальный рак (кратерообразная, красноватая опухоль неправильной формы) | |
| Специальность | Онкология |
| Симптомы | Кусок |
| Осложнения | Рак |
| Причины | Радиация |
А новообразование (/ˈпяoʊплæzəm,ˈпяə-/[1]) - это тип аномального и чрезмерного роста, называемый неоплазия, из ткань. Рост новообразования не скоординирован с ростом нормальной окружающей ткани и продолжает расти ненормально, даже если исходный триггер удален.[2][3][4] Этот ненормальный рост обычно образует массу, которую можно назвать опухоль.[5]
МКБ-10 классифицирует новообразования на четыре основные группы: доброкачественные новообразования, новообразования in situ, злокачественные новообразования, и новообразования неопределенного или неизвестного поведения.[6] Злокачественные новообразования также известны как раки и находятся в центре внимания онкология.
До аномального роста ткани, такого как неоплазия, клетки часто имеют ненормальный рост, например метаплазия или же дисплазия.[7] Однако метаплазия или дисплазия не всегда прогрессируют до неоплазии, а могут возникать и при других состояниях.[2] Слово из Древнегреческий νέος- нео («новый») и πλάσμα плазма («образование», «создание»).
Типы
| -плазия и -трофия |
|---|
|
|
Новообразование может быть доброкачественный, потенциально злокачественные или злокачественные (рак ).[8]
- Доброкачественные опухоли включают миома матки, остеофиты и меланоцитарные невусы (родинки на коже). Они ограничены и локализованы и не трансформируются в рак.[7]
- К потенциально злокачественным новообразованиям относятся: карцинома in situ. Они локализованы, не вторгаются и не разрушаются, но со временем могут трансформироваться в рак.
- Злокачественные новообразования обычно называют раком. Они проникают в окружающие ткани и разрушают их, могут образовывать метастазы и, если его не лечить или не реагировать на лечение, обычно заканчивается летальным исходом.
- Вторичное новообразование относится к любому классу раковых опухолей, которые являются либо метастатическим ответвлением первичной опухоли, либо явно несвязанной опухолью, частота которой увеличивается после определенных видов лечения рака, таких как химиотерапия или же лучевая терапия.
- В редких случаях может быть метастатическое новообразование без известного места первичного рака, и это классифицируется как рак неизвестного первичного происхождения
Клональность
Неопластические опухоли часто бывают неоднородный и содержат более одного типа клеток, но их начало и продолжение роста обычно зависит от одной популяции неопластических клеток. Предполагается, что эти клетки клональный - то есть они происходят из одной клетки,[9] и все несут то же самое генетический или же эпигенетический аномалия - очевидная клональность. При лимфоидных новообразованиях, например лимфома и лейкемия, клональность подтверждается усилением однократной перегруппировки их иммуноглобулин ген (для В клетка поражения) или Рецептор Т-клеток ген (для Т-клетка поражения). В настоящее время считается, что демонстрация клональности необходима для идентификации пролиферации лимфоидных клеток как неопластической.[10]
Заманчиво определять новообразования как клональные клеточные пролиферации, но демонстрация клональности не всегда возможна. Следовательно, клональность не требуется при определении неоплазии.
Новообразование против опухоли
Слово опухоль или же опухоль происходит от латинского слова припухлость, что является одним из основных признаков воспаления. Первоначально это слово относилось к любой форме припухлость, неопластический или нет. В современном английском, опухоль используется как синоним новообразования (твердой или жидкой кисты поражение который может быть образован или не образован аномальным ростом неопластических клеток), который кажется увеличенным в размерах.[11][12] Некоторые новообразования не образуют опухоли - к ним относятся: лейкемия и большинство форм карцинома in situ. Опухоль также не является синонимом рак. Хотя рак по определению является злокачественным, опухоль может быть доброкачественный, предраковый, или же злокачественный.
Условия масса и узелок часто используются как синонимы опухоль. Однако в целом термин опухоль используется в целом, без привязки к физическому размеру поражения.[2] В частности, термин масса часто используется, когда поражение имеет максимальный диаметр не менее 20 миллиметров (мм) в наибольшем направлении, в то время как термин узелок обычно используется, когда размер поражения меньше 20 мм в наибольшем измерении (25,4 мм = 1 дюйм).[2]
Причины
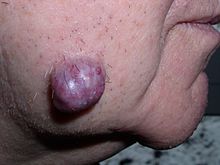
Опухоли у людей возникают в результате накопленных генетических и эпигенетических изменений внутри отдельных клеток, которые вызывают неконтролируемое деление и разрастание клетки.[13] Новообразование может быть вызвано аномальным разрастанием тканей, которое может быть вызвано генетическим мутации. Однако не все типы новообразований вызывают чрезмерное опухолевое разрастание тканей (например, лейкемия или же карцинома in situ ) и сходства между неоплазматическим ростом и регенеративными процессами, например дедифференцировкой и быстрой пролиферацией клеток.[14]
Рост опухоли изучался с помощью математики и механика сплошной среды. Сосудистые опухоли, такие как гемангиомы и лимфангиомы (образованные из кровеносных или лимфатических сосудов), таким образом, рассматриваются как амальгамы твердого скелета, образованного липкими клетками и органической жидкостью, заполняющей пространства, в которых клетки могут расти.[15] В рамках этого типа модели можно иметь дело с механическими напряжениями и деформациями и выяснять их влияние на рост опухоли и окружающей ткани и сосудистой сети. Недавние результаты экспериментов, в которых используется эта модель, показывают, что активный рост опухоли ограничен внешними краями опухоли и что усиление жесткости лежащей в основе нормальной ткани также ингибирует рост опухоли.[16]
Доброкачественные состояния, которые нет связаны с аномальным разрастанием ткани (например, сальные кисты ), однако, могут также проявляться в виде опухолей, но не иметь злокачественного потенциала. Кисты груди (что обычно происходит во время беременности и в другое время) - еще один пример, как и другие инкапсулированные железистые опухоли (щитовидная железа, надпочечники, поджелудочная железа).
Инкапсулированные гематомы, инкапсулированная некротическая ткань (от укуса насекомого, инородного тела или другого вредного механизма), келоиды (дискретные разрастания рубцовой ткани) и гранулемы также может проявляться в виде опухолей.
Дискретные локальные увеличения нормальных структур (мочеточников, кровеносных сосудов, внутрипеченочных или внепеченочных желчных протоков, легочных включений или дупликация желудочно-кишечного тракта ) из-за препятствий оттока или сужений, или аномальных соединений, также может проявляться как опухоль. Примерами являются артериовенозные свищи или аневризмы (с тромбозом или без него), желчные свищи или аневризмы, склерозирующий холангит, цистицеркоз или эхинококкоз, дупликация кишечника и легочные включения, наблюдаемые при кистозном фиброзе. Это может быть опасно биопсия ряд типов опухолей, при которых утечка их содержимого может быть катастрофической. Когда встречаются такие типы опухолей, используются диагностические методы, такие как ультразвук, компьютерная томография, МРТ, ангиограммы и сканирование в ядерной медицине, до (или во время) биопсии или хирургического исследования / удаления, чтобы избежать таких серьезных осложнений.
Злокачественные новообразования
Повреждение ДНК

Повреждение ДНК считается основной причиной злокачественных новообразований, известных как рак.[17] Его центральная роль в прогрессировании рака проиллюстрирована на рисунке в этом разделе в рамке вверху. (Основные особенности повреждения ДНК, эпигенетический изменения и недостаточная репарация ДНК при прогрессировании рака показаны красным.) Повреждение ДНК очень распространено. Естественные повреждения ДНК (в основном из-за клеточного метаболизма и свойств ДНК в воде при температуре тела) происходят со скоростью более 60000 новых повреждений, в среднем, на одну человеческую клетку в день.[нужна цитата ] [также см. статью Повреждение ДНК (естественное) ]. Дополнительные повреждения ДНК могут возникнуть в результате воздействия экзогенный агенты. Табачный дым вызывает повышенное экзогенный Повреждение ДНК, и эти повреждения ДНК являются вероятной причиной рака легких из-за курения.[18] Ультрафиолетовый свет от солнечного излучения вызывает повреждение ДНК, что важно при меланоме.[19] Helicobacter pylori инфекция вызывает высокий уровень активные формы кислорода которые повреждают ДНК и способствуют развитию рака желудка.[20] Желчные кислоты, высокие уровни в толстой кишке людей, придерживающихся диеты с высоким содержанием жиров, также вызывают повреждение ДНК и способствуют развитию рака толстой кишки.[21] Кацурано и др. показали, что макрофаги и нейтрофилы в воспаленном эпителии толстой кишки являются источником активных форм кислорода, вызывающих повреждения ДНК, которые инициируют онкогенез толстой кишки.[22][ненадежный источник? ] Некоторые источники повреждения ДНК указаны в прямоугольниках вверху рисунка в этом разделе.
Лица с мутацией зародышевой линии, вызывающей дефицит любого из 34 Ремонт ДНК гены (см. статью Расстройство дефицита репарации ДНК ) подвержены повышенному риску рак. Некоторые мутации зародышевой линии в генах репарации ДНК вызывают до 100% пожизненной вероятности рака (например, p53 мутации).[23] Эти мутации зародышевой линии указаны в рамке слева от рисунка со стрелкой, указывающей их вклад в дефицит репарации ДНК.
Около 70% злокачественных новообразований не имеют наследственной составляющей и называются «спорадическими раками».[24] Лишь небольшая часть спорадических видов рака имеет дефицит репарации ДНК из-за мутации в гене репарации ДНК. Однако в большинстве случаев спорадического рака наблюдается дефицит репарации ДНК из-за эпигенетический изменения, которые снижают или заглушают экспрессию гена репарации ДНК. Например, из 113 последовательных случаев колоректального рака только четыре имели миссенс-мутация в гене репарации ДНК MGMT, в то время как у большинства была снижена экспрессия MGMT из-за метилирования промоторной области MGMT (эпигенетическое изменение).[25] В пяти отчетах представлены доказательства того, что от 40% до 90% случаев колоректального рака снижают экспрессию MGMT из-за метилирования промоторной области MGMT.[26][27][28][29][30]
Аналогичным образом, из 119 случаев колоректального рака с недостаточной репарацией несоответствия, в которых отсутствовала экспрессия гена репарации ДНК PMS2, PMS2 был дефицитным в 6 из-за мутаций в гене PMS2, тогда как в 103 случаях экспрессия PMS2 была недостаточной из-за того, что его партнер по спариванию MLH1 был подавлен из-за к метилированию промотора (белок PMS2 нестабилен в отсутствие MLH1).[31] В других 10 случаях потеря экспрессии PMS2, вероятно, была связана с эпигенетической сверхэкспрессией микроРНК, miR-155, которая подавляет MLH1.[32]
В других примерах эпигенетические дефекты были обнаружены на частотах от 13% до 100% для генов репарации ДНК. BRCA1, WRN, FANCB, FANCF, МГМТ, MLH1, MSH2, MSH4, ERCC1, XPF, NEIL1 и Банкомат. Эти эпигенетические дефекты наблюдались при различных формах рака (например, груди, яичников, колоректального рака, головы и шеи). Два или три дефицита экспрессии ERCC1, XPF или PMS2 возникают одновременно в большинстве из 49 случаев рака толстой кишки, оцененных Facista et al.[33] Эпигенетические изменения, вызывающие снижение экспрессии генов репарации ДНК, показаны в центральной рамке на третьем уровне от верхнего края рисунка в этом разделе, а последующий дефицит репарации ДНК показан на четвертом уровне.
Когда экспрессия генов репарации ДНК снижается, повреждения ДНК накапливаются в клетках на более высоком, чем обычно, уровне, и эти избыточные повреждения вызывают увеличение частоты мутаций или эпимутаций. Скорость мутации сильно увеличивается в клетках, дефектных по Ремонт несоответствия ДНК[34][35] или в гомологичный рекомбинационный ремонт (HRR).[36]
Во время репарации двухцепочечных разрывов ДНК или репарации других повреждений ДНК не полностью очищенные участки репарации могут вызывать эпигенетический подавление гена.[37][38] Недостатки репарации ДНК (уровень 4 на рисунке) вызывают повышенные повреждения ДНК (уровень 5 на рисунке), что приводит к увеличению соматических мутаций и эпигенетических изменений (уровень 6 на рисунке).
Дефекты поля, нормальная ткань с множественными изменениями (обсуждаемые в разделе ниже), являются обычными предшественниками развития неупорядоченного и неправильно пролиферирующего клона ткани в злокачественном новообразовании. Такие дефекты поля (второй уровень снизу рисунка) могут иметь множественные мутации и эпигенетические изменения.
Как только рак образуется, он обычно нестабильность генома. Эта нестабильность, вероятно, связана с уменьшением репарации ДНК или чрезмерным повреждением ДНК. Из-за такой нестабильности рак продолжает развиваться и производить субклоны. Например, рак почек, отобранный в 9 областях, имел 40 повсеместных мутаций, демонстрирующих неоднородность опухоли (т.е. присутствуют во всех областях рака), 59 мутаций разделяют некоторые (но не все области), и 29 «частных» мутаций присутствуют только в одной из областей рака.[39]
Полевые дефекты

Для описания этого явление, включая "эффект поля", "канцеризацию поля" и "поле канцерогенез Термин «полевая канцеризация» был впервые использован в 1953 году для описания области или «поля» эпителия, которое было обусловлено (в то время) в значительной степени неизвестными процессами, чтобы предрасполагать его к развитию рака.[40] С тех пор термины «канцеризация поля» и «дефект поля» используются для описания предраковых тканей, в которых вероятно возникновение новых видов рака.
Дефекты поля важны для прогрессирования рака.[41][42] Однако в большинстве исследований рака, как указывает Рубин,[43] «Подавляющее большинство исследований рака проводилось на четко определенных опухолях in vivo или на отдельных неопластических очагах in vitro. Тем не менее, есть свидетельства того, что более 80% соматических мутаций, обнаруживаемых в опухолях толстой кишки человека с мутаторным фенотипом, происходят до начала терминальной клональной экспансии.[44] Аналогичным образом Vogelstein et al.[45] указывают на то, что более половины соматических мутаций, выявленных в опухолях, произошли в предопухолевой фазе (в области дефекта поля), во время роста явно нормальных клеток. Точно так же эпигенетические изменения, присутствующие в опухолях, могли происходить в предопухолевых полевых дефектах.
Расширенный взгляд на полевой эффект получил название «этиологического полевого эффекта», который охватывает не только молекулярные и патологические изменения в предопухолевых клетках, но также влияние экзогенных факторов окружающей среды и молекулярные изменения в локальных клетках. микросреда о неопластической эволюции от возникновения опухоли до смерти пациента.[46]
В толстой кишке дефект поля, вероятно, возникает в результате естественного отбора мутантной или эпигенетически измененной клетки среди стволовых клеток в основании одной из кишечные крипты на внутренней поверхности толстой кишки. Мутантная или эпигенетически измененная стволовая клетка может заменять другие близлежащие стволовые клетки путем естественного отбора. Таким образом, может возникнуть участок аномальной ткани. Рисунок в этом разделе включает фотографию недавно резецированного и продольно открытого сегмента толстой кишки, показывающую рак толстой кишки и четыре полипа. Под фотографией представлена схематическая диаграмма того, как мог образоваться большой участок мутантных или эпигенетически измененных клеток, показанный на диаграмме большой областью желтого цвета. Внутри этого первого большого участка на диаграмме (большого клона клеток) может произойти вторая такая мутация или эпигенетическое изменение, так что данная стволовая клетка приобретает преимущество по сравнению с другими стволовыми клетками внутри участка, и эта измененная стволовая клетка может увеличиваться. клонально образуя вторичный патч или субклон внутри исходного патча. На схеме это обозначено четырьмя меньшими участками разного цвета в большой желтой исходной области. Внутри этих новых участков (субклонов) процесс может повторяться несколько раз, на что указывают еще более мелкие участки внутри четырех вторичных участков (с все еще разными цветами на диаграмме), которые клонально расширяются, пока не появятся стволовые клетки, которые генерируют либо небольшие участки. полипы или злокачественное новообразование (рак).
На фотографии видимый дефект поля в этом сегменте толстой кишки привел к образованию четырех полипов (с указанием размера полипов 6 мм, 5 мм и двух по 3 мм, а также рака размером около 3 см в самом длинном измерении). Эти новообразования также обозначены на схеме под фото 4 маленькими желто-коричневыми кружками (полипы) и более крупной красной областью (рак). Рак на фотографии возник в слепой кишке толстой кишки, где толстая кишка соединяется с тонкой кишкой (помечено) и где находится аппендикс (помечено). Жир на фото расположен вне внешней стенки толстой кишки. В сегменте толстой кишки, показанном здесь, толстая кишка была разрезана в продольном направлении, чтобы обнажить внутреннюю поверхность толстой кишки и показать рак и полипы, возникающие внутри внутренней эпителиальной выстилки толстой кишки.
Если общий процесс, в результате которого возникают спорадические виды рака толстой кишки, представляет собой формирование пре-неопластического клона, который распространяется естественным отбором с последующим образованием внутренних субклонов внутри исходного клона и суб-субклонов внутри них, тогда рак толстой кишки обычно должны быть связаны с полями нарастающей патологии, отражающими последовательность предраковых событий, и им предшествовать их. Наиболее обширная область аномалии (крайняя желтая неправильная область на диаграмме) будет отражать самое раннее событие в формировании злокачественного новообразования.
При экспериментальной оценке специфических дефектов репарации ДНК при раке было показано, что многие специфические дефекты репарации ДНК также возникают в полевых дефектах, окружающих эти раковые образования. В таблице ниже приведены примеры, для которых было показано, что дефицит репарации ДНК при раке вызван эпигенетическим изменением, и несколько более низкие частоты, с которыми такой же эпигенетически вызванный дефицит репарации ДНК был обнаружен в дефекте окружающего поля.
| Рак | Ген | Частота при раке | Частота дефекта поля | Ref. |
|---|---|---|---|---|
| Колоректальный | MGMT | 46% | 34% | [26] |
| Колоректальный | MGMT | 47% | 11% | [28] |
| Колоректальный | MGMT | 70% | 60% | [47] |
| Колоректальный | MSH2 | 13% | 5% | [28] |
| Колоректальный | ERCC1 | 100% | 40% | [33] |
| Колоректальный | PMS2 | 88% | 50% | [33] |
| Колоректальный | XPF | 55% | 40% | [33] |
| Голова и шея | MGMT | 54% | 38% | [48] |
| Голова и шея | MLH1 | 33% | 25% | [49] |
| Голова и шея | MLH1 | 31% | 20% | [50] |
| Желудок | MGMT | 88% | 78% | [51] |
| Желудок | MLH1 | 73% | 20% | [52] |
| Пищевод | MLH1 | 77%-100% | 23%-79% | [53] |
Некоторые из небольших полипов в области дефекта, показанных на фото вскрытого сегмента толстой кишки, могут быть относительно доброкачественными новообразованиями. Из полипов размером менее 10 мм, обнаруженных во время колоноскопии с последующими повторными колоноскопиями в течение 3 лет, 25% не изменились в размере, 35% регрессировали или уменьшились в размере, а 40% увеличились в размере.[54]
Нестабильность генома
Раки, как известно, проявляют нестабильность генома или мутаторный фенотип.[55] ДНК, кодирующая белок в ядре, составляет около 1,5% от общей геномной ДНК.[56] Внутри этой кодирующей белок ДНК (называемой экзом ), средний рак груди или толстой кишки может иметь от 60 до 70 мутаций, изменяющих белок, из которых около 3 или 4 могут быть «драйверными» мутациями, а остальные могут быть «пассажирскими» мутациями.[45] Однако среднее количество мутаций в последовательности ДНК во всем геноме (включая районы, не кодирующие белок ) в образце ткани рака молочной железы составляет около 20 000.[57] В среднем образце ткани меланомы (где меланомы имеют более высокий экзом частота мутаций[45]) общее количество мутаций в последовательности ДНК составляет около 80 000.[58] Это сопоставимо с очень низкой частотой мутаций примерно 70 новых мутаций во всем геноме между поколениями (от родителей к детям) у людей.[59][60]
Высокая частота мутаций в общих нуклеотидных последовательностях при раке предполагает, что часто раннее изменение в полевых дефектах, вызывающих рак (например, желтая область на диаграмме в этом разделе), является недостаточностью восстановления ДНК. Большие дефекты поля, окружающие рак толстой кишки (простирающиеся примерно до 10 см с каждой стороны от рака), были показаны Facista et al.[33] часто иметь эпигенетические дефекты в 2 или 3 белках репарации ДНК (ERCC1, XPF или PMS2 ) на всей площади дефекта поля. Недостаток репарации ДНК приводит к увеличению скорости мутаций.[34][35][36] Дефицит репарации ДНК сам по себе может привести к накоплению повреждений ДНК и стать причиной ошибок. транслезионный синтез некоторые из этих повреждений могут вызвать мутации. Кроме того, неправильная репарация этих накопленных повреждений ДНК может вызвать эпимутацию. Эти новые мутации или эпимутации могут обеспечить пролиферативное преимущество, создавая дефект поля. Хотя мутации / эпимутации в генах репарации ДНК сами по себе не дают селективного преимущества, они могут переноситься в качестве пассажиров в клетках, когда клетки приобретают дополнительные мутации / эпимутации, которые действительно обеспечивают пролиферативное преимущество.
Этимология
Термин «новообразование» является синонимом слова «опухоль». «Неоплазия» обозначает процесс образования новообразований / опухолей, этот процесс именуется «неопластическим» процессом. Само слово «опухоль» происходит от греческого нео («новый») и пластик («сформированный, отлитый»).
Термин «опухоль» происходит от латинский имя существительное опухоль, «припухлость» - окончательно от глагола тумере "вспухать". В Британском Содружестве обычно используется написание «опухоль», тогда как в США это слово обычно пишется «опухоль».
В медицинском смысле «опухоль» традиционно означала аномальный отек плоти. Римский медицинский энциклопедист Цельс (c. 30 г. до н.э. - 38 г. н.э.) описал четыре основных признака острого воспаление в качестве опухоль, dolor, калорийность, и рубин (отек, боль, повышенный жар и покраснение). (Его трактат, De Medicina, была первой медицинской книгой, напечатанной в 1478 году после изобретения подвижного печатного станка.)
В современном английском языке слово «опухоль» часто используется как синоним кистозного (заполненного жидкостью) образования или твердого новообразования (злокачественного или незлокачественного).[61] с другими формами отека, которые часто называют "вздутия".[62]
Родственные термины часто встречаются в медицинской литературе, где существительные «припухлость» и «опухоль "(образовано от прилагательного" тумесцентный "[63]) - это современные медицинские термины для обозначения неопухолевых отеков. Этот тип отека чаще всего вызван воспалением, вызванным травмой, инфекцией и другими факторами.
Однако опухоли могут быть вызваны другими причинами, а не чрезмерным ростом неопластических клеток. Кисты (такие как сальные кисты) также называют опухолями, даже если в них нет опухолевых клеток. Это стандартная терминология при выставлении счетов за медицинские услуги (особенно при выставлении счетов за рост, патология которого еще не определена).
Смотрите также
Рекомендации
- ^ «Новообразование». Лексико. Издательство Оксфордского университета.
- ^ а б c d Бирбрайр А., Чжан Т., Ван З.М., Месси М.Л., Олсон Д.Д., Минц А., Дельбоно О. (июль 2014 г.). «Перициты 2 типа участвуют в нормальном и опухолевом ангиогенезе». Являюсь. J. Physiol., Cell Physiol.. 307 (1): C25–38. Дои:10.1152 / ajpcell.00084.2014. ЧВК 4080181. PMID 24788248.
- ^ Купер GM (1992). Элементы рака человека. Бостон: Джонс и Бартлетт Издательство. п. 16. ISBN 978-0-86720-191-8.
- ^ Тейлор, Элизабет Дж. (2000). Иллюстрированный медицинский словарь Дорланда (29-е изд.). Филадельфия: Сондерс. п.1184. ISBN 978-0721662541.
- ^ Медицинский словарь Стедмана (28-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. 2006. с. Новообразование. ISBN 978-0781733908.
- ^ «II Новообразования». Версия 10-го пересмотра Международной статистической классификации болезней и проблем, связанных со здоровьем (МКБ-10), 2010 г.. Всемирная организация здоровья. Получено 19 июн 2014.
- ^ а б Абрамс, Джеральд. «Неоплазия I». Получено 23 января 2012.
- ^ «Рак - Мероприятие 1 - Глоссарий, страница 4 из 5». Архивировано из оригинал на 2008-05-09. Получено 2008-01-08.
- ^ Определение клонирования - определения в медицинском словаре популярных медицинских терминов, легко определяемых на MedTerms
- ^ Ли Е.С., Локер Дж., Налесник М., Рейес Дж., Джаффе Р., Алашари М., Нур Б., Цакис А., Дикман П.С. (январь 1995 г.). «Связь вируса Эпштейна-Барра с опухолями гладкой мускулатуры, возникающими после трансплантации органов». N. Engl. J. Med. 332 (1): 19–25. Дои:10.1056 / NEJM199501053320104. PMID 7990861.
- ^ «Рак поджелудочной железы: Словарь терминов». Получено 2008-01-08.
- ^ «Опухоль». Иллюстрированный медицинский словарь Дорланда (31-е изд.). Сондерс. 2007. ISBN 978-1-84972-348-0.
- ^ Таммела, Туомас; Сейдж, Жюльен (2020). «Исследование неоднородности опухоли в моделях мышей». Ежегодный обзор биологии рака. 4: 99–119. Дои:10.1146 / annurev-Cancebio-030419-033413.
- ^ Асашима М, Ойнума Т., Мейер-Рохов В.Б. (1987). «Опухоли у амфибий». Зоологическая наука. 4: 411–425.
- ^ Амбрози Д., Моллика Ф (2002). «О механике растущей опухоли». Международный журнал инженерных наук. 40 (12): 1297–316. Дои:10.1016 / S0020-7225 (02) 00014-9.
- ^ Волох К.Ю. (сентябрь 2006 г.). «Напряжения в растущих мягких тканях». Acta Biomater. 2 (5): 493–504. Дои:10.1016 / j.actbio.2006.04.002. PMID 16793355.
- ^ Кастан МБ (2008). «Реакция на повреждение ДНК: механизмы и роль в человеческих заболеваниях: лекция 2007 г. на присуждении премии имени Г.А. Клоуса». Мол. Рак Res. 6 (4): 517–24. Дои:10.1158 / 1541-7786.MCR-08-0020. PMID 18403632.
- ^ Каннингем Ф. Х., Фибелкорн С., Джонсон М., Мередит С. (ноябрь 2011 г.). «Новое применение подхода маржи воздействия: разделение токсичных веществ табачного дыма». Food Chem. Токсикол. 49 (11): 2921–33. Дои:10.1016 / j.fct.2011.07.019. PMID 21802474.
- ^ Канави HE, Герстенблит MR (декабрь 2011 г.). «Ультрафиолетовое излучение и меланома». Семин Кутан Мед Сург. 30 (4): 222–8. Дои:10.1016 / j.sder.2011.08.003. PMID 22123420.
- ^ Ханда О, Наито Й, Йошикава Т. (2011). «Редокс-биология и канцерогенез желудка: роль Helicobacter pylori». Редокс Rep. 16 (1): 1–7. Дои:10,1179 / 174329211X12968219310756. ЧВК 6837368. PMID 21605492.
- ^ Бернштейн С., Голубек Х., Бхаттачарья А.К., Нгуен Х., Пейн С.М., Зейтлин Б., Бернштейн Х. (август 2011 г.). «Канцерогенность дезоксихолата, вторичной желчной кислоты». Arch. Токсикол. 85 (8): 863–71. Дои:10.1007 / s00204-011-0648-7. ЧВК 3149672. PMID 21267546.
- ^ Кацурано М., Нива Т., Ясуи Ю., Сигемацу Ю., Ямасита С., Такешима Х., Ли М.С., Ким Ю.Дж., Танака Т., Ушидзима Т. (январь 2012 г.). «Ранняя стадия формирования дефекта эпигенетического поля в модели колита у мышей и несущественные роли Т- и В-клеток в индукции метилирования ДНК». Онкоген. 31 (3): 342–51. Дои:10.1038 / onc.2011.241. PMID 21685942.
- ^ Малкин Д (апрель 2011). «Синдром Ли-Фраумени». Гены рака. 2 (4): 475–84. Дои:10.1177/1947601911413466. ЧВК 3135649. PMID 21779515.
- ^ Лихтенштейн П., Холм Н.В., Веркасало П.К., Илиадоу А., Каприо Дж., Коскенвуо М., Пуккала Е., Скайтте А., Хемминки К. (июль 2000 г.). «Экологические и наследственные факторы в возникновении рака - анализ когорт близнецов из Швеции, Дании и Финляндии». N. Engl. J. Med. 343 (2): 78–85. Дои:10.1056 / NEJM200007133430201. PMID 10891514.
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (июнь 2005 г.). «O (6) -метилгуанинметилтрансфераза при колоректальном раке: обнаружение мутаций, потеря экспрессии и слабая связь с переходами G: C> A: T». Кишечник. 54 (6): 797–802. Дои:10.1136 / гут.2004.059535. ЧВК 1774551. PMID 15888787.
- ^ а б Шен Л., Кондо Й., Роснер Г.Л., Сяо Л., Эрнандес Н.С., Вилайтонг Дж., Хулихан П.С., Кроуз Р.С., Прасад А.Р., Эйнспар Дж. Г., Бакмайер Дж., Альбертс Д.С., Гамильтон С.Р., Исса Дж. П. (сентябрь 2005 г.). «Метилирование промотора MGMT и дефект поля при спорадическом колоректальном раке». J. Natl. Институт рака. 97 (18): 1330–8. Дои:10.1093 / jnci / dji275. PMID 16174854.
- ^ Псофаки В., Калогера С., Цамбурас Н., Стефану Д., Цианос Е., Сефериадис К., Колиос Г. (июль 2010 г.). «Статус метилирования промотора hMLH1, MGMT и CDKN2A / p16 в колоректальных аденомах». Мир J. Гастроэнтерол. 16 (28): 3553–60. Дои:10.3748 / wjg.v16.i28.3553. ЧВК 2909555. PMID 20653064.
- ^ а б c Ли К. Х., Ли Дж. С., Нам Дж. Х., Чхве С., Ли МС, Пак С. С., Джунг С. В., Ли Дж. Х. (октябрь 2011 г.). «Статус метилирования промотора генов hMLH1, hMSH2 и MGMT при колоректальном раке, ассоциированном с последовательностью аденома-карцинома». Langenbecks Arch Surg. 396 (7): 1017–26. Дои:10.1007 / s00423-011-0812-9. PMID 21706233. S2CID 8069716.
- ^ Амату А., Сарторе-Бьянки А., Моутинью С., Белотти А., Бенкардино К., Кирико Дж., Кассингена А., Рускони Ф., Эспозито А., Ничелатти М., Эстеллер М., Сиена С. (апрель 2013 г.). «Промотор CpG-островка гиперметилирования фермента репарации ДНК MGMT предсказывает клинический ответ на дакарбазин в исследовании II фазы метастатического колоректального рака». Clin. Рак Res. 19 (8): 2265–72. Дои:10.1158 / 1078-0432.CCR-12-3518. PMID 23422094.
- ^ Мокаррам П., Замани М., Кавусипур С., Нагибалхоссаини Ф., Ираджи С., Моради Сараби М. и др. (Май 2013). «Различные паттерны метилирования ДНК двух различных областей промотора O6-метилгуанин-ДНК-метилтрансферазы (O6-MGMT) при колоректальном раке». Мол. Биол. Представитель. 40 (5): 3851–7. Дои:10.1007 / s11033-012-2465-3. PMID 23271133. S2CID 18733871.
- ^ Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers JO и др. (Май 2005 г.). «Иммуногистохимический анализ показывает высокую частоту дефектов PMS2 при колоректальном раке». Гастроэнтерология. 128 (5): 1160–71. Дои:10.1053 / j.gastro.2005.01.056. PMID 15887099.
- ^ Валери Н., Гаспарини П., Фаббри М., Бракони С., Веронезе А., Ловат Ф. и др. (Апрель 2010 г.). «Модуляция репарации несовпадений и стабильности генома с помощью miR-155». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 107 (15): 6982–7. Bibcode:2010ПНАС..107.6982В. Дои:10.1073 / pnas.1002472107. ЧВК 2872463. PMID 20351277.
- ^ а б c d е Фасиста А., Нгуен Х., Льюис С., Прасад А.Р., Рэмси Л., Зейтлин Б. и др. (2012). «Недостаточная экспрессия ферментов репарации ДНК при раннем прогрессировании до спорадического рака толстой кишки». Геном Интегр. 3 (1): 3. Дои:10.1186/2041-9414-3-3. ЧВК 3351028. PMID 22494821.
- ^ а б Нараянан Л., Фритцелл Дж. А., Бейкер С. М., Лискай Р. М., Глейзер П. М. (апрель 1997 г.). «Повышенные уровни мутаций во многих тканях мышей с дефицитом гена репарации несоответствия ДНК Pms2». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 94 (7): 3122–7. Bibcode:1997ПНАС ... 94.3122Н. Дои:10.1073 / пнас.94.7.3122. ЧВК 20332. PMID 9096356.
- ^ а б Хеган Д.К., Нараянан Л., Джирик FR, Эдельманн В., Лискай Р.М., Глейзер П.М. (декабрь 2006 г.). «Различия в паттернах генетической нестабильности у мышей, лишенных генов восстановления несовпадений Pms2, Mlh1, Msh2, Msh3 и Msh6». Канцерогенез. 27 (12): 2402–8. Дои:10.1093 / carcin / bgl079. ЧВК 2612936. PMID 16728433.
- ^ а б Тутт А.Н., ван Остром К.Т., Росс Г.М., ван Стиг Х., Эшворт А. (март 2002 г.). «Нарушение Brca2 увеличивает скорость спонтанных мутаций in vivo: синергизм с ионизирующим излучением». EMBO Rep. 3 (3): 255–60. Дои:10.1093 / embo-reports / kvf037. ЧВК 1084010. PMID 11850397.
- ^ О'Хаган Х.М., Мохаммад Х.П., Бейлин С.Б. (2008). Ли JT (ред.). «Двухцепочечные разрывы могут инициировать сайленсинг генов и SIRT1-зависимое начало метилирования ДНК в экзогенном промоторном острове CpG». PLOS Genet. 4 (8): e1000155. Дои:10.1371 / journal.pgen.1000155. ЧВК 2491723. PMID 18704159.
- ^ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV (июль 2007 г.). «Повреждение ДНК, гомологически направленная репарация и метилирование ДНК». PLOS Genet. 3 (7): e110. Дои:10.1371 / journal.pgen.0030110. ЧВК 1913100. PMID 17616978.
- ^ Герлингер М., Роуэн А.Дж., Хорсвелл С., Ларкин Дж., Эндесфельдер Д., Гронроос Э. и др. (Март 2012 г.). «Внутриопухолевая гетерогенность и разветвленная эволюция, выявленные с помощью мультирегионального секвенирования». N. Engl. J. Med. 366 (10): 883–92. Дои:10.1056 / NEJMoa1113205. ЧВК 4878653. PMID 22397650.
- ^ Slaughter DP, Southwick HW, Smejkal W (сентябрь 1953 г.). «Полевая канцеризация в многослойном плоском эпителии полости рта; клинические последствия мультицентрического происхождения». Рак. 6 (5): 963–8. Дои:10.1002 / 1097-0142 (195309) 6: 5 <963 :: AID-CNCR2820060515> 3.0.CO; 2-Q. PMID 13094644.
- ^ Бернштейн C, Бернштейн H, Пейн CM, Дворак K, Гарвал H (февраль 2008 г.). «Дефекты поля в прогрессировании рака желудочно-кишечного тракта». Рак Lett. 260 (1–2): 1–10. Дои:10.1016 / j.canlet.2007.11.027. ЧВК 2744582. PMID 18164807.
- ^ Нгуен Х., Лустаунау С., Фасиста А., Рэмси Л., Хассуна Н., Тейлор Х., Кроуз Р., Пейн С.М., Цикитис В.Л., Гольдшмид С., Банерджи Б., Перини Р.Ф., Бернштейн С. (2010). «Дефицит Pms2, ERCC1, Ku86, CcOI в полевых дефектах при прогрессировании рака толстой кишки». J Vis Exp (41): 1931. Дои:10.3791/1931. ЧВК 3149991. PMID 20689513.
- ^ Рубин Х (март 2011 г.). «Поля и полевая канцеризация: пренеопластическое происхождение рака: бессимптомные гиперпластические поля являются предшественниками неоплазии, и их прогрессирование в опухоли можно отслеживать по плотности насыщения в культуре». BioEssays. 33 (3): 224–31. Дои:10.1002 / bies.201000067. PMID 21254148. S2CID 44981539.
- ^ Цао Дж. Л., Ятабэ Ю., Саловаара Р., Ярвинен Х. Дж., Меклин Дж. П., Аалтонен Л. А., Таваре С., Шибата Д. (февраль 2000 г.). «Генетическая реконструкция истории индивидуальных колоректальных опухолей». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 97 (3): 1236–41. Bibcode:2000PNAS ... 97.1236T. Дои:10.1073 / pnas.97.3.1236. ЧВК 15581. PMID 10655514.
- ^ а б c Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинзлер К.В. (март 2013 г.). «Пейзажи генома рака». Наука. 339 (6127): 1546–58. Bibcode:2013Научный ... 339.1546V. Дои:10.1126 / наука.1235122. ЧВК 3749880. PMID 23539594.
- ^ Локхед П., Чан А.Т., Нишихара Р., Фукс К.С., Бек А.Х., Джованнуччи Е., Огино С. (2014). «Этиологический полевой эффект: переоценка концепции полевого эффекта в предрасположенности и прогрессировании рака». Мод Pathol. 28 (1): 14–29. Дои:10.1038 / modpathol.2014.81. ЧВК 4265316. PMID 24925058.
- ^ Сврчек М., Бухард О., Колас С., Куле Ф., Дюмон С., Массауди И. и др. (Ноябрь 2010 г.). «Толерантность к метилированию из-за дефекта поля O6-метилгуанин-ДНК-метилтрансферазы (MGMT) в слизистой оболочке толстой кишки: начальный шаг в развитии колоректального рака с дефицитом репарации несоответствия». Кишечник. 59 (11): 1516–26. Дои:10.1136 / gut.2009.194787. PMID 20947886. S2CID 206950452.
- ^ Paluszczak J, Misiak P, Wierzbicka M, Woniak A, Baer-Dubowska W (февраль 2011 г.). «Частое гиперметилирование DAPK, RARbeta, MGMT, RASSF1A и FHIT при плоскоклеточном раке гортани и прилегающей нормальной слизистой оболочке». Оральный Онкол. 47 (2): 104–7. Дои:10.1016 / j.oraloncology.2010.11.006. PMID 21147548.
- ^ Zuo C, Zhang H, Spencer HJ, Vural E, Suen JY, Schichman SA, Smoller BR, Kokoska MS, Fan CY (октябрь 2009 г.). «Повышенная микросателлитная нестабильность и эпигенетическая инактивация гена hMLH1 при плоскоклеточной карциноме головы и шеи». Отоларингол Хирургия головы и шеи. 141 (4): 484–90. Дои:10.1016 / j.otohns.2009.07.007. PMID 19786217. S2CID 8357370.
- ^ Тауфик Х.М., Эль-Максуд Н.М., Хак Б.Х., Эль-Щербины Ю.М. (2011). «Плоскоклеточный рак головы и шеи: иммуногистохимия восстановления несоответствия и гиперметилирование промотора гена hMLH1». Ам Дж Отоларингол. 32 (6): 528–36. Дои:10.1016 / j.amjoto.2010.11.005. PMID 21353335.
- ^ Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (ноябрь 2009 г.). «Промотор гиперметилирования нескольких генов в ранней аденокарциноме желудка и предраковых поражениях». Гм. Патол. 40 (11): 1534–42. Дои:10.1016 / j.humpath.2009.01.029. PMID 19695681.
- ^ Вани М., Афрозе Д., Махдуми М., Хамид И., Вани Б., Бхат Г., Вани Р., Вани К. (2012). «Статус метилирования промотора гена репарации ДНК (hMLH1) у больных карциномой желудка в Кашмирской долине». Азиатский Пак. J. Cancer Prev. 13 (8): 4177–81. Дои:10.7314 / APJCP.2012.13.8.4177. PMID 23098428.
- ^ Агарвал А., Полинени Р., Хусейн З., Вигода И., Бхагат Т.Д., Бхаттачарья С., Майтра А., Верма А. (2012). «Роль эпигенетических изменений в патогенезе пищевода Барретта и аденокарциномы пищевода». Int J Clin Exp Pathol. 5 (5): 382–96. ЧВК 3396065. PMID 22808291.
- ^ Hofstad B, Vatn MH, Andersen SN, Huitfeldt HS, Rognum T., Larsen S, Osnes M (сентябрь 1996 г.). «Рост колоректальных полипов: повторное обнаружение и оценка нерезецированных полипов в течение трех лет». Кишечник. 39 (3): 449–56. Дои:10.1136 / гут.39.3.449. ЧВК 1383355. PMID 8949653.
- ^ Шмитт MW, Prindle MJ, Loeb LA (сентябрь 2012 г.). «Последствия генетической гетерогенности рака». Анна. Акад. Наука. 1267 (1): 110–6. Bibcode:2012НЯСА1267..110С. Дои:10.1111 / j.1749-6632.2012.06590.x. ЧВК 3674777. PMID 22954224.
- ^ Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, Devon K, Dewar K, Doyle M, FitzHugh W. и др. (Февраль 2001 г.). "Начальная последовательность и анализ человеческого генома" (PDF). Природа. 409 (6822): 860–921. Дои:10.1038/35057062. PMID 11237011.
- ^ Йост С.Е., Смит Э. Н., Шваб Р. Б., Бао Л., Юнг Х., Ван X, Восток Э., Пирс Дж. П., Мессер К., Паркер Б. А., Харисменди О., Фрейзер К. А. (август 2012 г.). «Идентификация соматических мутаций с высокой степенью достоверности во всей последовательности генома фиксированных формалином образцов рака молочной железы». Нуклеиновые кислоты Res. 40 (14): e107. Дои:10.1093 / нар / gks299. ЧВК 3413110. PMID 22492626.
- ^ Бергер М.Ф., Ходис Э., Хеффернан Т.П., Дерибе Ю.Л., Лоуренс М.С., Протопопов А. и др. (Май 2012 г.). «Секвенирование генома меланомы выявляет частые мутации PREX2». Природа. 485 (7399): 502–6. Bibcode:2012Натура.485..502Б. Дои:10.1038 / природа11071. ЧВК 3367798. PMID 22622578.
- ^ Roach JC, Glusman G, Smit AF, Huff CD, Hubley R, Shannon PT и др. (Апрель 2010 г.). «Анализ генетической наследственности в семейном квартете методом полногеномного секвенирования». Наука. 328 (5978): 636–9. Bibcode:2010Sci ... 328..636R. Дои:10.1126 / science.1186802. ЧВК 3037280. PMID 20220176.
- ^ Кэмпбелл С.Д., Чонг Дж. Х., Малиг М., Ко А., Дюмон Б. Л., Хан Л. и др. (Ноябрь 2012 г.). «Оценка частоты мутаций человека с использованием аутозиготности в популяции-основателе». Nat. Genet. 44 (11): 1277–81. Дои:10,1038 / нг. 2418. ЧВК 3483378. PMID 23001126.
- ^ Опухоль в Медицинская энциклопедия
- ^ "Припухлость". Медицинская энциклопедия MedlinePlus. 14 октября 2012 г.
- ^ "припухлость". Оксфордский словарь английского языка (Интернет-изд.). Издательство Оксфордского университета. (Подписка или членство участвующего учреждения требуется.)
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |

