Механизм действия - Mechanism of action
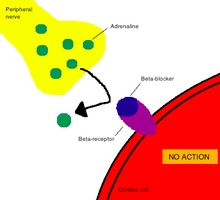
В фармакология, период, термин механизм действия (MOA) относится к конкретным биохимическим взаимодействие через который препарат, средство, медикамент вещество оказывает фармакологический эффект.[2] Механизм действия обычно включает упоминание конкретных молекулярных мишеней, с которыми связывается лекарство, таких как фермент или же рецептор.[3] Рецепторные сайты имеют специфическое сродство к лекарствам, основанное на химической структуре лекарства, а также на специфическом действии, которое там происходит.
Лекарства, которые не связываются с рецепторами, производят соответствующий терапевтический эффект, просто взаимодействуя с химическими или физическими свойствами в организме. Типичные примеры лекарств, которые действуют таким образом: антациды и слабительные.[2]
Напротив, способ действия (MoA) описывает функциональные или анатомические изменения на клеточном уровне, возникающие в результате воздействия на живой организм вещества.
Важность
Выяснение механизма действия новых лекарств и медикаментов важно по нескольким причинам:
- В случае противоинфекционный препарат при разработке, информация позволяет предвидеть проблемы, связанные с клинической безопасностью. Наркотики, нарушающие цитоплазматическая мембрана или же электронная транспортная цепь, например, с большей вероятностью вызовут токсичность проблемы, чем те, которые нацелены на компоненты клеточной стенки (пептидогликан или же β-глюканы ) или же 70S рибосома, структуры, которые отсутствуют в клетках человека.[4][5]
- Зная взаимодействие между определенным участком действия лекарства и рецептором, другие лекарства могут быть составлены таким образом, чтобы воспроизводить это взаимодействие, обеспечивая тем самым те же терапевтические эффекты. Действительно, этот метод используется для создания новых лекарств.
- Это может помочь определить, какие пациенты с наибольшей вероятностью ответят на лечение. Поскольку рак молочной железы медикамент трастузумаб известен как целевой белок HER2, Например, опухоли можно проверить на наличие этой молекулы, чтобы определить, получит ли пациент пользу от терапии трастузумабом.[6][7]
- Это может позволить лучше дозирование потому что действие препарата на целевой путь можно отслеживать у пациента. Статины дозировка, например, обычно определяется путем измерения крови пациента холестерин уровни.[6]
- Это позволяет комбинированные препараты таким образом, снижается вероятность возникновения лекарственной устойчивости. Зная, какой клеточной структуры обладает противоинфекционный или противоопухолевый действует на лекарство, можно вводить коктейль, который подавляет несколько целей одновременно, тем самым снижая риск того, что один мутация в микробе или опухоли ДНК приведет к лекарственной устойчивости и неудаче лечения.[4][8][9][10]
- Это может позволить идентифицировать другие показания к применению препарата. Открытие, что силденафил подавляет фосфодиэстераза-5 (ФДЭ-5) белки, например, позволили этому препарату быть перепрофилированный за легочная артериальная гипертензия лечение, поскольку ФДЭ-5 экспрессируется в легких с легочной гипертензией.[11][12]
Определение
Методы на основе микроскопии

Биоактивные соединения вызывают фенотипический изменения в клетках-мишенях, изменения, которые наблюдаются микроскопия, и которые могут дать представление о механизме действия соединения.[13]
С антибактериальные средства, превращение клеток-мишеней в сферопласты может быть признаком того, что пептидогликан синтез тормозится, и филаментация клеток-мишеней может быть признаком того, что PBP 3, FtsZ или же Синтез ДНК подавляется. Другие изменения, вызванные антибактериальным агентом, включают образование овоидных клеток, псевдомиклеточные формы, локализованное набухание, образование выпуклостей, образование пузырей и утолщение пептидогликана.[4] В случае противораковые агенты, пузырь образование может быть признаком того, что соединение нарушает плазматическая мембрана.[14]
Текущее ограничение этого подхода - время, необходимое для ручного создания и интерпретации данных, но достижения в автоматизированной микроскопии и анализ изображений программное обеспечение может помочь решить эту проблему.[4][13]
Прямые биохимические методы
Прямые биохимические методы включают методы, в которых белок или небольшая молекула, например кандидат в лекарство, маркируются и отслеживаются по всему телу.[15] Это оказывается наиболее прямым подходом к поиску белка-мишени, который будет связываться с небольшими интересующими целями, такими как базовое представление схемы лекарственного средства, чтобы идентифицировать фармакофор препарата. Из-за физических взаимодействий между меченой молекулой и белком биохимические методы могут использоваться для определения токсичности, эффективности и механизма действия лекарственного средства.
Методы вывода вычислений
Обычно методы компьютерного вывода в основном используются для прогнозирования белковых мишеней для низкомолекулярных лекарств на основе компьютерного распознавания образов.[15] Однако этот метод также можно использовать для поиска новых мишеней для существующих или вновь разрабатываемых лекарств. Определив фармакофор молекулы лекарственного средства метод профилирования для распознавания образов может быть проведен там, где идентифицирована новая цель.[15] Это дает представление о возможном механизме действия, поскольку известно, какие определенные функциональные компоненты лекарственного средства отвечают за взаимодействие с определенной областью белка, что приводит к терапевтическому эффекту.
Методы, основанные на омиксе
Методы, основанные на омиксе, используют омикс-технологии, такие как обратная генетика и геномика, транскриптомика, и протеомика, чтобы определить потенциальные цели интересующего соединения.[16] Подходы обратной генетики и геномики, например, используют генетические нарушения (например, CRISPR -Cas9 или же миРНК ) в сочетании с соединением для идентификации генов, нокдаун или нокаутировать отменяет фармакологический эффект соединения. С другой стороны, профили транскриптомики и протеомики соединения можно использовать для сравнения с профилями соединений с известными мишенями. Благодаря выводам вычислений можно делать гипотезы о механизме действия соединения, которые впоследствии можно проверить.[16]
Препараты с известной MOA
Есть много препаратов, у которых известен механизм действия. Один из примеров - аспирин.
Аспирин
В механизм действия аспирина включает необратимое ингибирование фермента циклооксигеназа;[17] поэтому подавление производства простагландины и тромбоксаны, таким образом уменьшая боль и воспаление. Этот механизм действия специфичен для аспирина и не является постоянным для всех. нестероидные противовоспалительные препараты (НПВП). Скорее, аспирин - единственный НПВП, необратимо подавляющий ЦОГ-1.[18]
Препараты с неизвестной MOA
Некоторые механизмы действия препарата до сих пор неизвестны. Однако, несмотря на то, что механизм действия определенного лекарства неизвестен, он все еще функционирует; просто неизвестно или неясно, как препарат взаимодействует с рецепторами и оказывает терапевтический эффект.
Способ действия
В некоторых литературных статьях термин механизм действия и способ действия (MoA) используются взаимозаменяемо; обычно относится к способу, которым лекарство взаимодействует и оказывает лечебный эффект. Однако на самом деле способ действия описывает функциональные или анатомические изменения на клеточном уровне, возникающие в результате воздействия вещества на живой организм.[19] Это отличается от механизма действия, поскольку это более конкретный термин, который фокусируется на взаимодействии между самим лекарственным средством и фермент или же рецептор и его особую форму взаимодействия, будь то через торможение, активация, агонизм, или же антагонизм. Кроме того, термин механизм действия является основным термином, который в основном используется в фармакологии, тогда как механизм действия чаще встречается в области микробиологии или определенных аспектов биологии.
Смотрите также
Рекомендации
- ^ Огродовчик, М .; Dettlaff, K .; Елинска, А. (2016). «Бета-адреноблокаторы: современное состояние и перспективы». Мини-обзоры по медицинской химии. 16 (1): 40–54. Дои:10.2174/1389557515666151016125948. PMID 26471965.
- ^ а б Spratto, G.R .; Вудс, А.Л. (2010). Справочник медсестры Дельмар по лекарствам. Cengage Learning. ISBN 978-1-4390-5616-5.
- ^ Grant, R.L .; Combs, A.B .; Акоста, Д. (2010) "Экспериментальные модели для исследования токсикологических механизмов". В McQueen, C.A. Комплексная токсикология (2-е изд.). Оксфорд: Эльзевир. п. 204. ISBN 978-0-08-046884-6.
- ^ а б c d е Cushnie, T.P .; O’Driscoll, N.H .; Лэмб, А.Дж. (2016). «Морфологические и ультраструктурные изменения бактериальных клеток как индикатор антибактериального механизма действия». Клеточные и молекулярные науки о жизни. 73 (23): 4471–4492. Дои:10.1007 / s00018-016-2302-2. HDL:10059/2129. PMID 27392605.
- ^ Chang, C.C .; Славин, М.А .; Чен, С.С. (2017). «Новые разработки и направления в клиническом применении эхинокандинов». Архив токсикологии. 91 (4): 1613–1621. Дои:10.1007 / s00204-016-1916-3. PMID 28180946.
- ^ а б Авторы не указаны (2010 г.). "Механизм имеет значение". Природа Медицина. 16 (4): 347. Дои:10,1038 / нм0410-347. PMID 20376007.
- ^ Йоэнсуу, Х. (2017). «Эскалация и деэскалация лечения HER2-положительного рака груди на ранней стадии». Отзывы о лечении рака. 52: 1–11. Дои:10.1016 / j.ctrv.2016.11.002. PMID 27866067.
- ^ Cihlar, T .; Фордайс, М. (2016). «Текущее состояние и перспективы лечения ВИЧ». Текущее мнение в вирусологии. 18: 50–56. Дои:10.1016 / j.coviro.2016.03.004. PMID 27023283.
- ^ Antony, H.A .; Parija, S.C. (2016). «Устойчивость к противомалярийным препаратам: обзор». Тропическая паразитология. 6 (1): 30–41. Дои:10.4103/2229-5070.175081. ЧВК 4778180. PMID 26998432.
- ^ Bozic, I .; Reiter, J.G .; Allen, B .; Antal, T .; Chatterjee, K .; Shah, P .; Moon, Y.S .; Yaqubie, A .; Kelly, N .; Le, D.T .; Lipson, E.J .; Chapman, P.B .; Diaz, L.A .; Фогельштейн, Б., Новак, М.А. (2013). «Эволюционная динамика рака в ответ на таргетную комбинированную терапию». eLife. 2: Идентификатор статьи e00747. Дои:10.7554 / eLife.00747. ЧВК 3691570. PMID 23805382.CS1 maint: несколько имен: список авторов (связь)
- ^ Тари, Л .; Во, Н .; Liang, S .; Patel, J .; Baral, C .; Цай, Дж. (2012). «Выявление показаний к новым лекарствам с помощью автоматизированных рассуждений». PLOS ONE. 7 (7): Статья e40946. Дои:10.1371 / journal.pone.0040946. ЧВК 3402456. PMID 22911721.
- ^ Хаярдени, Л. (2014). Почему важно знать механизм действия лекарств? (Презентация на конференции). Семинар "Новые рубежи в нейробиологии и методах трансдисциплинарного образования", Тель-Авивский университет, Израиль: Тель-Авивский университет. Получено 18 марта 2017.
- ^ а б Fetz, V .; Prochnow, H .; Brönstrup, M .; Зассе, Ф. (2016). «Идентификация цели путем анализа изображения» (PDF). Отчеты о натуральных продуктах. 33 (5): 655–667. Дои:10.1039 / c5np00113g. HDL:10033/621283. PMID 26777141.
- ^ Дубовский, П.В .; Василевский, А.А .; Козлов, С.А .; Феофанов, А.В .; Гришин, Е.В .; Ефремов, Р. (2015). «Латарцины: универсальные пептиды яда пауков». Клеточные и молекулярные науки о жизни. 72 (23): 4501–4522. Дои:10.1007 / s00018-015-2016-х. PMID 26286896.
- ^ а б c Schenone, M .; Dančík, V .; Вагнер, Б.К .; Клемонс, П.А. (2013). «Идентификация цели и механизм действия в химической биологии и открытии лекарств». Природа Химическая Биология. 9 (4): 232–240. Дои:10.1038 / nchembio.1199. ISSN 1552-4450. ЧВК 5543995. PMID 23508189.
- ^ а б Wecke, T .; Машер, Т. (2011). «Исследования антибиотиков в эпоху омиков: от профилей экспрессии до межвидовой коммуникации». Журнал антимикробной химиотерапии. 66 (12): 2689–2704. Дои:10.1093 / jac / dkr373. PMID 21930574.
- ^ Tóth, L .; Muszbek, L .; Комароми, И. (2013). «Механизм необратимого ингибирования человеческой циклооксигеназы-1 аспирином, предсказанный расчетами QM / MM». Журнал молекулярной графики и моделирования. 40: 99–109. Дои:10.1016 / j.jmgm.2012.12.013. PMID 23384979.
- ^ Sharma, S .; Шарма, С. С. (1997). «Обновленная информация об эйкозаноидах и ингибиторах ферментных систем циклооксигеназы». Индийский журнал экспериментальной биологии. 35 (10): 1025–1031. ISSN 0019-5189. PMID 9475035.
- ^ «Механизмы и режим действия диоксинов» (PDF). Агентство по охране окружающей среды США. Получено 11 июн 2012.
