Направляющая РНК - Guide RNA
Направляющие РНК (a.k.a. гРНК, сгРНК) являются РНК которые направляют вставку или удаление остатков уридина в митохондриальный мРНК в кинетопластид протисты в процессе, известном как Редактирование РНК.[1]
Термины «направляющая РНК» и «гРНК» являются также использовал в прокариотический Редактирование ДНК с участием CRISPR и Cas9. Для этой прокариотической системы редактирования ДНК гРНК придает специфичность последовательности-мишени системе CRISPR-Cas9. Эти гРНК представляют собой некодирующие короткие последовательности РНК, которые связываются с комплементарными последовательностями ДНК-мишени. Направляющая РНК сначала связывается с ферментом Cas9, а последовательность гРНК направляет комплекс через спаривание в определенное место на ДНК, где Cas9 выполняет свою эндонуклеазную активность, разрезая цепь ДНК-мишени.
Помимо экспрессии нуклеазы Cas9, системе CRISPR-Cas9 требуется определенная молекула РНК для рекрутирования и направления нуклеазной активности в интересующую область. Эти направляющие РНК имеют одну из двух форм:
- Синтетическая трансактивирующая РНК CRISPR (tracrRNA) плюс синтетическая РНК CRISPR (crRNA), предназначенная для расщепления интересующего участка-мишени гена
- Синтетическая или экспрессированная одиночная направляющая РНК (sgRNA), которая состоит из crRNA и tracrRNA в виде единой конструкции.
CrRNA и tracrRNA образуют комплекс, который действует как направляющая РНК для фермента Cas9. Способность tracrRNA к формированию каркаса вместе со специфичностью crRNA может быть объединена в единую синтетическую gRNA, которая упрощает управление генными изменениями до однокомпонентной системы, которая может повысить эффективность.
История
Руководство по редактированию РНК РНК было открыто в 1990 году Б. Блюмом, Н. Бакаларой и Л. Симпсоном.[2] из-за их роли в редактировании РНК в митохондрии Leishmania tarentolae. Эти молекулы гРНК кодируются в ДНК максимального кольца в митохондриях, имеющих последовательности, которые комплементарны зрелым мРНК в редактируемых областях. Они участвуют в нескольких активностях по расщеплению, вставке или удалению оснований после образования частичного гибрида между гРНК и предварительно отредактированной мРНК.
Направляющая РНК у протистов
Трипаносоматид протисты и другие кинетопластиды имеют новый процесс посттранскрипционной модификации митохондриальной РНК, известный как «редактирование РНК». У них есть большой сегмент высокоорганизованных сегментов ДНК, присутствующих в митохондриях. Эта митохондриальная ДНК является кольцевой и существует в одной из двух форм: максициклических или миникольцевых. Есть 20-50 Maxicircles на клетки, имеющие как кодирующие, так и некодирующие области. Кодирующая область является высококонсервативной (16-17 kb), а некодирующая область варьируется в зависимости от вида. Миникруги маленькие, но их больше, чем максикокружностей. Миникольцы составляют 95% массы кинетопластидной ДНК. Maxicircles может кодировать "криптогены "и некоторые гРНК; миникольца могут кодировать большинство гРНК. До 1000 гРНК могут кодироваться 250 или более миникольцами. Некоторые гены гРНК показывают идентичные сайты вставки и делеции, даже если они имеют разные последовательности, тогда как другие последовательности гРНК не комплементарны к предварительно отредактированной мРНК. Молекулы максициклов и миникольцов связаны в гигантскую сеть ДНК, которая расположена в основании жгутик во внутреннем отсеке одиночной митохондрии.[2]
Большинство транскриптов maxicircle не могут транслироваться в белки из-за множественных сдвигов рамки считывания в последовательностях. Эти сдвиги рамки корректируются после транскрипции путем вставки и удаления уридин остатки в точных сайтах, которые создают открытую рамку считывания, которая транслируется в митохондриальный белок, гомологичный митохондриальным белкам из других клеток. Вставки и делеции опосредуются короткой направляющей РНК (gRNA), которая кодирует информацию редактирования в форме комплементарных последовательностей (что позволяет использовать пары оснований GU, а также GC).
Комплекс гРНК-мРНК
Направляющие РНК в основном транскрибируются из межгенной области максицикла ДНК, и они комплементарны зрелой мРНК. Важно, чтобы гРНК сначала взаимодействовала с предварительно отредактированной мРНК, а затем с ее парой оснований в 5'-области с комплементарной мРНК. 3'-конец гРНК содержит олиго-U-хвост (5-25 нуклеотидов в длину), который является некодируемой областью, но взаимодействует и образует стабильный комплекс с богатой A и G областью мРНК. Этот исходный гибрид помогает в распознавании конкретного редактируемого участка мРНК.[3]
Функция
Наличие двух геномов в митохондрии, один из которых содержит информацию о последовательности, которая исправляет ошибки в другом геноме, является новым явлением. Редактирование обычно продолжается от 3 'до 5' мРНК. Событие первоначального редактирования происходит, когда гРНК образует дуплекс РНК с комплементарной последовательностью мРНК сразу после сайта редактирования. Затем это набирает ряд рибонуклеопротеин комплексы, которые направляют расщепление первого ошибочно спаренного основания, соседнего с якорем гРНК-мРНК. Уридилитрансфераза вставляет U на 3'-конце, а РНК-лигаза отвечает за соединение двух обрезанных концов. Затем аналогичным образом модифицируется соседний вышестоящий сайт редактирования. Одна гРНК обычно кодирует информацию для нескольких сайтов редактирования («блок редактирования»), редактирование которого дает полный дуплекс гРНК / мРНК. Этот процесс модификации получил название оригинальной модели ферментного каскада.[4]
В случае «пан-редактируемых» мРНК,[5] дуплекс раскручивается, и другая гРНК затем образует дуплекс с отредактированной последовательностью мРНК и инициирует еще один раунд редактирования. Перекрывающиеся gRNA образуют редактирующий «домен». В некоторых генах существует несколько доменов редактирования. Степень редактирования любого конкретного гена варьируется между видами трипаносоматид. Вариация состоит в потере редактирования на 3'-стороне, вероятно, из-за потери классов последовательностей миникольца, которые кодируют специфические гРНК. А ретропозиция Модель была предложена для учета частичной, а в некоторых случаях полной потери редактирования в процессе эволюции. Потеря редактирования в большинстве случаев приводит к летальному исходу, хотя потери были замечены в старых лабораторных штаммах. Сохранение редактирования на протяжении долгой эволюционной истории этих древних протистов предполагает наличие избирательного преимущества, точная природа которого все еще не ясна.
Непонятно, почему трипаносоматиды используют такой сложный механизм для производства мРНК. Возможно, он возник в ранней митохондрии предка линии протистов кинтопластид, так как он присутствует в бодониды которые являются предками трипаносоматид и могут не присутствовать в эвгленоиды, которые произошли от того же общего предка, что и кинетопластиды.
У простейших Leishmania tarentolae, 12 из 18 митохондриальных генов редактируются с помощью этого процесса. Один из таких генов - Cyb. На самом деле мРНК редактируется дважды подряд. Для первого редактирования соответствующая последовательность мРНК выглядит следующим образом:
мРНК 5 'AAAGAAAAGGCUUUAACUUCAGGUUGU 3'
3'-конец используется для закрепления gRNA (gCyb-I gRNA в данном случае) путем спаривания оснований (используются некоторые пары G / U). Конец 5 футов не совсем совпадает и является одним из трех конкретных эндонуклеазы расщепляет мРНК на сайте несовпадения.
gRNA 3 'AAUAAUAAAUUUUUAAAUAUAAUAGAAAAUUGAAGUUCAGUA 5'mRNA 5' A A AGAAA A G G C UUUAACUUCAGGUUGU 3 '
Теперь мРНК «восстанавливается» путем последовательного добавления U на каждом сайте редактирования, что дает следующую последовательность:
gRNA 3 'AAUAAUAAAUUUUUAAAUAUAAUAGAAAAUUGAAGUUCAGUA 5'mRNA 5' UUAUUAUUUAGAAAUUUAUGUUGUCUUUUAACUUCAGGUUGU 3 '
Этот конкретный ген имеет два перекрывающихся сайта редактирования гРНК. 5 'конец этого раздела - это 3' якорь для другой гРНК (gCyb-II gRNA)
Направляющая РНК у прокариот
CRISPR в прокариотах
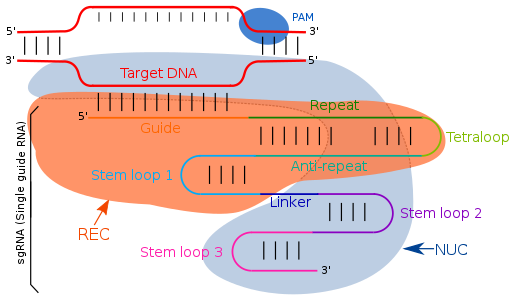
Большинство прокариот, таких как бактерии и археи, используют свою адаптивную иммунную систему, используя CRISPR (сгруппированные с регулярными интервалами короткие палиндромные повторы) и фермент cas для обнаружения и удаления чужеродного генетического материала. Когда прокариоты инфицированы бактериофагами, ДНК фага дает короткие кластерные повторы (CRISPR), которые используются для обнаружения и отщепления фрагментов ДНК от фагов аналогичного типа. Этот защитный механизм прокариот используется как метод редактирования, который также может использоваться в процессе генной терапии. Метод редактирования CRISPR Cas использует gRNA для идентификации и расщепления цепей ДНК.
Структура
Направляющая РНК нацелена на комплементарные последовательности путем простого спаривания оснований Уотсона-Крика. В системе CRISPR / cas типа II единая направляющая РНК направляет целевые специфические области. Единая направляющая РНК - это искусственно запрограммированная комбинация двух молекул РНК, одного компонента. (tracrRNA ) отвечает за активность эндонуклеазы Cas9, а другая (crRNA) связывается с целевой областью ДНК. Следовательно, трансактивирующая РНК (tracrRNA ) и crRNA являются двумя ключевыми компонентами и соединяются тетрапетлей, что приводит к образованию sgRNA. TracrRNA представляют собой пары оснований, имеющие стеблевая петля структура сама по себе и прикрепляется к эндонуклеаза фермент. Транскрипция локуса CRISPR дает РНК CRISPR (crRNA), которая имеет спейсер-фланкированную область из-за повторяющихся последовательностей, состоящих из 18-20 пар оснований. crRNA идентифицирует специфическую комплементарную целевую область, которая расщепляется Cas9 после его связывания с crRNA и tcRNA, которые все вместе известны как эффекторный комплекс. С помощью модификаций в последовательностях crRNA направляющей РНК можно изменить место связывания и, следовательно, определить его как программу, определяемую пользователем.
Приложения
Разработка гРНК
Нацеленная специфичность CRISPR-Cas9 определяется 20-нуклеотидной последовательностью на 5'-конце гРНК. Желаемая последовательность-мишень должна предшествовать мотиву, прилегающему к протоспейсеру (PAM), который представляет собой короткую последовательность ДНК, обычно длиной 2-6 пар оснований, которая следует за областью ДНК, нацеленной на расщепление системой CRISPR, такой как CRISPR-Cas9. PAM необходим для разрезания нуклеазы Cas и обычно находится на 3–4 нуклеотидах ниже участка разреза. После спаривания оснований гРНК с мишенью Cas9 опосредует двухцепочечный разрыв примерно на 3 нуклеотида выше PAM.
Содержание ГХ в направляющей последовательности должно составлять 40-80%. Высокое содержание GC стабилизирует дуплекс РНК-ДНК, дестабилизируя гибридизацию вне мишени. Длина направляющей последовательности должна быть между 17-24 п.о., при этом более короткая последовательность минимизирует эффекты, не соответствующие цели. Направляющие последовательности размером менее 17 пар оснований могут нацеливаться на несколько локусов.
CRISPR Cas9
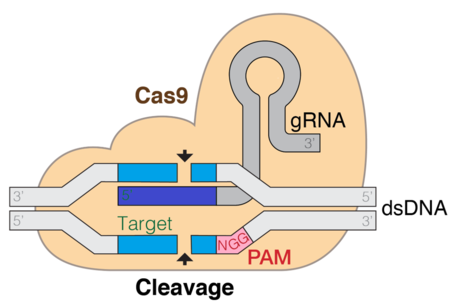
CRISPR (Кластерные короткие палиндромные повторы с регулярными интервалами) / Cas9 - это метод, используемый для редактирования генов и генной терапии. Cas - это фермент эндонуклеаза, который разрезает ДНК в определенном месте, управляемом направляющей РНК. Это специфическая для мишени методика, которая может вызвать нокаут или нокаут гена в зависимости от пути двухцепочечной репарации. Доказательства показывают, что как in vitro, так и in vivo требуется tracrRNA для связывания Cas9 и последовательности ДНК-мишени. Система CRISPR CAS9 состоит из трех основных этапов. Первый этап - расширение оснований в области локуса CRISPR путем добавления спейсеров чужеродной ДНК в последовательность генома. Несколько разных белков, таких как cas1 и cas2, помогают находить новые спейсеры. Следующий этап включает транскрипцию CRISPR: пре-crRNA (предшественник CRISPR РНК) экспрессируется транскрипцией массива повтор-спейсер CRISPR. При дальнейшей модификации пре-crРНК превращаются в единый спейсер, фланкированный областью, с образованием короткой crРНК. Процесс созревания РНК аналогичен для типов I и II, но отличается для типа III, на этом этапе добавляются аРНК в качестве индикатора. Третий этап включает связывание белка cas9 и направление его на расщепление сегмента ДНК. Белок Cas9 связывается с комбинированной формой crRNA и tracrRNA, образуя эффекторный комплекс. Они действуют как направляющая РНК для белка cas9, управляя его эндонуклеазной активностью.[6]
Мутагенез РНК
Одним из важных методов регуляции генов является мутагенез РНК, который может быть введен путем редактирования РНК с помощью гРНК. Направляющая РНК заменяет аденозин на инозин в конкретном целевом сайте и изменяет генетический код.[7] Аденозиндезаминаза действует на РНК, вызывая посттранскрипционную модификацию, изменяя кодоны и различные функции белков. Направляющие РНК представляют собой небольшие ядрышковые РНК, которые вместе с рибопротеинами выполняют внутриклеточные изменения РНК, такие как рибометилирование в рРНК и введение псевдоуридина в прерибосомальную РНК. Направляющая РНК связывается с антисмысловой последовательностью РНК и регулирует модификацию РНК. Замечено, что малая интерферирующая РНК (миРНК) и микроРНК (миРНК) обычно используются в качестве последовательности РНК-мишени, и модификации сравнительно легко вводятся из-за небольшого размера.
Смотрите также
Рекомендации
- ^ Hajduk, S.L .; Harris, M.E .; Поллард, В. В. (январь 1993 г.). «Редактирование РНК в митохондриях кинетопластид». Журнал FASEB. 7 (1): 54–63. Дои:10.1096 / fasebj.7.1.8422975. ISSN 0892-6638. PMID 8422975.
- ^ а б Blum, B .; Бакалара, Н .; Симпсон, Л. (26 января 1990). «Модель редактирования РНК в митохондриях кинетопластид:« руководство », молекулы РНК, транскрибированные из ДНК максицикла, предоставляют отредактированную информацию». Клетка. 60 (2): 189–198. Дои:10.1016 / 0092-8674 (90) 90735-в.. ISSN 0092-8674. PMID 1688737.
- ^ Коннелл, Грегори Дж .; Бирн, Элейн М .; Симпсон, Ларри (14 февраля 1997 г.). «Направляющая РНК-независимая и направляющая РНК-зависимая вставка уридина в мРНК цитохрома b в митохондриальном лизате из Leishmania tarentolae РОЛЬ ВТОРИЧНОЙ СТРУКТУРЫ РНК». Журнал биологической химии. 272 (7): 4212–4218. Дои:10.1074 / jbc.272.7.4212. ISSN 0021-9258. PMID 9020135.
- ^ Коннелл, Грегори Дж .; Бирн, Элейн М .; Симпсон, Ларри (14 февраля 1997 г.). «Направляющая РНК-независимая и направляющая РНК-зависимая вставка уридина в мРНК цитохрома b в митохондриальном лизате из Leishmania tarentolae РОЛЬ ВТОРИЧНОЙ СТРУКТУРЫ РНК». Журнал биологической химии. 272 (7): 4212–4218. Дои:10.1074 / jbc.272.7.4212. ISSN 0021-9258. PMID 9020135.
- ^ Маслов, Дмитрий А. (октябрь 2010 г.). «Полный набор митохондриальных пан-редактируемых мРНК в Leishmania mexicana amazonensis LV78». Молекулярная и биохимическая паразитология. 173 (2): 107–114. Дои:10.1016 / j.molbiopara.2010.05.013. ISSN 0166-6851. ЧВК 2913609. PMID 20546801.
- ^ Карвелис, Таутвидас; Гасюнас, Гедрюс; Миксис, Альгирдас; Баррангу, Родольф; Хорват, Филипп; Сикснис, Виргиниюс (01.05.2013). «crRNA и tracrRNA направляют Cas9-опосредованную интерференцию ДНК в Streptococcus thermophilus». РНК Биология. 10 (5): 841–851. Дои:10.4161 / rna.24203. ISSN 1547-6286. ЧВК 3737341. PMID 23535272.
- ^ Фукуда, Масатора; Умено, Хиромицу; Нос, Канако; Нишитарумизу, Азуса; Ногучи, Рёма; Накагава, Хироюки (02.02.2017). «Создание направляющей РНК для сайт-направленного мутагенеза РНК с использованием внутриклеточного редактирования РНК A-to-I». Научные отчеты. 7: 41478. Bibcode:2017НатСР ... 741478F. Дои:10.1038 / srep41478. ISSN 2045-2322. ЧВК 5288656. PMID 28148949.
дальнейшее чтение
- Руководство по редактированию РНК-инсерции уридина с помощью РНК in vitrohttp://www.jbc.org/content/272/7/4212.full
- Блюм, Бит; Симпсон, Ларри (1990). «Направляющие РНК в митохондриях кинетопластид имеют незакодированный 3'-олиго (U) хвост, участвующий в распознавании предварительно отредактированной области». Клетка. 62 (2): 391–397. Дои:10.1016 / 0092-8674 (90) 90375-О. PMID 1695552.
- Курата, Морито; Волк, Натали К .; Lahr, Walker S .; Weg, Madison T .; Kluesner, Mitchell G .; Ли, Саманта; Хуэй, Кай; Шираива, Масано; Webber, Beau R .; Мориарти, Бранден С. (2018). «Высоко мультиплексная инженерия генома с использованием массивов гРНК CRISPR / Cas9». PLOS ONE. 13 (9): e0198714. Bibcode:2018PLoSO..1398714K. Дои:10.1371 / journal.pone.0198714. ЧВК 6141065. PMID 30222773.
- Khan, Fehad J .; Юэнь, Гармен; Ло, Цзи (2019). «Мультиплексный нокаут гена CRISPR / Cas9 с простой ко-трансфекцией crRNA: tracrRNA». Cell & Bioscience. 9: 41. Дои:10.1186 / s13578-019-0304-0. ЧВК 6528186. PMID 31139343.
- Нисимасу, Хироши; Нуреки, Осаму (2017). «Структуры и механизмы действия эффекторных нуклеаз, управляемых РНК CRISPR». Текущее мнение в структурной биологии. 43: 68–78. Дои:10.1016 / j.sbi.2016.11.013. PMID 27912110.
- Чуай, Гохуэй; Ма, Ханьхуэй; Ян, Цзифан; Чен, Мин; Хун, Нанфан; Сюэ, Дунъюй; Чжоу, Чи; Чжу, Чэньюй; Чен, Кэ; Дуань, Бин; Гу, Фэн; Цюй, Шэн; Хуанг, Дешуан; Вэй, Цзя; Лю, Ци (2018). "DeepCRISPR: Оптимизированный дизайн РНК руководства CRISPR с помощью глубокого обучения". Геномная биология. 19 (1): 80. Дои:10.1186 / s13059-018-1459-4. ЧВК 6020378. PMID 29945655.
