Редактирование РНК - RNA editing
Редактирование РНК (также Модификация РНК) представляет собой молекулярный процесс, посредством которого некоторые клетки могут вносить дискретные изменения в определенные нуклеотидные последовательности в пределах РНК молекула после того, как она была создана РНК-полимераза. Он встречается во всех живых организмах и является одним из наиболее эволюционно сохраняемых свойств РНК.[1][2][3] Редактирование РНК может включать в себя вставку, удаление и замену оснований нуклеотидов в молекуле РНК. Редактирование РНК относительно редко, с распространенными формами обработки РНК (например, сращивание, 5'-укупорка, и 3'-полиаденилирование ) обычно не рассматривается как редактирование. Он может влиять на активность, локализацию, а также стабильность РНК и связан с заболеваниями человека.[1][2][3][4]
Редактирование РНК наблюдалось в некоторых тРНК, рРНК, мРНК, или miRNA молекулы эукариоты и их вирусы, археи, и прокариоты.[5] Редактирование РНК происходит в ядре клетки и цитозоль, а также внутри митохондрии и пластиды. У позвоночных редактирование происходит редко и обычно состоит из небольшого количества изменений в последовательности затронутых молекул. У других организмов, таких как кальмары,[6] обширное редактирование (пан-редактирование) может случиться; в некоторых случаях большинство нуклеотидов в последовательности мРНК может быть результатом редактирования. К настоящему времени описано более 160 типов модификаций РНК.[7]
Процессы редактирования РНК демонстрируют большое молекулярное разнообразие, и некоторые из них кажутся эволюционно недавними приобретениями, возникшими независимо. Разнообразие явлений редактирования РНК включает азотистое основание модификации, такие как цитидин (C) к уридин (U) и аденозин (А) к инозин (Я) дезаминирование, а также добавления и вставки нематричных нуклеотидов. Редактирование РНК в мРНК эффективно изменяет аминокислотная последовательность кодируемого белка, так что он отличается от предсказанного последовательностью геномной ДНК.[8]
Обнаружение редактирования РНК
Секвенирование нового поколения
Для выявления разнообразных посттранскрипционных модификаций молекул РНК и определения ландшафта модификаций РНК в масштабе всего транскриптома с помощью секвенирования РНК следующего поколения в последнее время были разработаны многие исследования.[9] или специальные методы секвенирования.[1][2][3] Примеры специализированных методов: MeRIP-seq,[10] m6A-seq,[11] метилирование-iCLIP,[12] m6A-CLIP,[13] Псевдо-последовательность,[14] Ψ-seq,[15] CeU-seq,[16] Аза-ИП[17] и RiboMeth-seq[18]). Применение этих методов позволило выявить различные модификации (например, псевдоуридин, м6А, m5C, 2'-O-Me) в кодирующих генах и некодирующих генах (например, тРНК, днРНК, микроРНК) с одним нуклеотидом или с очень высоким разрешением.[4]
Масс-спектрометрии
Масс-спектрометрии это способ качественно и (относительно) количественно оценить модификации РНК.[19] Чаще всего модификации вызывают увеличение массы данного нуклеозида. Это дает характерные показания для нуклеозида и модифицированного аналога.[19] Более того, масс-спектрометрия позволяет исследовать динамику модификации, маркируя молекулы РНК стабильными (нерадиоактивными) тяжелыми изотопами. in vivo. Из-за определенного увеличения массы нуклеозидов, меченных тяжелыми изотопами, их можно отличить от соответствующих немеченых изотопомеров с помощью масс-спектрометрии. Этот метод называется ГВОЗДЬ-MS (сопряженная масс-спектрометрия с мечением изотопов нуклеиновых кислот), позволяет использовать различные подходы для исследования динамики модификации РНК.[20][21][22]
Типы РНК
Модификация матричной РНК
Недавно функциональные эксперименты выявили много новых функциональных ролей модификаций РНК. Например, m6Было предсказано, что A влияет на трансляцию и локализацию белка,[1][2][3] стабильность мРНК,[23] альтернативный выбор polyA [13] и плюрипотентность стволовых клеток.[24] Псевдоуридилирование бессмысленных кодонов подавляет прекращение трансляции как in vitro и in vivo, предполагая, что модификация РНК может предоставить новый способ расширения генетического кода.[25] Важно отметить, что многие ферменты модификации не регулируются и генетически мутируют при многих типах заболеваний.[1] Например, генетические мутации в псевдоуридинсинтазах вызывают митохондриальную миопатию, сидеробластную анемию (MLASA). [26] и дискератоз врожденный.[27]
Модификации РНК переноса
Передача РНК или тРНК является наиболее модифицированным типом РНК.[28] Модификации тРНК играют решающую роль в поддержании эффективности трансляции благодаря поддерживающей структуре, взаимодействиям антикодон-кодон и взаимодействиям с ферментами.[29]
Модификации антикодона важны для правильного декодирования мРНК. Поскольку генетический код является вырожденным, для правильного декодирования мРНК необходимы модификации антикодона. В частности, положение колебания антикодона определяет, как кодоны читаются. Например, у эукариот аденозин в положении 34 антикодона может быть преобразован в инозин. Инозин - это модификация, способная образовывать пары оснований с цитозином, аденином и уридином.[30]
Другое обычно модифицированное основание в тРНК - это положение, прилегающее к антикодону. Позиция 37 часто гипермодифицирована громоздкими химическими модификациями. Эти модификации предотвращают сдвиг рамки считывания и повышают стабильность связывания антикодон-кодон за счет взаимодействия стэкинга.[31].
Модификация рибосомной РНК
Модификации рибосомной РНК производятся на протяжении всего синтеза рибосомы. Модификации в первую очередь играют роль в структуре рРНК, чтобы защитить эффективность трансляции.[32].
Типы изменений
Редактирование путем вставки или удаления
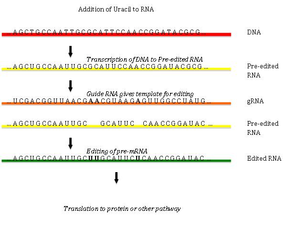
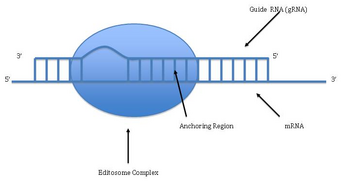
Редактирование РНК путем добавления и удаления урацила было обнаружено в кинетопластах [кинетопласт представляет собой сеть кольцевой ДНК (называемой кДНК) внутри большой митохондрии] из митохондрий Trypanosoma brucei[33]Поскольку это может включать большую часть сайтов в гене, его иногда называют «пан-редактированием», чтобы отличить его от тематического редактирования одного или нескольких сайтов.
Пан-редактирование начинается с пары оснований неотредактированного первичного транскрипта с направляющая РНК (гРНК), которая содержит последовательности, комплементарные участкам вокруг точек вставки / удаления. Вновь образованная двухцепочечная область затем окутана эдитосомой, большим мультибелковым комплексом, который катализирует редактирование.[34][35] Эдитосома открывает транскрипт на первом несовпадающем нуклеотиде и начинает вставку уридинов. Вставленные уридины образуют пару оснований с направляющей РНК, и вставка будет продолжаться, пока A или G присутствуют в направляющей РНК, и остановится при обнаружении C или U.[36][37] Вставленные нуклеотиды вызывают сдвиг рамки, и в результате получается транслируемый белок, который отличается от своего гена.
Механизм Editosome включает в себя эндонуклеолитический разрез в точке несоответствия между направляющей РНК и неотредактированным транскриптом. Следующий шаг катализируется одним из ферментов в комплексе, терминальной U-трансферазой, которая добавляет Us из UTP на 3'-конце мРНК.[38] Открытые концы удерживаются на месте другими белками в комплексе. Другой фермент, U-специфическая экзорибонуклеаза, удаляет неспаренные Us. После того, как редактирование сделало мРНК комплементарной к гРНК, РНК-лигаза присоединяется к концам отредактированного транскрипта мРНК.[39][40] Как следствие, editosome может редактировать только в направлении от 3 'до 5' вдоль первичного транскрипта РНК. Комплекс может действовать одновременно только на одну направляющую РНК. Следовательно, для транскрипта РНК, требующего обширного редактирования, потребуется более одной направляющей РНК и комплекса эдитосом.
Редактирование методом дезаминирования
Редактирование C-to-U

В редактировании участвует цитидиндезаминаза, которая дезаминирует основание цитидина до основания уридина. Пример редактирования C-to-U с аполипопротеин B ген у человека. Апо B100 экспрессируется в печени, а апо B48 экспрессируется в кишечнике. В кишечнике мРНК имеет последовательность CAA, отредактированную как UAA, стоп-кодон, таким образом образуя более короткую форму B48. Редактирование C-to-U часто происходит в митохондриальная РНК цветущих растений. Различные растения имеют разную степень редактирования C-to-U; например, восемь (8) событий редактирования происходят в митохондриях мха. Фунария гигрометрическая, в то время как более 1700 событий редактирования происходят в ликофитах Isoetes engelmanii.[41] Редактирование C-to-U выполняется членами семейства белков пентатрикопептидных повторов (PPR). Покрытосеменные имеют большие семейства PPR, выступающие в качестве транс -факторы для СНГ -элементы, лишенные согласованной последовательности; Arabidopsis насчитывает около 450 представителей семейства PPR. Было сделано несколько открытий белков PPR как в пластидах, так и в митохондриях.[42]
Редактирование от А до Я
Модификации аденозина и инозина (A-to-I) вносят вклад почти в 90% всех событий редактирования в РНК. Дезаминирование аденозина катализируется двухцепочечной РНК-специфической аденозиндезаминазой (АДАР ), который обычно действует на пре-мРНК. Дезаминирование аденозина до инозина разрушает и дестабилизирует спаривание оснований дцРНК, тем самым делая эту конкретную дцРНК менее способной продуцировать миРНК, что мешает РНКи путь.
В спаривание базовых колебаний заставляет дезаминированную РНК иметь уникальную, но другую структуру, что может быть связано с ингибированием стадии инициации трансляции РНК. Исследования показали, что I-РНК (РНК с множеством повторов пары оснований I-U) рекрутирует метилазы, которые участвуют в образовании гетерохроматин и что эта химическая модификация сильно влияет на сайты-мишени miRNA.[43] Ведутся активные исследования важности модификаций A-to-I и их назначения в новой концепции эпитранскриптомика, при котором модификации РНК изменяют их функцию.[44][45] Давно установленное следствие A-to-I в мРНК - это интерпретация I как G, что приводит к функциональной замене A-to-G, например в интерпретации генетического кода рибосомами. Однако более новые исследования ослабили эту корреляцию, показав, что I также могут быть декодированы рибосомой (хотя и в меньшей степени) как A и U. Кроме того, было показано, что I приводит к остановке рибосом на богатой I мРНК.[46]
Развитие высокопроизводительного секвенирования в последние годы позволило разработать обширные базы данных для различных модификаций и редактирования РНК. RADAR (строго аннотированная база данных редактирования РНК A-to-I) была разработана в 2013 году для каталогизации огромного разнообразия сайтов A-to-I и тканеспецифичных уровней, присутствующих у людей, мышей, и мухи. В базу данных постоянно добавляются новые сайты и вносятся общие изменения.[47] Уровень редактирования для конкретных сайтов редактирования, например в транскрипте филамина А тканеспецифичен.[48] Эффективность сплайсинга мРНК является основным фактором, контролирующим уровень редактирования РНК A-to-I.[49][50]
Альтернативное редактирование мРНК
Альтернативное редактирование мРНК U-to-C было впервые описано в транскриптах WT1 (опухоль Вильмса-1),[51] и неклассические изменения мРНК G-A впервые наблюдались в транскриптах HNRNPK (гетерогенный ядерный рибонуклеопротеин K) как в злокачественных, так и в нормальных образцах толстой кишки.[52] Последние изменения также позже наблюдались вместе с неклассическими изменениями U-to-C в клетках мозга. TPH2 (триптофангидроксилаза 2) транскрипты.[53] Хотя обратное аминирование может быть самым простым объяснением изменений U-to-C, механизмы трансаминирования и трансгликозилирования были предложены для событий редактирования U-to-C растений в митохондриальных транскриптах.[54] В недавнем исследовании сообщалось о новых изменениях мРНК G-to-A в транскриптах WT1 в двух горячих точках, предлагая APOBEC3A (фермент редактирования мРНК аполипопротеина B, каталитический полипептид 3A) в качестве фермента, участвующего в этом классе альтернативного редактирования мРНК.[55] Также было показано, что альтернативные изменения мРНК были связаны с каноническим WT1. сращивание варианты с указанием их функциональной значимости.
Редактирование РНК в митохондриях и пластидах растений
В предыдущих исследованиях было показано, что единственные типы редактирования РНК, наблюдаемые в митохондриях и пластидах растений, - это преобразование C в U и U в C (очень редко).[56][57][58][59][60][61][62][63][64][65][66][67][68] Сайты редактирования РНК находятся в основном в кодирующих областях мРНК, интроны, и другие непереведенные регионы.[58] Фактически, редактирование РНК может восстановить функциональность молекул тРНК.[60][61] Сайты редактирования находятся в основном перед митохондриальными или пластидными РНК. Хотя конкретные положения для событий редактирования C to U РНК были достаточно хорошо изучены как в митохондрии, так и в пластиде,[69] идентичность и организация всех белков, составляющих editosome, еще предстоит установить. Было показано, что члены обширного семейства белков PPR действуют как транс-действующие факторы узнавания последовательности РНК.[70] Определенные члены семейства MORF (фактор редактирования множественной органеллярной РНК) также необходимы для правильного редактирования на нескольких сайтах. Поскольку было показано, что некоторые из этих белков MORF взаимодействуют с членами семейства PPR, вполне возможно, что белки MORF являются компонентами комплекса эдитосом.[71] Фермент, ответственный за транс- или дезаминирование транскрипта РНК, остается неуловимым, хотя было высказано предположение, что белки PPR также могут выполнять эту функцию.
Редактирование РНК важно для нормального функционирования трансляции и дыхательной активности растений. Редактирование может восстановить основные последовательности спаривания оснований тРНК, восстанавливая функциональность.[72] Это также было связано с производством РНК-отредактированных белков, которые включаются в полипептидные комплексы дыхательного пути. Следовательно, весьма вероятно, что полипептиды, синтезированные из неотредактированных РНК, не будут функционировать должным образом и будут препятствовать активности как митохондрий, так и пластид.
Редактирование РНК C-to-U может создавать запуск и остановку кодоны, но он не может уничтожить существующие старт- и стоп-кодоны. Загадочный стартовый кодон создается, когда кодон ACG редактируется как AUG.

Редактирование РНК в вирусах
Редактирование РНК в вирусах (т.е. корь, свинка, или парагрипп ) используется для стабильности и создания вариантов белка.[73][74] Вирусные РНК транскрибируются кодируемой вирусом РНК-зависимой РНК-полимераза, который склонен к паузам и «заиканию» при определенных комбинациях нуклеотидов. Кроме того, до нескольких сотен нестандартных А добавляются полимеразой на 3'-конце растущей мРНК.[75] Эти As помогают стабилизировать мРНК. Более того, пауза и заикание РНК-полимеразы позволяет включать один или два G или As перед трансляционным кодоном.[75] Добавление нестандартных нуклеотидов сдвигает рамку считывания, в результате чего образуется другой белок.
Происхождение и эволюция редактирования РНК
Система редактирования РНК, наблюдаемая у животных, возможно, произошла от мононуклеотиддезаминаз, что привело к появлению более крупных семейств генов, включающих гены apobec-1 и adar. Эти гены очень похожи на бактериальные дезаминазы, участвующие в метаболизме нуклеотидов. Аденозиндезаминаза Кишечная палочка не может дезаминировать нуклеозид в РНК; реакционный карман фермента слишком мал для связывания цепи РНК. Однако этот активный сайт расширяется за счет аминокислотных изменений в соответствующих генах-аналогах человека, APOBEC1 и АДАР, позволяющий дезаминировать.[76][77]Пан-редактирование, опосредованное gRNA, в трипаносома митохондрии, включающие шаблонную вставку остатков U, - это совершенно другая биохимическая реакция. В других исследованиях было показано, что участвующие ферменты привлекаются и адаптируются из разных источников.[34][78] Но специфичность встраивания нуклеотидов через взаимодействие между гРНК и мРНК аналогична процессам редактирования тРНК у животных и Акантамеба митохондрии.[79] Эукариотическое метилирование рибозы рРНК молекулами направляющей РНК представляет собой аналогичную форму модификации.[80]
Таким образом, редактирование РНК развивалось не раз. Было предложено несколько адаптивных оснований для редактирования.[81] Редактирование часто описывается как механизм исправления или исправления для компенсации дефектов в последовательностях генов. Однако в случае редактирования, опосредованного gRNA, это объяснение не представляется возможным, потому что, если дефект случается первым, невозможно создать безошибочную область, кодирующую gRNA, которая, предположительно, возникает в результате дублирования области исходного гена. Это мышление приводит к эволюционному предложению, называемому «конструктивная нейтральная эволюция», в котором порядок шагов меняется на противоположный, а «дефекту» предшествует безвозмездная возможность редактирования.[82] 31
Редактирование РНК может участвовать в деградации РНК
В исследовании рассматривалось участие редактирования РНК в деградации РНК.[83] Исследователи специально рассмотрели взаимодействие между ADAR и UPF1, фермент, участвующий в нонсенс-опосредованный распад мРНК путь (NMD). Они обнаружили, что ADAR и UPF1 обнаруживаются в супраслицеосоме и образуют комплекс, который приводит к подавлению регуляции определенных генов. Точный механизм или точные пути, в которых участвуют эти двое, в настоящее время неизвестны. Единственный факт, который показало это исследование, - это то, что они образуют сложные и подавляют определенные гены.
Терапевтическое редактирование мРНК
Направление редактирования для исправления мутировавших последовательностей было впервые предложено и продемонстрировано в 1995 году.[84] В этой первоначальной работе использовались синтетические антисмысловые олигонуклеотиды РНК, комплементарные мутации преждевременного стоп-кодона в последовательности дистрофина, чтобы активировать редактирование стоп-кодона A-to-I для считывания кодона в модельной клеточной системе xenopus.[84] Хотя это также привело к близлежащим непреднамеренным переходам от A к I, переходы от A к I (читаются как G) могут исправить все три стоп-кодона, но не могут создать стоп-кодон. Таким образом, изменения привели к> 25% коррекции целевого стоп-кодона с считыванием нижестоящей репортерной последовательности люциферазы. Следуя работе Розенталя, удалось отредактировать мутированную последовательность мРНК в культуре клеток млекопитающих, направив олигонуклеотид, связанный с цитидиндезаминазой, на исправление мутированной последовательности муковисцидоза.[85] Совсем недавно CRISPR-Cas13, слитый с дезаминазами, был использован для управления редактированием мРНК.[86]
Сравнение с редактированием ДНК
В отличие от редактирования ДНК, которое является постоянным, эффекты редактирования РНК, включая потенциальные нецелевые мутации в РНК - преходящи и не передаются по наследству. Поэтому редактирование РНК считается менее рискованным. Кроме того, может потребоваться только направляющая РНК с использованием белка ADAR, уже обнаруженного в клетках человека и многих других эукариот, вместо того, чтобы вводить чужеродный белок в организм.[87]
использованная литература
- ^ а б c d е Ли С., Мейсон CE (2013). «Основной регуляторный ландшафт модификаций РНК». Ежегодный обзор геномики и генетики человека. 15: 127–50. Дои:10.1146 / annurev-genom-090413-025405. PMID 24898039.
- ^ а б c d Song CX, Yi C, He C (ноябрь 2012 г.). «Картирование недавно идентифицированных вариантов нуклеотидов в геноме и транскриптоме». Природа Биотехнологии. 30 (11): 1107–16. Дои:10.1038 / nbt.2398. ЧВК 3537840. PMID 23138310.
- ^ а б c d Мейер К.Д., Джеффри С.Р. (май 2014 г.). «Динамический эпитранскриптом: N6-метиладенозин и контроль экспрессии генов». Обзоры природы. Молекулярная клеточная биология. 15 (5): 313–26. Дои:10.1038 / nrm3785. ЧВК 4393108. PMID 24713629.
- ^ а б Сунь В. Дж., Ли Дж. Х., Лю С., Ву Дж., Чжоу Х., Цюй Л. Х., Ян Дж. Х. (январь 2016 г.). «RMBase: ресурс для расшифровки ландшафта модификаций РНК из данных высокопроизводительного секвенирования». Исследования нуклеиновых кислот. 44 (D1): D259-65. Дои:10.1093 / нар / gkv1036. ЧВК 4702777. PMID 26464443.
- ^ Су А.А., Рандау Л. (август 2011 г.). «Редактирование A-to-I и C-to-U в транспортной РНК». Биохимия. Биохимия. 76 (8): 932–7. Дои:10.1134 / S0006297911080098. PMID 22022967. S2CID 11283810.
- ^ «У кальмара открыты новые возможности генетического редактирования». Phys.org. Получено 2020-04-05.
- ^ Боккалетто П., Мачницка М.А., Пурта Е., Пятковски П., Багински Б., Вирэки Т.К., де Креси-Лагар В., Росс Р., Лимбах П.А., Коттер А., Хельм М., Буйницки Дж. М. (январь 2018 г.). «MODOMICS: база данных путей модификации РНК. Обновление 2017 г.». Исследования нуклеиновых кислот. 46 (D1): D303 – D307. Дои:10.1093 / нар / gkx1030. ЧВК 5753262. PMID 29106616.
- ^ Бреннике А., Марчфельдер А., Биндер С. (июнь 1999 г.). «Редактирование РНК». Обзор микробиологии FEMS. 23 (3): 297–316. Дои:10.1111 / j.1574-6976.1999.tb00401.x. PMID 10371035.
- ^ «Точное картирование прочтений тРНК»; Энн Хоффманн и др .; Биоинформатика, btx756, https://doi.org/10.1093/bioinformatics/btx756
- ^ Мейер К.Д., Салютор Ю., Зумбо П., Элемент О, Мейсон К.Э., Джаффри С.Р. (июнь 2012 г.). «Всесторонний анализ метилирования мРНК обнаруживает обогащение 3 'UTR и почти стоп-кодонами». Ячейка. 149 (7): 1635–46. Дои:10.1016 / j.cell.2012.05.003. ЧВК 3383396. PMID 22608085.
- ^ Dominissini D, Moshitch-Moshkovitz S, Schwartz S, Salmon-Divon M, Ungar L, Osenberg S, Cesarkas K, Jacob-Hirsch J, Amariglio N, Kupiec M, Sorek R, Rechavi G (апрель 2012 г.). «Топология метиломов РНК m6A человека и мыши, выявленная с помощью m6A-seq». Природа. 485 (7397): 201–6. Bibcode:2012Натура.485..201Д. Дои:10.1038 / природа11112. PMID 22575960. S2CID 3517716.
- ^ Хуссейн С., Саджини А.А., Бланко С., Дитманн С., Ломбард П., Сугимото Ю., Парамор М., Глисон Дж. Г., Одом Д. Т., Уле Дж., Фрай М. (июль 2013 г.). «NSun2-опосредованное цитозин-5 метилирование некодирующей РНК хранилища определяет его процессинг в регуляторные малые РНК». Отчеты по ячейкам. 4 (2): 255–61. Дои:10.1016 / j.celrep.2013.06.029. ЧВК 3730056. PMID 23871666.
- ^ а б Ке С., Алему Э.А., Мертенс К., Гантман Э. К., Фак Дж. Дж., Меле А, Харипал Б., Цукер-Шарфф И., Мур М. Дж., Парк С. Ю., Вогбё CB, Кушньерчик А., Клунгланд А., Дарнелл Дж. Э., Дарнелл Р. Б. (октябрь 2015 г.) . «Большинство остатков m6A находятся в последних экзонах, что делает возможной регуляцию 3 'UTR». Гены и развитие. 29 (19): 2037–53. Дои:10.1101 / gad.269415.115. ЧВК 4604345. PMID 26404942.
- ^ Карлайл TM, Рохас-Дюран М.Ф., Зинштейн Б., Шин Х., Бартоли К.М., Гилберт В.В. (ноябрь 2014 г.). «Псевдоуридиновый профиль выявляет регулируемое псевдоуридилирование мРНК в дрожжевых и человеческих клетках». Природа. 515 (7525): 143–6. Bibcode:2014Натура. 515..143C. Дои:10.1038 / природа13802. ЧВК 4224642. PMID 25192136.
- ^ Schwartz S, Bernstein DA, Mumbach MR, Jovanovic M, Herbst RH, León-Ricardo BX, Engreitz JM, Guttman M, Satija R, Lander ES, Fink G, Regev A (сентябрь 2014 г.). «Транскриптомное картирование показывает широко распространенное динамически регулируемое псевдоуридилирование нкРНК и мРНК». Ячейка. 159 (1): 148–162. Дои:10.1016 / j.cell.2014.08.028. ЧВК 4180118. PMID 25219674.
- ^ Ли X, Чжу П, Ма С., Сон Дж, Бай Дж, Сун Ф, Йи Ц (август 2015 г.). «Химическое раскрытие показывает динамическое псевдоуридилирование транскриптома млекопитающих». Природа Химическая Биология. 11 (8): 592–7. Дои:10.1038 / nchembio.1836. PMID 26075521.
- ^ Khoddami V, Cairns BR (май 2013 г.). «Идентификация прямых мишеней и модифицированных оснований РНК цитозинметилтрансфераз». Природа Биотехнологии. 31 (5): 458–64. Дои:10.1038 / nbt.2566. ЧВК 3791587. PMID 23604283.
- ^ Биркедал Ю., Кристенсен-Далсгаард М., Крог Н., Сабаринатан Р., Городкин Дж., Нильсен Х. (январь 2015 г.). «Профилирование метилирования рибозы в РНК с помощью высокопроизводительного секвенирования». Angewandte Chemie. 54 (2): 451–5. Дои:10.1002 / anie.201408362. PMID 25417815.
- ^ а б Ветцель К., Лимбах, Пенсильвания (январь 2016 г.). «Масс-спектрометрия модифицированных РНК: последние разработки». Аналитик. 141 (1): 16–23. Bibcode:2016Ана ... 141 ... 16Вт. Дои:10.1039 / C5AN01797A. ЧВК 4679475. PMID 26501195.
- ^ Heiss M, Reichle VF, Kellner S (сентябрь 2017 г.). «Наблюдение за судьбой тРНК и ее модификаций с помощью масс-спектрометрии с мечением изотопов нуклеиновых кислот: NAIL-MS». РНК Биология. 14 (9): 1260–1268. Дои:10.1080/15476286.2017.1325063. ЧВК 5699550. PMID 28488916.
- ^ Райхле В.Ф., Вебер В., Келлнер С. (декабрь 2018 г.). «NAIL-MS в E. coli определяет источник и судьбу метилирования тРНК». ChemBioChem. 19 (24): 2575–2583. Дои:10.1002 / cbic.201800525. ЧВК 6582434. PMID 30328661.
- ^ Reichle VF, Kaiser S, Heiss M, Hagelskamp F, Borland K, Kellner S (март 2019 г.). «Превосходя пределы статического анализа модификации РНК с динамическим NAIL-MS». Методы. 156: 91–101. Дои:10.1016 / j.ymeth.2018.10.025. PMID 30395967.
- ^ Ван Х, Лу З., Гомес А., Хон ГК, Юэ И, Хан Д, Фу И, Паризиэн М, Дай Кью, Цзя Джи, Рен Би, Пан Т, Хе Си (январь 2014 г.). «N6-метиладенозин-зависимая регуляция стабильности информационной РНК». Природа. 505 (7481): 117–20. Bibcode:2014Натура.505..117Вт. Дои:10.1038 / природа12730. ЧВК 3877715. PMID 24284625.
- ^ Геула С., Мошич-Мошковиц С., Доминиссини Д., Мансур А. А., Кол Н., Лосось-Дивон М., Хершковиц В., Пер Э, Мор Н., Поместье Ю. С., Бен-Хаим М. С., Эял Е., Юнгер С., Пинто Ю., Джайтин Д. А. , Виуков С., Раис Й., Крупальник В., Хомский Е., Зербиб М., Маза I, Речави Ю., Массарва Р., Ханна С., Амит И., Леванон Е. Ю., Амариглио Н., Стерн-Джиноссар Н., Новерштерн Н., Рехави Г., Ханна Дж. Х. (Февраль 2015 г.). «Стволовые клетки. Метилирование мРНК m6A способствует разрешению наивной плюрипотентности к дифференцировке». Наука. 347 (6225): 1002–6. Дои:10.1126 / science.1261417. PMID 25569111. S2CID 206562941.
- ^ Кариджолич Дж, Ю. Ю. Т. (июнь 2011 г.). «Преобразование бессмысленных кодонов в смысловые кодоны с помощью целевого псевдоуридилирования». Природа. 474 (7351): 395–8. Дои:10.1038 / природа10165. ЧВК 3381908. PMID 21677757.
- ^ Быховская Ю., Касас К., Менгеша Е., Инбал А., Фишель-Годсиан Н. (июнь 2004 г.). «Миссенс-мутация псевдоуридинсинтазы 1 (PUS1) вызывает митохондриальную миопатию и сидеробластную анемию (MLASA)». Американский журнал генетики человека. 74 (6): 1303–8. Дои:10.1086/421530. ЧВК 1182096. PMID 15108122.
- ^ Heiss NS, Knight SW, Vulliamy TJ, Klauck SM, Wiemann S, Mason PJ, Poustka A, Dokal I (май 1998 г.). «Х-сцепленный врожденный дискератоз вызывается мутациями в высококонсервативном гене с предполагаемыми ядрышковыми функциями». Природа Генетика. 19 (1): 32–8. Дои:10.1038 / ng0598-32. PMID 9590285. S2CID 205342127.
- ^ Кирхнер С., Игнатова З. (февраль 2015 г.). «Новые роли тРНК в адаптивной трансляции, сигнальной динамике и болезни». Обзоры природы. Генетика. 16 (2): 98–112. Дои:10.1038 / nrg3861. PMID 25534324. S2CID 6727707.
- ^ Lorenz C, Lünse CE, Mörl M (апрель 2017 г.). «Модификации тРНК: влияние на структуру и термическую адаптацию». Биомолекулы. 7 (2): 35. Дои:10.3390 / biom7020035. ЧВК 5485724. PMID 28375166.
- ^ Agris PF, Vendeix FA, Graham WD (февраль 2007 г.). «Раскачивание тРНК генома: 40 лет модификации». Журнал молекулярной биологии. 366 (1): 1–13. Дои:10.1016 / j.jmb.2006.11.046. PMID 17187822.
- ^ Agris PF, Vendeix FA, Graham WD (февраль 2007 г.). «Раскачивание тРНК генома: 40 лет модификации». Журнал молекулярной биологии. 366 (1): 1–13. Дои:10.1016 / j.jmb.2006.11.046. PMID 17187822.
- ^ Sloan KE, Warda AS, Sharma S, Entian KD, Lafontaine DL, Bohnsack MT (сентябрь 2017 г.). «Настройка рибосомы: влияние модификации рРНК на биогенез и функцию эукариотических рибосом». РНК Биология. 14 (9): 1138–1152. Дои:10.1080/15476286.2016.1259781. ЧВК 5699541. PMID 27911188.
- ^ Бенн Р. (апрель 1994 г.). «Редактирование РНК в трипаносомах». Европейский журнал биохимии. 221 (1): 9–23. Дои:10.1111 / j.1432-1033.1994.tb18710.x. PMID 7513284.
- ^ а б Arts GJ, Benne R (июнь 1996 г.). «Механизм и эволюция редактирования РНК в кинетопластидах». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1307 (1): 39–54. Дои:10.1016/0167-4781(96)00021-8. PMID 8652667.
- ^ Альфонсо Дж. Д., Тиманн О., Симпсон Л. (октябрь 1997 г.). «Механизм редактирования вставки / делеции РНК U в кинетопластидных митохондриях». Исследования нуклеиновых кислот. 25 (19): 3751–9. Дои:10.1093 / nar / 25.19.3751. ЧВК 146959. PMID 9380494.
- ^ Блюм Б., Бакалара Н., Симпсон Л. (январь 1990 г.). «Модель редактирования РНК в митохондриях кинетопластид:« руководство », молекулы РНК, транскрибированные из ДНК максицикла, предоставляют отредактированную информацию». Ячейка. 60 (2): 189–98. Дои:10.1016 / 0092-8674 (90) 90735-В. PMID 1688737. S2CID 19656609.
- ^ Kable ML, Heidmann S, Stuart KD (май 1997 г.). «Редактирование РНК: попадание U в РНК». Тенденции в биохимических науках. 22 (5): 162–6. Дои:10.1016 / S0968-0004 (97) 01041-4. PMID 9175474.
- ^ Симпсон Л., Тиманн, Огайо (июнь 1995 г.).«Смысл из ерунды: редактирование РНК в митохондриях кинетопластидных простейших и слизистых плесени». Ячейка. 81 (6): 837–40. Дои:10.1016/0092-8674(95)90003-9. PMID 7781060. S2CID 4634304.
- ^ Стюарт К. (февраль 1991 г.). «Редактирование РНК в митохондриальной мРНК трипаносоматид». Тенденции в биохимических науках. 16 (2): 68–72. Дои:10.1016 / 0968-0004 (91) 90027-С. PMID 1713359.
- ^ Хайдук С.Л., Сабатини Р.С. (1998). «Редактирование митохондриальной мРНК в кинетопластидных простейших». В Grosjean H, Benne R (ред.). Модификация и редактирование РНК. Вашингтон, округ Колумбия: ASM Press. С. 377–394.
- ^ Такенака М., Вербицкий Д., Зехрманн А., Хертель Б., Байер-Часар Е., Гласс Ф., Бреннике А. (ноябрь 2014 г.). «Редактирование РНК в митохондриях растений - соединение последовательностей-мишеней РНК и действующих белков». Митохондрия. Посадите митохондрии в митохондрии. 19 Pt B: 191–7. Дои:10.1016 / j.mito.2014.04.005. PMID 24732437.
- ^ Шиканай Т. (сентябрь 2015 г.). «Редактирование РНК в растениях: техника и гибкость распознавания сайтов». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. SI: Биогенез хлоропластов. 1847 (9): 779–85. Дои:10.1016 / j.bbabio.2014.12.010. PMID 25585161.
- ^ Нисикура К (2010). «Функции и регуляция редактирования РНК дезаминазами ADAR». Ежегодный обзор биохимии. 79 (1): 321–49. Дои:10.1146 / annurev-biochem-060208-105251. ЧВК 2953425. PMID 20192758.
- ^ Таджаддод М., Янч М.Ф., Лихт К. (март 2016 г.). «Динамический эпитранскриптом: редактирование от A до I модулирует генетическую информацию». Хромосома. 125 (1): 51–63. Дои:10.1007 / s00412-015-0526-9. ЧВК 4761006. PMID 26148686.
- ^ Лихт К., Янч М.Ф. (апрель 2016 г.). «Быстрая и динамическая регуляция транскриптома путем редактирования РНК и модификаций РНК». Журнал клеточной биологии. 213 (1): 15–22. Дои:10.1083 / jcb.201511041. ЧВК 4828693. PMID 27044895.
- ^ Licht K, et al. (2019). «Инозин вызывает контекстно-зависимое перекодирование и остановку перевода». Исследования нуклеиновых кислот. 47 (1): 3–14. Дои:10.1093 / нар / gky1163. ЧВК 6326813. PMID 30462291.
- ^ Рамасвами Дж., Ли Дж. Б. (январь 2014 г.). "RADAR: тщательно аннотированная база данных редактирования РНК A-to-I". Исследования нуклеиновых кислот. 42 (Выпуск базы данных): D109–13. Дои:10.1093 / nar / gkt996. ЧВК 3965033. PMID 24163250.
- ^ Стулич М., Янч М.Ф. (октябрь 2013 г.). «Пространственно-временное профилирование редактирования РНК филамина А выявляет предпочтения ADAR и высокие уровни редактирования вне нервных тканей». РНК Биология. 10 (10): 1611–7. Дои:10.4161 / rna.26216. ЧВК 3866242. PMID 24025532.
- ^ Лихт К., Капур У., Майрхофер Э., Янч М.Ф. (июль 2016 г.). «Частота редактирования аденозина в инозин контролируется эффективностью сращивания». Исследования нуклеиновых кислот. 44 (13): 6398–408. Дои:10.1093 / нар / gkw325. ЧВК 5291252. PMID 27112566.
- ^ Licht K, Kapoor U, Amman F, Picardi E, Martin D, Bajad P, Jantsch MF (сентябрь 2019 г.). «Карта редактирования A-to-I с высоким разрешением с помощью мыши определяет события редактирования, контролируемые сплайсингом пре-мРНК». Геномные исследования. 29 (9): 1453–1463. Дои:10.1101 / гр.242636.118. ЧВК 6724681. PMID 31427386.
- ^ Sharma PM, Bowman M, Madden SL, Rauscher FJ, Sukumar S (март 1994). "Редактирование РНК в гене предрасположенности к опухоли Вильмса, WT1". Гены и развитие. 8 (6): 720–31. Дои:10.1101 / gad.8.6.720. PMID 7926762.
- ^ Klimek-Tomczak K, Mikula M, Dzwonek A, Paziewska A, Karczmarski J, Hennig E, Bujnicki JM, Bragoszewski P, Denisenko O, Bomsztyk K, Ostrowski J (февраль 2006 г.). «Редактирование мРНК белка hnRNP K при колоректальной аденокарциноме и окружающей слизистой оболочке». Британский журнал рака. 94 (4): 586–92. Дои:10.1038 / sj.bjc.6602938. ЧВК 2361188. PMID 16404425.
- ^ Громанн М., Хаммер П., Вальтер М., Паульманн Н., Бюттнер А., Эйзенменгер В., Багхай Т.К., Шюле С., Руппрехт Р., Бадер М., Бонди Б., Зилл П., Приллер Дж., Вальтер Д.Д. (январь 2010 г.). «Альтернативный сплайсинг и обширное редактирование РНК транскриптов человеческого TPH2». PLOS ONE. 5 (1): e8956. Bibcode:2010PLoSO ... 5,8956G. Дои:10.1371 / journal.pone.0008956. ЧВК 2813293. PMID 20126463.
- ^ Кастандет Б., Арайя А. (август 2011 г.). «Редактирование РНК в органеллах растений. Почему это сделать проще?». Биохимия. Биохимия. 76 (8): 924–31. Дои:10.1134 / S0006297911080086. PMID 22022966. S2CID 2174535.
- ^ Ниаварани А., Карри Е., Рейал И., Анжос-Афонсо Ф, Хорсвелл С., Гриссинджер Е., Луис Сардина Дж, Боннет Д. (2015). «APOBEC3A участвует в новом классе редактирования мРНК G-to-A в транскриптах WT1». PLOS ONE. 10 (3): e0120089. Bibcode:2015PLoSO..1020089N. Дои:10.1371 / journal.pone.0120089. ЧВК 4373805. PMID 25807502.
- ^ Ковелло П.С., Грей М.В. (октябрь 1989 г.). «Редактирование РНК в митохондриях растений». Природа. 341 (6243): 662–6. Bibcode:1989Натура.341..662С. Дои:10.1038 / 341662a0. PMID 2552326. S2CID 4373041.
- ^ Гуальберто Дж. М., Ламаттина Л., Боннар Дж., Вейл Дж. Х., Гриненбергер Дж. М. (октябрь 1989 г.). «Редактирование РНК в митохондриях пшеницы приводит к сохранению белковых последовательностей». Природа. 341 (6243): 660–2. Bibcode:1989Натура.341..660Г. Дои:10.1038 / 341660a0. PMID 2552325. S2CID 19402913.
- ^ а б Хизель Р., Виссинджер Б., Шустер В., Бреннике А. (декабрь 1989 г.). «Редактирование РНК в митохондриях растений». Наука. 246 (4937): 1632–4. Bibcode:1989Sci ... 246.1632H. Дои:10.1126 / science.2480644. PMID 2480644.
- ^ Hoch B, Maier RM, Appel K, Igloi GL, Kössel H (сентябрь 1991 г.). «Редактирование мРНК хлоропласта путем создания инициирующего кодона». Природа. 353 (6340): 178–80. Bibcode:1991Натура.353..178H. Дои:10.1038 / 353178a0. PMID 1653905. S2CID 4303733.
- ^ а б Принг Д., Бреннике А., Шустер В. (март 1993 г.). «Редактирование РНК придает новое значение генетической информации в митохондриях и хлоропластах». Молекулярная биология растений. 21 (6): 1163–70. Дои:10.1007 / BF00023611. PMID 8490134. S2CID 30396182.
- ^ а б Виссинджер Б., Бреннике А., Шустер В. (сентябрь 1992 г.). «Возрождение здравого смысла: редактирование РНК и транс-сплайсинг в митохондриях растений». Тенденции в генетике. 8 (9): 322–8. Дои:10.1016/0168-9525(92)90265-6. PMID 1365399.
- ^ Grienenberger, J.M. (1993). «Редактирование РНК в органеллах растений». Редактирование РНК (Бенн Р., Ред.), Эллис Харвуд, Нью-Йорк.
- ^ Малек О., Леттиг К., Хизель Р., Бреннике А., Кнуп В. (март 1996 г.). «Редактирование РНК у мохообразных и молекулярная филогения наземных растений». Журнал EMBO. 15 (6): 1403–11. Дои:10.1002 / j.1460-2075.1996.tb00482.x. ЧВК 450045. PMID 8635473.
- ^ Freyer R, Kiefer-Meyer MC, Kössel H (июнь 1997 г.). «Возникновение редактирования пластидной РНК во всех основных линиях наземных растений». Труды Национальной академии наук Соединенных Штатов Америки. 94 (12): 6285–90. Bibcode:1997PNAS ... 94.6285F. Дои:10.1073 / пнас.94.12.6285. ЧВК 21041. PMID 9177209.
- ^ Дитрих А., Смолл I, Коссет А., Вейль Дж. Х., Марешаль-Друар Л. (1996). «Редактирование и импорт: стратегии обеспечения митохондрий растений полным набором функциональных РНК переноса». Биохимия. 78 (6): 518–29. Дои:10.1016/0300-9084(96)84758-4. PMID 8915541.
- ^ Бок Р., Герман М., Фукс М. (октябрь 1997 г.). «Идентификация критических положений нуклеотидов для распознавания сайта редактирования пластидной РНК». РНК. 3 (10): 1194–200. ЧВК 1369561. PMID 9326494.
- ^ Серый М.В., Ковелло П.С. (январь 1993 г.). «Редактирование РНК в митохондриях и хлоропластах растений». Журнал FASEB. 7 (1): 64–71. Дои:10.1096 / fasebj.7.1.8422976. PMID 8422976.
- ^ Марчфельдер А., Биндер С., Бреннике А., Кнуп В. (1998). "Предисловие". В Grosjean H, Benne R (ред.). Модификация и редактирование РНК. Вашингтон, округ Колумбия: ASM Press. С. 307–323.
- ^ Такенака М., Зехрманн А., Вербицкий Д., Хертель Б., Бреннике А. (2013). «Редактирование РНК в растениях и его эволюция». Ежегодный обзор генетики. 47: 335–52. Дои:10.1146 / annurev-genet-111212-133519. PMID 24274753.
- ^ Баркан А., Малый I (2014). «Пентатрикопептидные повторяющиеся белки в растениях». Ежегодный обзор биологии растений. 65: 415–42. Дои:10.1146 / annurev-arplant-050213-040159. PMID 24471833.
- ^ Bentolila S, Oh J, Hanson MR, Bukowski R (июнь 2013 г.). «Комплексный анализ с высоким разрешением роли семейства генов Arabidopsis в редактировании РНК». PLOS Genetics. 9 (6): e1003584. Дои:10.1371 / journal.pgen.1003584. ЧВК 3688494. PMID 23818871.
- ^ Цена ЦТ, Серый МВт (1998). «Редактирование тРНК». В Grosjean H, Benne R (ред.). Модификация и редактирование РНК. Вашингтон, округ Колумбия: ASM Press. С. 289–306.
- ^ Курран Дж., Бок Р., Колакофски Д. (октябрь 1991 г.). «Ген P вируса Сендай экспрессирует как важный белок, так и ингибитор синтеза РНК путем перетасовки модулей посредством редактирования мРНК». Журнал EMBO. 10 (10): 3079–85. Дои:10.1002 / j.1460-2075.1991.tb07860.x. ЧВК 453024. PMID 1655410.
- ^ Чжэн Х., Фу ТБ, Лазински Д., Тейлор Дж. (Август 1992 г.). «Редактирование геномной РНК вируса гепатита дельта человека». Журнал вирусологии. 66 (8): 4693–7. Дои:10.1128 / jvi.66.8.4693-4697.1992. ЧВК 241294. PMID 1629949.
- ^ а б Колаковский Д., Хаусманн С. (1998). «Глава 23: Редактирование мРНК котранскрипционного парамиксовируса: противоречие в терминах?». В Grosjean H, Benne R (ред.). Модификация и редактирование РНК. Вашингтон, округ Колумбия: ASM Press. С. 413–420.
- ^ Картер Ч.В. (1998). «Нуклеозид дезаминазы цитидина и аденозина: сравнение с дезаминазами, действующими на РНК». В Grosjean H, Benne R (ред.). Модификация и редактирование РНК. Вашингтон, округ Колумбия: ASM Press. С. 363–376.
- ^ Covello PS, Gray MW (август 1993 г.). «Об эволюции редактирования РНК». Тенденции в генетике. 9 (8): 265–8. Дои:10.1016/0168-9525(93)90011-6. PMID 8379005.
- ^ Лонерган К.М., Серый М.В. (сентябрь 1993 г.). «Прогнозируемое редактирование дополнительных РНК переноса в митохондриях Acanthamoeba castellanii». Исследования нуклеиновых кислот. 21 (18): 4402. Дои:10.1093 / nar / 21.18.4402. ЧВК 310088. PMID 8415006.
- ^ Bachellerie JP, Cavaille J (1998). «Малые ядрышковые РНК направляют метилирование рибозы эукариотических рРНК». В Grosjean H, Benne R (ред.). Модификация и редактирование РНК. Вашингтон, округ Колумбия: ASM Press. С. 255–272.
- ^ Speijer D (май 2011 г.). «Играет ли конструктивная нейтральная эволюция важную роль в возникновении клеточной сложности? Понимание происхождения и использования биологической сложности». BioEssays. 33 (5): 344–9. Дои:10.1002 / bies.201100010. PMID 21381061.
- ^ Штольцфус А (август 1999 г.). «О возможности конструктивной нейтральной эволюции». Журнал молекулярной эволюции. 49 (2): 169–81. Bibcode:1999JMolE..49..169S. CiteSeerX 10.1.1.466.5042. Дои:10.1007 / PL00006540. PMID 10441669. S2CID 1743092.
- ^ Агранат Л., Райцкин О., Сперлинг Дж., Сперлинг Р. (апрель 2008 г.). «Редактирующий фермент ADAR1 и белок наблюдения за мРНК hUpf1 взаимодействуют в ядре клетки». Труды Национальной академии наук Соединенных Штатов Америки. 105 (13): 5028–33. Bibcode:2008PNAS..105.5028A. Дои:10.1073 / pnas.0710576105. ЧВК 2278206. PMID 18362360.
- ^ а б Woolf TM, Chase JM, Stinchcomb DT (август 1995 г.). «К терапевтическому редактированию мутированных последовательностей РНК». Труды Национальной академии наук Соединенных Штатов Америки. 92 (18): 8298–302. Bibcode:1995PNAS ... 92,8298 Вт. Дои:10.1073 / пнас.92.18.8298. ЧВК 41144. PMID 7545300.
- ^ Монтьель-Гонсалес М.Ф., Валлесилло-Вьехо I, Юдовски Г.А., Розенталь Дж.Дж. (ноябрь 2013 г.). «Коррекция мутаций в регуляторе трансмембранной проводимости муковисцидоза путем сайт-направленного редактирования РНК». Труды Национальной академии наук Соединенных Штатов Америки. 110 (45): 18285–90. Bibcode:2013ПНАС..11018285М. Дои:10.1073 / пнас.1306243110. ЧВК 3831439. PMID 24108353.
- ^ Cox DB, Gootenberg JS, Abudayyeh OO, Franklin B, Kellner MJ, Joung J, Zhang F (ноябрь 2017 г.). «Редактирование РНК с помощью CRISPR-Cas13». Наука. 358 (6366): 1019–1027. Bibcode:2017Научный ... 358.1019C. Дои:10.1126 / science.aaq0180. ЧВК 5793859. PMID 29070703.
- ^ «Осторожно, CRISPR. Гонка за редактирование РНК продолжается». Новости химии и машиностроения. Получено 30 сентября 2020.
