Малая ядрышковая РНК - Small nucleolar RNA
Малые ядрышковые РНК (snoRNAs) являются классом малых РНК молекулы, которые в первую очередь направляют химические модификации других РНК, в основном рибосомные РНК, переносить РНК и малые ядерные РНК. Существует два основных класса snoRNA, c / D box snoRNA, которые связаны с метилирование и snoRNA бокса H / ACA, которые связаны с псевдоуридилирование.SnoRNA обычно называют направляющими РНК, но их не следует путать с направляющие РНК это прямое Редактирование РНК в трипаносомы.
модификации, управляемые snoRNA
После транскрипция возникающие молекулы рРНК (называемые пре-рРНК) подвергаются ряду этапов процессинга с образованием зрелой молекулы рРНК. Перед расщеплением экзо- и эндонуклеазами пре-рРНК претерпевает сложный паттерн нуклеозидных модификаций. К ним относятся метилирование и псевдоуридилирование, управляемое мяноРНК.
- Метилирование - это присоединение или замещение метильная группа на различные субстраты. РРНК человека содержит примерно 115 модификаций метильных групп. Большинство из них 2'O-рибоза-метилирования (где метильная группа присоединена к группе рибозы).[1]
- Псевдоуридилирование - это превращение (изомеризация ) из нуклеозид уридин в другую изомерную форму псевдоуридин (Ψ). Эта модификация состоит из поворота на 180 ° основания уридина вокруг его гликозильной связи с рибозой остова РНК. После этого вращения азотистое основание добавляет атом углерода к гликозильной связи вместо обычного атома азота. Благоприятным аспектом этой модификации является дополнительный донор водородных связей, доступный на основе. В то время как уридин образует две водородные связи со своей парой оснований Уотсона-Крика, аденином, псевдоуридин способен образовывать три водородные связи. Когда псевдоуридин спарен с аденином, он также может образовывать еще одну водородную связь, что позволяет сформировать сложную структуру зрелой рРНК. Свободный донор водородной связи часто образует связь с основанием, удаленным от него самого, создавая третичную структуру, которая должна быть функциональной для рРНК. Зрелые человеческие рРНК содержат примерно 95 модификаций.[1]
Каждая молекула мяРНК действует как проводник только для одной (или двух) индивидуальных модификаций РНК-мишени.[2] Чтобы осуществить модификацию, каждая мяРНК связывается по меньшей мере с четырьмя коровыми белками в комплексе РНК / белок, называемом небольшой ядрышковой рибонуклеопротеидной частицей (snoRNP).[3] Белки, связанные с каждой РНК, зависят от типа молекулы snoRNA (см. Руководства по семействам snoRNA ниже). Молекула мяРНК содержит антисмысловой элемент (отрезок 10–20 нуклеотиды ), которые являются базовыми дополнительными к последовательности, окружающей основание (нуклеотид ), предназначенные для модификации в молекуле пре-РНК. Это позволяет snoRNP распознавать РНК-мишень и связываться с ней. После связывания snoRNP с сайтом-мишенью связанные белки находятся в правильном физическом месте для катализировать химическая модификация целевой базы.[4]
семейства направляющих snoRNA
Два разных типа модификации рРНК (метилирование и псевдоуридилирование) управляются двумя разными семействами мяРНК. Эти семейства snoRNA называются антисмысловыми C / D box и H / ACA box snoRNA на основании присутствия консервативных мотивов последовательности в snoRNA. Есть исключения, но, как правило, члены коробки C / D руководят метилированием, а члены H / ACA руководят псевдоуридилированием. Члены каждой семьи могут различаться по биогенезу, структуре и функциям, но каждая семья классифицируется по следующим обобщенным характеристикам. Подробнее см. Обзор.[5]SnoRNA классифицируются как малые ядерные РНК в MeSH. В HGNC, в сотрудничестве с snoRNABase и эксперты в этой области одобрили уникальные имена для генов человека, кодирующих snoRNA.[6]
C / D коробка
C / D box snoRNAs содержат два коротких консервативных мотива последовательности, C (RUGAUGA) и D (CUGA), расположенные рядом с 5′ и 3′ концы мяРНК соответственно. Короткие участки (~ 5 нуклеотидов) расположены вверх по течению коробки C и вниз по течению D-бокса обычно дополняют основу и образуют структуру «ствол-коробка», которая сближает мотивы C- и D-боксов. Эта структура стволовых коробок, как было показано, важна для правильного синтеза snoRNA и локализации ядрышка.[7] Многие C / D-бокс-snoRNA также содержат дополнительную менее хорошо консервативную копию мотивов C и D (обозначаемых как C 'и D'), расположенную в центральной части молекулы snoRNA. Консервативная область длиной 10–21 нуклеотидов выше D-бокса комплементарна сайту метилирования целевой РНК и позволяет snoRNA образовывать дуплекс РНК с РНК.[8] Нуклеотид, который должен быть модифицирован в целевой РНК, обычно располагается в 5-м положении выше D-бокса (или D '-бокса).[9][10] C / D-бокс snoRNA связывается с четырьмя эволюционно консервативными и незаменимыми белками:фибрилларин (Nop1p), NOP56, NOP58, и Snu13 (белок 15,5 кДа у эукариот; его архейный гомолог - L7Ae), которые составляют сердцевину C / D-бокса snoRNP.[5]
Существует эукариотическая C / D-бокс snoRNA (snoRNA U3 ), что не было показано для руководства 2'-ОВместо этого он участвует в процессинге рРНК, управляя расщеплением пре-рРНК.
Коробка H / ACA
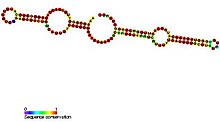
H / ACA box snoRNAs имеют общие вторичная структура состоящий из двух заколки для волос и две одноцепочечные области, названные структурой шпилька-шарнир-шпилька-хвост.[5] H / ACA snoRNA также содержат консервативные мотивы последовательности, известные как H-бокс (консенсусная ANANNA) и ACA-бокс (ACA). Оба мотива обычно располагаются в одноцепочечных областях вторичной структуры. Мотив H расположен в шарнире, а мотив ACA расположен в области хвоста; 3 нуклеотида с 3'-конца последовательности.[11] Области шпильки содержат внутренние выпуклости, известные как петли распознавания, в которых расположены антисмысловые направляющие последовательности (основания, комплементарные целевой последовательности). Эти направляющие последовательности по существу отмечают расположение уридина на целевой рРНК, которая будет модифицирована. Эта последовательность распознавания является двудольной (построена из двух разных плеч области петли) и образует сложные псевдоузлы с целевой РНК. H / ACA box snoRNAs связаны с четырьмя эволюционно консервативными и незаменимыми белками:дискерин (Cbf5p), GAR1, NHP2, и NOP10 - которые составляют ядро snoRNP H / ACA box.[5] Дискерин, вероятно, является каталитическим компонентом комплекса рибонуклеопротеидов (РНП), поскольку он обладает несколькими консервативными последовательностями псевдоуридинсинтазы и тесно связан с псевдоуридинсинтазой, которая модифицирует уридин в тРНК. В низших эукариотических клетках, таких как трипаносомы, подобные РНК существуют в форме одиночной шпилечной структуры и бокса AGA вместо бокса ACA на 3'-конце РНК.[12] Подобно трипаносомам, Entamoeba histolytica имеет смешанную популяцию одиночных шпилечных и двойных шпилек H / ACA box snoRNA. Сообщалось, что произошел процессинг snoRNA H / ACA-бокса с двойной шпилькой в snoRNA с одной шпилькой, однако, в отличие от трипаносом, он имеет регулярный мотив ACA на 3'-хвосте.[19]
Компонент РНК человека теломераза (hTERC) содержит домен H / ACA для образования пре-РНП и ядрышковой локализации самой теломеразной РНП.[13] H / ACA snoRNP участвует в редком генетическом заболевании. врожденный дискератоз (DKC) из-за его принадлежности к теломеразе человека. Мутации белкового компонента snoRNP H / ACA приводят к снижению физиологических уровней TERC. Это сильно коррелировало с патологией, лежащей в основе DKC, которая, по-видимому, в первую очередь является болезнью бедных теломер поддержание.
Композитный блок H / ACA и C / D
Необычная направляющая snoRNA U85, которая участвует как в метилировании 2'-O-рибозы, так и в псевдоуридилировании малая ядерная РНК (мяРНК) U5 был идентифицирован.[14] Эта составная snoRNA содержит оба C / D- и H / ACA-бокса домены и ассоциирует с белками, специфичными для каждого класса snoRNA (fibrillarin и Gar1p, соответственно). К настоящему времени охарактеризованы более сложные snoRNAs.[15]
Было обнаружено, что эти составные snoRNA накапливаются в субядерной органелле, называемой Тело Кахала и называются малые РНК, специфичные для тельца Кахаля. Это контрастирует с большинством мяРНК C / D-бокса или H / ACA-бокса, которые локализуются в ядрышке. Предполагается, что эти специфичные для тельца Кахаля РНК участвуют в модификации транскрибируемых РНК-полимеразой II сплайсосомных РНК U1, U2, U4, U5 и U12.[15] Не все snoRNAs, которые были локализованы в тельцах Кахаля, представляют собой составные c / D- и H / ACA box snoRNAs.
Орфанные snoRNA
Мишени для вновь идентифицированных snoRNAs предсказываются на основе комплементарности последовательностей между предполагаемыми целевыми РНК и антисмысловыми элементами или петлями узнавания в последовательности snoRNA. Однако растет число «сиротских» гидов без каких-либо известных РНК-мишеней, что предполагает, что в рРНК может быть больше белков или транскриптов, чем раньше, и / или что некоторые мяРНК выполняют другие функции, не относящиеся к рРНК.[16][17] Есть доказательства, что некоторые из этих орфанных snoRNAs регулируют транскрипты с альтернативным сплайсингом.[18] Например, кажется, что мяРНК C / D-бокса SNORD115 регулирует альтернативное соединение рецептор серотонина 2C мРНК через консервативную область комплементарности.[19][20]Другой C / D-бокс snoRNA, SNORD116, который находится в том же кластере, что и SNORD115, как было предсказано, имеет 23 возможных мишени в генах, кодирующих белок, с использованием биоинформатический подход. Из них было обнаружено, что большая фракция подвергается альтернативному сплайсингу, что указывает на роль SNORD116 в регуляции альтернативного сплайсинга.[21]
Целевые модификации
Точный эффект модификаций метилирования и псевдоуридилирования на функцию зрелых РНК пока не известен. Модификации не кажутся существенными, но известно, что они слегка усиливают укладку РНК и взаимодействие с рибосомными белками. В подтверждение их важности модификации сайта-мишени локализуются исключительно в консервативных и функционально важных доменах зрелой РНК и обычно консервативны среди далеких эукариот.[5]
- 2'-O-метилированная рибоза вызывает усиление конформации 3'-эндо
- Псевдоуридин (psi /) добавляет еще один вариант для водородной связи.
- Сильно метилированная РНК защищена от гидролиза. рРНК действует как рибозим, катализируя собственный гидролиз и сплайсинг.
Геномная организация
SnoRNA расположены в геноме по-разному. Большинство генов snoRNA позвоночных кодируется в интроны генов, кодирующих белки, участвующие в синтезе или трансляции рибосом, и синтезируются РНК-полимераза II. Также показано, что SnoRNA расположены в межгенных областях, ORF генов, кодирующих белок, и UTR.[22] SnoRNA также могут транскрибироваться со своих собственных промоторов с помощью РНК-полимеразы II или III.
Отпечатанные локусы
В геноме человека есть по крайней мере два примера, где C / D box snoRNAs обнаруживаются в тандемных повторах внутри отпечатанный места. Эти два локуса (14q32 на хромосоме 14 и 15q11q13 на хромосоме 15) были тщательно охарактеризованы, и в обоих регионах были обнаружены множественные snoRNAs, расположенные внутри интронов в кластерах близкородственных копий.
В 15q11q13 идентифицировано пять различных snoRNA (SNORD64, SNORD107, SNORD108, SNORD109 (в двух экземплярах), SNORD116 (29 копий) и SNORD115 (48 экз.). Утрата 29 копий SNORD116 (HBII-85) из этого региона была идентифицирована как причина Синдром Прадера-Вилли[23][24][25][26] тогда как получение дополнительных копий SNORD115 было связано с аутизм.[27][28][29]
Область 14q32 содержит повторы двух мяРНК SNORD113 (9 копий) и SNORD114 (31 копия) в интронах тканеспецифичного транскрипта нкРНК (MEG8 ). Было показано, что домен 14q32 имеет общие геномные особенности с импринтированными локусами 15q11-q13 и предположена возможная роль тандемных повторов C / D box snoRNAs в эволюции или механизме импринтированных локусов.[30][31]
Прочие функции
snoRNA могут функционировать как миРНК. Было показано, что человек ACA45 это добросовестный snoRNA, которая может быть преобразована в 21-нуклеотиды -длинная зрелая миРНК Эндорибонуклеаза семейства РНКазы III dicer.[32] Этот продукт snoRNA ранее был идентифицирован как mmu-miR-1839 и было показано, что он процессируется независимо от других генерирующих miRNA эндорибонуклеаза Дроша.[33] Биоинформатический Анализы показали, что предположительно происходящие от snoRNA, miRNA-подобные фрагменты встречаются в разных организмах.[34]
Недавно было обнаружено, что мяРНК могут иметь функции, не связанные с рРНК. Одна из таких функций - регулирование альтернативное сращивание из транс транскрипт гена, который осуществляется snoRNA HBII-52, который также известен как SNORD115.[19]
В ноябре 2012 года Schubert et al. выявили, что специфические РНК контролируют уплотнение хроматина и доступность в Дрозофила клетки.[35]
Рекомендации
- ^ а б Маден Б. Е., Хьюз Дж. М. (июнь 1997 г.). «Эукариотические рибосомные РНК: недавний ажиотаж в проблеме модификации нуклеотидов». Хромосома. 105 (7–8): 391–400. Дои:10.1007 / BF02510475. PMID 9211966. S2CID 846233.
- ^ Гьерде, Дуглас Т. (2009). Очистка и анализ РНК: подготовка проб, экстракция, хроматография.. Вайнхайм: Wiley-VCH. С. 25–26. ISBN 978-3-527-62720-2. Получено 28 сентября 2020.
- ^ Бертран, Эдуард; Фурнье, Мориль Ж. (2013). «SnoRNPs и родственные машины: древние устройства, которые опосредуют созревание рРНК и других РНК». Landes Bioscience. Получено 28 сентября 2020.
- ^ Ликке-Андерсен, Сорен; Ардал, Бритт Кидмос; Холленсен, Энн Круз; Дамгаард, Кристиан Кроун; Дженсен, Торбен Хейк (октябрь 2018 г.). «Box C / D snoRNP Autoregulation by cis-Acting snoRNA in the NOP56 Pre-mRNA». Молекулярная клетка. 72 (1): 99–111.e5. Дои:10.1016 / j.molcel.2018.08.017. PMID 30220559.
- ^ а б c d е Bachellerie JP, Cavaillé J, Hüttenhofer A (август 2002 г.). «Расширяющийся мир snoRNA». Биохимия. 84 (8): 775–790. Дои:10.1016 / S0300-9084 (02) 01402-5. PMID 12457565.
- ^ Райт М.В., Бруфорд Е.А. (январь 2011 г.). «Обозначение« мусор »: номенклатура генов небелковой кодирующей РНК (нкРНК) человека». Геномика человека. 5 (2): 90–98. Дои:10.1186/1479-7364-5-2-90. ЧВК 3051107. PMID 21296742.
- ^ Самарский Д.А., Фурнье MJ, Зингер Р.Х., Бертран Э. (июль 1998 г.). «Мотив C / D snoRNA box направляет ядрышковое нацеливание, а также связывает синтез и локализацию snoRNA». Журнал EMBO. 17 (13): 3747–3757. Дои:10.1093 / emboj / 17.13.3747. ЧВК 1170710. PMID 9649444.
- ^ Kiss-László Z, Henry Y, Kiss T (февраль 1998 г.). «Последовательность и структурные элементы метилирования направляют мяРНК, необходимые для сайт-специфического метилирования рибозы пре-рРНК». Журнал EMBO. 17 (3): 797–807. Дои:10.1093 / emboj / 17.3.797. ЧВК 1170428. PMID 9451004.
- ^ Кавай Дж., Николозо М., Bachellerie JP (октябрь 1996 г.). «Направленное метилирование рибозы РНК in vivo, направляемое специальными антисмысловыми руководствами по РНК». Природа. 383 (6602): 732–735. Bibcode:1996Натура.383..732C. Дои:10.1038 / 383732a0. PMID 8878486. S2CID 4334683.
- ^ Kiss-László Z, Henry Y, Bachellerie JP, Caizergues-Ferrer M, Kiss T (июнь 1996 г.). «Сайт-специфическое метилирование рибозы прерибосомальной РНК: новая функция для малых ядрышковых РНК». Клетка. 85 (7): 1077–1088. Дои:10.1016 / S0092-8674 (00) 81308-2. PMID 8674114. S2CID 10418885.
- ^ Ганот П., Кайзерг-Феррер М., Поцелуй Т. (апрель 1997 г.). «Семейство малых ядрышковых РНК бокс-АСА определяется эволюционно консервативной вторичной структурой и повсеместными элементами последовательности, необходимыми для накопления РНК». Гены и развитие. 11 (7): 941–956. Дои:10.1101 / gad.11.7.941. PMID 9106664.
- ^ Лян XH, Лю Л., Михаэли С. (октябрь 2001 г.). «Идентификация первой РНК трипаносомы H / ACA, которая направляет образование псевдоуридина на рРНК». Журнал биологической химии. 276 (43): 40313–40318. Дои:10.1074 / jbc.M104488200. PMID 11483606.
- ^ Трэхан С., Дракон Ф. (февраль 2009 г.). «Мутации врожденного дискератоза в домене H / ACA теломеразной РНК человека влияют на ее сборку в пре-РНП». РНК. 15 (2): 235–243. Дои:10.1261 / rna.1354009. ЧВК 2648702. PMID 19095616.
- ^ Jády BE, Kiss T (февраль 2001 г.). «Малая ядрышковая направляющая РНК действует как в метилировании 2'-O-рибозы, так и в псевдоуридилировании сплайсосомальной РНК U5». Журнал EMBO. 20 (3): 541–551. Дои:10.1093 / emboj / 20.3.541. ЧВК 133463. PMID 11157760.
- ^ а б Darzacq X, Jády BE, Verheggen C, Kiss AM, Bertrand E, Kiss T (июнь 2002 г.). «Малые ядерные РНК, специфичные для тельца Кахаля: новый класс управляющих РНК 2'-O-метилирования и псевдоуридилирования». Журнал EMBO. 21 (11): 2746–2756. Дои:10.1093 / emboj / 21.11.2746. ЧВК 126017. PMID 12032087.
- ^ Jády BE, Kiss T (март 2000 г.). «Характеристика малых ядрышковых РНК U83 и U84: две новые направляющие РНК 2'-O-рибозы, которые не комплементарны рибосомным РНК» (Бесплатный полный текст). Исследования нуклеиновых кислот. 28 (6): 1348–1354. Дои:10.1093 / nar / 28.6.1348. ЧВК 111033. PMID 10684929.
- ^ Ли С.Г., Чжоу Х., Ло Ю.П., Чжан П., Цюй Л.Х. (апрель 2005 г.). «Идентификация и функциональный анализ 20 малых ядрышковых РНК Box H / ACA (мяРНК) Schizosaccharomyces pombe». Журнал биологической химии. 280 (16): 16446–16455. Дои:10.1074 / jbc.M500326200. PMID 15716270.
- ^ Кишор С., Штамм С. (2006). «Регулирование альтернативного сплайсинга мяноРНК». Симпозиумы Колд-Спринг-Харбор по количественной биологии. 71: 329–334. Дои:10.1101 / sqb.2006.71.024. PMID 17381313.
- ^ а б Кишор С., Штамм С. (январь 2006 г.). «SnoRNA HBII-52 регулирует альтернативный сплайсинг серотонинового рецептора 2C». Наука. 311 (5758): 230–232. Bibcode:2006Научный ... 311..230K. Дои:10.1126 / science.1118265. PMID 16357227. S2CID 44527461.
- ^ Доу С.М., Релкович Д., Гарфилд А.С., Далли Дж. В., Теобальд Д. Е., Хамби Т., Уилкинсон Л. С., Айлс, штат Арканзас (июнь 2009 г.). «Потеря импринтированной мяРНК mbii-52 приводит к увеличению редактирования пре-РНК 5htr2c и изменению опосредованного 5HT2CR поведения». Молекулярная генетика человека. 18 (12): 2140–2148. Дои:10.1093 / hmg / ddp137. ЧВК 2685753. PMID 19304781.
- ^ Базелей П.С., Шепелев В., Талебизаде З., Батлер М.Г., Федорова Л., Филатов В., Федоров А. (январь 2008 г.). «snoTARGET показывает, что человеческие мишени snoRNA-сирот располагаются близко к альтернативным сплайсинговым соединениям». Ген. 408 (1–2): 172–179. Дои:10.1016 / j.gene.2007.10.037. ЧВК 6800007. PMID 18160232.
- ^ Каур Д., Гупта А. К., Кумари В., Шарма Р., Бхаттачарья А., Бхаттачарья С. (14 августа 2012 г.). «Вычислительное предсказание и проверка C / D, H / ACA и Eh_U3 snoRNAs Entamoeba histolytica». BMC Genomics. 13: 390. Дои:10.1186/1471-2164-13-390.
- ^ Скрябин Б.В., Губарь Л.В., Сигер Б., Пфайффер Дж., Гендель С., Робек Т., Карпова Е., Рождественский Т.С., Брозиус Дж. (Декабрь 2007 г.). «Делеция генного кластера мяРНК MBII-85 у мышей приводит к задержке послеродового роста». PLOS Genetics. 3 (12): e235. Дои:10.1371 / journal.pgen.0030235. ЧВК 2323313. PMID 18166085.
- ^ Саху Т., Дель Гаудио Д., Герман-младший, Шинави М., Петерс С.У., Лицо Р.Э., Гарника А., Чунг С.В., Боде А.Л. (июнь 2008 г.). «Фенотип Прадера-Вилли, вызванный отцовской недостаточностью для небольшого кластера ядрышковой РНК HBII-85 C / D box». Природа Генетика. 40 (6): 719–721. Дои:10,1038 / нг.158. ЧВК 2705197. PMID 18500341.
- ^ Дин Ф., Ли Х. Х., Чжан С., Соломон Н. М., Кампер С. А., Коэн П., Франк У. (март 2008 г.). Акбарян С (ред.). «Делеция SnoRNA Snord116 (Pwcr1 / MBII-85) вызывает дефицит роста и гиперфагию у мышей». PLOS ONE. 3 (3): e1709. Bibcode:2008PLoSO ... 3.1709D. Дои:10.1371 / journal.pone.0001709. ЧВК 2248623. PMID 18320030.
- ^ Ding F, Prints Y, Dhar MS, Johnson DK, Garnacho-Montero C, Nicholls RD, Francke U (июнь 2005 г.). «Отсутствие мяРНК Pwcr1 / MBII-85 критично для неонатальной летальности в моделях мышей с синдромом Прадера-Вилли». Геном млекопитающих. 16 (6): 424–431. Дои:10.1007 / s00335-005-2460-2. PMID 16075369. S2CID 12256515.
- ^ Накатани Дж., Тамада К., Хатанака Ф., Исэ С, Охта Х, Иноуэ К., Томонага С., Ватанабэ Й., Чунг Й. Дж., Банерджи Р., Ивамото К., Като Т, Окадзава М., Ямаути К., Танда К., Такао К., Миякава Т. , Брэдли А., Такуми Т. (июнь 2009 г.). «Аномальное поведение в модели мыши, созданной с помощью хромосом, для дупликации 15q11-13 человека, наблюдаемой при аутизме». Клетка. 137 (7): 1235–1246. Дои:10.1016 / j.cell.2009.04.024. ЧВК 3710970. PMID 19563756.
- ^ Болтон П.Ф., Велтман М.В., Вайсблатт Э., Холмс-младший, Томас Н.С., Юингс С.А., Томпсон Р.Дж., Робертс С.Е., Деннис Н.Р., Браун С.Е., Гудсон С., Мур В., Браун Дж. (Сентябрь 2004 г.). «Аномалии хромосомы 15q11-13 и другие заболевания у людей с расстройствами аутистического спектра». Психиатрическая генетика. 14 (3): 131–137. Дои:10.1097/00041444-200409000-00002. PMID 15318025. S2CID 37344935.
- ^ Cook EH, Scherer SW (октябрь 2008 г.). «Вариации числа копий, связанные с нервно-психическими расстройствами». Природа. 455 (7215): 919–923. Bibcode:2008Натура.455..919C. Дои:10.1038 / природа07458. PMID 18923514. S2CID 4377899.
- ^ Cavaillé J, Seitz H, Paulsen M, Ferguson-Smith AC, Bachellerie JP (июнь 2002 г.). «Идентификация тандемно-повторяющихся генов C / D snoRNA в импринтированном человеческом домене 14q32, напоминающем таковые в области синдрома Прадера-Вилли / Ангельмана». Молекулярная генетика человека. 11 (13): 1527–1538. Дои:10.1093 / hmg / 11.13.1527. PMID 12045206.
- ^ Labialle S, Cavaillé J (август 2011 г.). «Вызывают ли повторяющиеся массивы регуляторных генов малых РНК геномный импринтинг ?: одновременное появление больших кластеров малых некодирующих РНК и геномный импринтинг в четырех эволюционно различных локусах человеческих хромосом». BioEssays. 33 (8): 565–573. Дои:10.1002 / bies.201100032. PMID 21618561. S2CID 10408004.
- ^ Эндер С., Крек А., Фридлендер М. Р., Бейтцингер М., Вайнманн Л., Чен В., Пфеффер С., Раевски Н., Майстер Г. (ноябрь 2008 г.). «Человеческая snoRNA с функциями, подобными микроРНК». Молекулярная клетка. 32 (4): 519–528. Дои:10.1016 / j.molcel.2008.10.017. PMID 19026782.
- ^ Бабиарц Дж. Э., Руби Дж. Г., Ван Й, Бартель Д. П., Блеллох Р. (октябрь 2008 г.). «Мышиные ES-клетки экспрессируют эндогенные shRNA, siRNA и другие микропроцессорные независимые, Dicer-зависимые малые РНК». Гены и развитие. 22 (20): 2773–2785. Дои:10.1101 / gad.1705308. ЧВК 2569885. PMID 18923076.
- ^ Тафт Р.Дж., Глазов Е.А., Лассманн Т., Хаяшизаки Ю., Карнинчи П., Маттик Дж.С. (июль 2009 г.). «Малые РНК, полученные из мяРНК». РНК. 15 (7): 1233–1240. Дои:10.1261 / rna.1528909. ЧВК 2704076. PMID 19474147.
- ^ Schubert T, Pusch MC, Diermeier S, Benes V, Kremmer E, Imhof A, Längst G (ноябрь 2012 г.). «Белок Df31 и мяРНК поддерживают доступные структуры хроматина высшего порядка». Молекулярная клетка. 48 (3): 434–444. Дои:10.1016 / j.molcel.2012.08.021. PMID 23022379.
внешняя ссылка
- атлас snoRNA человека из данных секвенирования малых РНК
- база данных snoRNA растений
- snoRNAbase: база данных snoRNA H / ACA и C / D-бокса человека
- База данных snoRNP
- База данных snoRNA дрожжей
- паттерн экспрессии snoRNA человека
- Страница Rfam для C / D box snoRNAs
- Страница rfam для snoRNA бокса H / ACA
- Страница rfam для scaRNA snoRNAs

