Распознавание сигнала РНК частицы - Signal recognition particle RNA - Wikipedia
| RN7SL1 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Псевдонимы | RN7SL1, 7L1a, 7SL, RN7SL, RNSRP1, РНК частицы распознавания сигнала, РНК, 7SL, цитоплазма 1, компонент РНК частицы распознавания сигнала 7SL1 | ||||||
| Внешние идентификаторы | OMIM: 612177 Генные карты: RN7SL1 | ||||||
| Ортологи | |||||||
| Разновидность | Человек | Мышь | |||||
| Entrez |
| ||||||
| Ансамбль |
| ||||||
| UniProt |
|
| |||||
| RefSeq (мРНК) |
|
| |||||
| RefSeq (белок) |
|
| |||||
| Расположение (UCSC) | н / д | н / д | |||||
| PubMed поиск | [1] | н / д | |||||
| Викиданные | |||||||
| |||||||
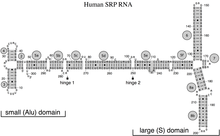
В сигнал распознавания частицы РНК, (также известный как 7SL, 6S, ffs, или 4.5S РНК) является частью частица распознавания сигнала (SRP) рибонуклеопротеин сложный. SRP признает сигнальный пептид и привязывается к рибосома, остановка синтеза белка. SRP-рецептор представляет собой белок, который встроен в мембрану и содержит трансмембранная пора. Когда SRP-рибосома комплекс связывается с SRP-рецептор, SRP высвобождает рибосому и уносится прочь. Рибосома возобновляет синтез белка, но теперь белок движется через SRP-рецептор трансмембранные поры.
Таким образом SRP направляет движение белки в пределах клетка связываться с трансмембранной порой, которая позволяет белку пересекать мембрану туда, где это необходимо. РНК и белковые компоненты этого комплекса высоко консервированный но различаются между разными королевства жизни.
Общее СИНУС семья Алу вероятно, произошел от гена 7SL РНК после делеции центральной последовательности.[2]
В эукариотический SRP состоит из 300 нуклеотидов 7S РНК и шесть белков: SRP 72, 68, 54, 19, 14 и 9. SRP архей состоит из 7S РНК и гомологов эукариотических белков SRP19 и SRP54. 7S РНК эукариот и архей имеют очень похожие вторичные структуры.[3]
В большинстве бактерии SRP состоит из молекулы РНК (4.5S) и белка Ffh (гомолог эукариотического белка SRP54). Немного Грамположительный бактерии (например, Bacillus subtilis ) имеют более длинную эукариотоподобную РНК SRP, которая включает Домен Alu.[4]
У эукариот и архей восемь спиральных элементов складываются в Алу и S-домены, разделенные длинной линкерной областью.[5][6] Полагают, что домен Alu опосредует функцию замедления удлинения пептидной цепи SRP.[5] Универсально консервативная спираль, которая взаимодействует с M-доменом SRP54, опосредует распознавание сигнальной последовательности.[6][7] Комплекс SRP19-спираль 6, как полагают, участвует в сборке SRP и стабилизирует спираль 8 для SRP54. привязка[5] У людей есть три функциональных гена РНК SRP, которые удобно назвать RN7SL1, RN7SL2 и RN7SL3. В частности, известно, что геном человека содержит большое количество последовательности, относящейся к РНК SRP, включая Алу повторяет.[4]
Открытие
РНК SRP была впервые обнаружена у птиц и мышей. онкогенный РНК (окорна) вирус частицы.[8] Впоследствии было обнаружено, что РНК SRP является стабильным компонентом неинфицированных клеток HeLa, где она связана с мембрана и полисом фракции.[9][10] В 1980 году клеточные биологи очистили от собачий поджелудочная железа 11S «белок распознавания сигнала» (случайно также сокращенно «SRP»), который способствует транслокации секреторных белков через мембрана из эндоплазматический ретикулум.[11] Затем было обнаружено, что SRP содержит РНК компонент.[12] Сравнение РНК SRP гены из разных разновидность показали, что спираль 8 SRP РНК очень высока. консервированный во всех сферах жизнь.[13] Области около 5′- и 3′-концов млекопитающее SRP РНК подобны доминантному семейству Alu средних повторяющихся последовательностей человеческий геном.[14] Теперь понятно, что Алу ДНК происходит из РНК SRP путем вырезания центрального фрагмента РНК SRP (S), за которым следует обратная транскрипция и интеграция с несколькими сайтами человеческого хромосомы.[2] РНК SRP были идентифицированы также в некоторых органеллы, например в пластида SRP многих фотосинтезирующих организмов.[15]
Транскрипция и обработка
РНК SRP эукариот транскрибируются с ДНК к РНК-полимераза III (Pol III).[16] РНК-полимераза III также транскрибирует гены для 5S рибосомальный РНК, тРНК, 7SK РНК, и Сплайсосомная РНК U6. В промоутеры генов SRP РНК человека включают элементы, расположенные ниже сайта начала транскрипции. Растительная РНК SRP промоутеры содержать стимулирующий элемент вверх по течению (ИСПОЛЬЗОВАНИЕ) и Коробка ТАТА.[нужна цитата ] Дрожжи Гены SRP РНК имеют Коробка ТАТА и дополнительные внутригенный промоторные последовательности (называемые А- и В-блоками), которые играют роль в регуляции транскрипция гена SRP с помощью Pol III.[17] в бактерии, гены организованы в опероны и расшифровано РНК-полимераза.[нужна цитата ] 5'-конец малой (4.5S) РНК SRP многих бактерий расщепляется РНКаза P.[нужна цитата ] Конец Bacillus subtilis РНК SRP обрабатываются РНКаза III. Пока нет SRP РНК интроны наблюдались.[нужна цитата ]
Функция
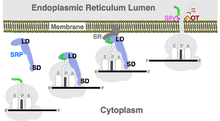
Ко-трансляционная транслокация
РНК SRP является неотъемлемой частью малого и большого домена SRP. Функция малого домена заключается в задержке трансляции белка до тех пор, пока связанный с рибосомами SRP не получит возможность связываться с резидентным мембраной. Рецептор SRP (SR). Внутри большого домена РНК SRP заряженного сигнальным пептидом SRP способствует гидролизу двух гуанозинтрифосфат (GTP) молекулы. Эта реакция высвобождает SRP из рецептора SRP и рибосома, позволяя перевод продолжать и белок войти в Translocon.[18] Белок пересекает мембрану совместно (во время трансляции) и входит в другой клеточный компартмент или внеклеточное пространство. В эукариоты, целью является мембрана из эндоплазматический ретикулум (ER). В Археи, SRP доставляет белки в плазматическая мембрана.[19] в бактерии, SRP в первую очередь включает белки во внутреннюю мембрану.[20]
Посттрансляционный транспорт
SRP также участвует в сортировке белки после завершения их синтеза (посттрансляционная сортировка белков). В эукариоты, заякоренные в хвосте белки, обладающие гидрофобный последовательность вставки на их C-конце доставляется в эндоплазматический ретикулум (ER) SRP.[21] Точно так же SRP помогает посттрансляционно импортировать ядерно-кодируемые белки в тилакоид мембрана хлоропласты.[22]
Структура
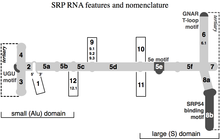
В 2005 г. номенклатура для всех SRP РНК предложена система нумерации из 12 спиралей. Секции спирали именуются строчными буквами. суффикс (например, 5а). Вставки или спиральные «ответвления» обозначены пунктирными номерами (например, 9.1 и 12.1).
РНК SRP охватывает широкий филогенетический спектр по размеру и количеству его структурных особенностей (см. Примеры вторичной структуры SRP РНК ниже). Наименьшие функциональные РНК SRP были обнаружены в микоплазма и родственные виды. кишечная палочка SRP РНК (также называемая 4.5S РНК) состоит из 114 нуклеотид остатки и образует РНК стебель-петля. В грамположительный бактерия Bacillus subtilis кодирует более крупную 6S SRP РНК, которая напоминает Архей гомологи но отсутствует спираль 6 РНК SRP. Архей РНК SRP имеют спирали с 1 по 8, без спирали 7 и характеризуются третичная структура который включает апикальный петли спирали 3 и спирали 4. эукариотический РНК SRP лишены спирали 1 и содержат спираль 7 переменного размера. Немного простейшие РНК SRP имеют сокращенные спирали 3 и 4. аскомикота РНК SRP имеют полностью сокращенный малый домен и не имеют спиралей 3 и 4. Самые крупные из известных на сегодняшний день SRP РНК обнаружены в дрожжи (Сахаромицеты ), который приобрел спирали 9–12 как вставки в спираль 5, а также удлиненную спираль 7. Семя растения экспрессируют многочисленные сильно дивергентные РНК SRP.[3]
Мотивы
Были идентифицированы четыре консервативных признака (мотива) (показаны на рисунке темно-серым цветом): (1) связывающий мотив SRP54, (2) мотив тетрапетли Helix 6 GNAR, (3) мотив 5e и (4) UGU (NR). мотив.[нужна цитата ]
Привязка SRP54
Асимметричная петля между спиральными участками 8a и 8b и соседним парным участком 8b является характерным свойством каждой SRP РНК. Винтовая секция 8b содержит не-Базовые пары Уотсона-Крика которые способствуют формированию плоского малая бороздка в РНК, подходящей для связывания белок SRP54 (в бактериях он называется Ffh).[6] В апикальный петля спирали 8 содержит четыре, пять или шесть остатков, в зависимости от разновидность. Имеет очень консервативный гуанозин как первый и аденозин как остаток последней петли. Эта функция необходима для взаимодействия с третьим аденозин остаток спирали 6 GNAR тетрапетли.[23]
Тетралуп Helix 6 GNAR
РНК SRP эукариоты и Археи иметь тетрапетлю GNAR (N для любого нуклеотид, R для пурин ) в спирали 6. Его консервативная аденозин остаток важен для связывания белок SRP19.[24] Этот аденозин совершает третичное взаимодействие с другим аденозин остаток, расположенный в апикальный петля спирали 8.[25]
5e
11 нуклеотидов мотива 5e образуют четыре пар оснований которые прерываются петлей из трех нуклеотиды.[4] в эукариоты, первый нуклеотид петли - это аденозин который нужен для привязки белок SRP72.[26]
UGU (NR)
Мотив UGU (NR) соединяет спирали 3 и 4 в малом (Alu) домене SRP. Грибковые SRP РНК, лишенные спиралей 3 и 4, содержат мотив внутри петли спирали 2.[4] Важно при привязке SRP9 / 14 белок гетеродимер как часть РНК Разворот.[27]
Вторичный
- Примеры вторичных структур SRP РНК
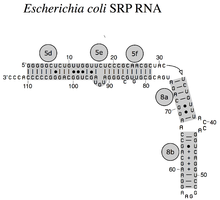
Бактериальный SRP РНК (4.5S РНК) из Кишечная палочка

Бактериальная РНК SRP (6S РНК) из Bacillus subtilis

Архей SRP РНК Археоглобус фулгидус

Эукариотический протист SRP РНК из Trypanosoma brucei

Эукариотический дрожжи SRP РНК из Saccharomyces cerevisiae
Третичный
| SRP РНК | |
|---|---|
| Идентификаторы | |
| Рфам | CL00003 |
| Прочие данные | |
| PDB структуры | PDBe 2IY3, 1Z43, 1RY1, 1QZW, 1MFQ, 1L9A, 1 СПГ,1JID, 1E8S, 1E8O, 1DUL, 1DUH,1D4R, 28SR, 28SP |
Рентгеновская кристаллография, ядерный магнитный резонанс (ЯМР) и криоэлектронная микроскопия (крио-ЭМ] были использованы для определения молекулярная структура частей РНК SRP из различных разновидность. Доступные структуры PDB показывают, что молекула РНК либо свободна, либо связана с одним или несколькими SRP. белки.
- Кристаллографические структуры репрезентативных SRP

SRP19-7S.S SRP РНК-комплекс из М. jannaschii[25]
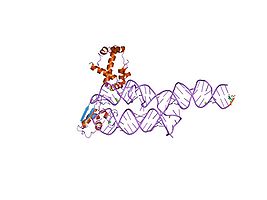
S-домен человеческого SRP[28]
Связывающие белки
Один или несколько SRP белки привязать к SRP РНК собрать функциональный SRP. Белки SRP названы в соответствии с их приблизительными молекулярная масса измеряется в килодальтон.[29] Наиболее бактериальный SRP состоят из SRP РНК и SRP54 (также называемых Ffh для "Fесли-жнаш часомолог "). Архей SRP содержит белки SRP54 и SRP19. В эукариоты, РНК SRP объединяется с импортированными белками SRP SRP9 / 14, SRP19 и SRP68 / 72 в области ядрышко. Этот предварительный SRP переносится в цитозоль где он связывается с белком SRP54.[30] В молекулярные структуры свободной или связанной с SRP РНК белки SRP9 / 14, SRP19 или SRP54 известны с высоким разрешением.
SRP9 и SRP14
SRP9 и SRP14 являются структурно связанных и образуют SRP9 / 14 гетеродимер который связывается с SRP РНК малого (Alu) домена.[27] Дрожжи SRP не имеет SRP9 и содержит структурно родственный белок SRP21. Дрожжи SRP14 образует гомодимер.[31] SRP9 / 14 отсутствует в SRP трипаносома которые вместо этого обладают тРНК -подобная молекула.[32]
SRP19
SRP19 находится в SRP эукариоты и Археи. Его основная роль заключается в подготовке РНК SRP для связывания SRP54, SRP68 и SRP72 путем правильной организации спиралей 6 и 8 РНК SRP.[28] Дрожжи SRP содержит Sec65p, более крупный гомолог SRP19.[33]
SRP54
Белок SRP54 (названный Ffh в бактерии ) является важным компонентом каждого SRP. Он состоит из трех функциональных домены: N-концевой (N) домен, GTPase (G) область, а метионин -богатый (M) домен.[34][35]
SRP68 и SRP72
Белки SRP68 и SRP72 являются составными частями большого домена эукариотический SRP. Они образуют стабильный гетеродимер SRP68 / 72. Было показано, что около одной трети человеческого белка SRP68 связывается с РНК SRP.[36] Относительно небольшая область, расположенная рядом с С-концом SRP72, связывается с мотивом РНК 5e SRP.[26][37]
Рекомендации
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Уллу Э., Чуди Ч. (1984). «Последовательности Alu процессируются генами 7SL РНК». Природа. 312 (5990): 171–172. Bibcode:1984Натура.312..171У. Дои:10.1038 / 312171a0. PMID 6209580. S2CID 4328237.
- ^ а б Розенблад М.А., Ларсен Н., Самуэльссон Т., Цвиб С. (2009). «Родство в семействе SRP РНК». РНК Биология. 6 (5): 508–516. Дои:10.4161 / rna.6.5.9753. PMID 19838050.
- ^ а б c d Regalia M, Rosenblad MA, Samuelsson T (август 2002 г.). «Прогнозирование распознавания сигналов генов РНК частиц». Исследования нуклеиновых кислот. 30 (15): 3368–3377. Дои:10.1093 / нар / gkf468. ЧВК 137091. PMID 12140321.
- ^ а б c Wild K, Weichenrieder O, Strub K, Sinning I, Cusack S (февраль 2002 г.). «К структуре частицы распознавания сигнала млекопитающих». Текущее мнение в структурной биологии. 12 (1): 72–81. Дои:10.1016 / S0959-440X (02) 00292-0. PMID 11839493.
- ^ а б c Батей Р.Т., Рэмбо Р.П., Лукаст Л., Ра Б., Дудна Д.А. (февраль 2000 г.). «Кристаллическая структура рибонуклеопротеинового ядра сигнальной распознающей частицы». Наука. 287 (5456): 1232–1239. Bibcode:2000Sci ... 287.1232B. Дои:10.1126 / science.287.5456.1232. PMID 10678824.
- ^ Батей Р.Т., Сагар М.Б., Дудна Д.А. (март 2001 г.). «Структурный и энергетический анализ распознавания РНК универсально консервативным белком из сигнальной частицы распознавания». Журнал молекулярной биологии. 307 (1): 229–246. Дои:10.1006 / jmbi.2000.4454. PMID 11243816.
- ^ Епископ Дж. М., Левинсон В. Е., Салливан Д., Фаншиер Л., Квинтрелл Н., Джексон Дж. (Декабрь 1970 г.). "Низкомолекулярные РНК вируса саркомы Рауса. II. РНК 7 S". Вирусология. 42 (4): 927–937. Дои:10.1016/0042-6822(70)90341-7. PMID 4321311.
- ^ Уокер Т.А., Пейс Н.Р., Эриксон Р.Л., Эриксон Э., Бер Ф. (сентябрь 1974 г.). «РНК 7S, общая для онкорнавирусов и нормальных клеток, связана с полирибосомами». Труды Национальной академии наук Соединенных Штатов Америки. 71 (9): 3390–3394. Bibcode:1974PNAS ... 71,3390 Вт. Дои:10.1073 / пнас.71.9.3390. ЧВК 433778. PMID 4530311.
- ^ Зиев Г., Пенман С. (май 1976 г.). «Малые виды РНК клетки HeLa: метаболизм и субклеточная локализация». Клетка. 8 (1): 19–31. Дои:10.1016/0092-8674(76)90181-1. PMID 954090. S2CID 26928799.
- ^ Вальтер П., Ибрагими И., Блобель Г. (ноябрь 1981 г.). «Транслокация белков через эндоплазматический ретикулум. I. Белок распознавания сигнала (SRP) связывается с собранными in vitro полисомами, синтезирующими секреторный белок». Журнал клеточной биологии. 91 (2 Pt 1): 545–550. Дои:10.1083 / jcb.91.2.545. ЧВК 2111968. PMID 7309795.
- ^ Вальтер П., Блобель Г. (октябрь 1982 г.). «Частица распознавания сигнала содержит 7S РНК, необходимую для транслокации белка через эндоплазматический ретикулум». Природа. 299 (5885): 691–698. Bibcode:1982Натура.299..691Вт. Дои:10.1038 / 299691a0. PMID 6181418. S2CID 4237513.
- ^ Ларсен Н., Цвиб С. (январь 1991 г.). «Выравнивание последовательностей SRP-РНК и вторичная структура». Исследования нуклеиновых кислот. 19 (2): 209–215. Дои:10.1093 / nar / 19.2.209. ЧВК 333582. PMID 1707519.
- ^ Уллу Э., Мерфи С., Мелли М. (май 1982 г.). «Человеческая 7SL РНК состоит из 140 нуклеотидной средне повторяющейся последовательности, вставленной в последовательность alu». Клетка. 29 (1): 195–202. Дои:10.1016/0092-8674(82)90103-9. PMID 6179628. S2CID 12709599.
- ^ Розенблад М.А., Самуэльссон Т. (ноябрь 2004 г.). «Идентификация генов РНК частиц распознавания сигнала хлоропластов». Физиология растений и клеток. 45 (11): 1633–1639. Дои:10.1093 / pcp / pch185. PMID 15574839.
- ^ Dieci G, Fiorino G, Castelnuovo M, Teichmann M, Pagano A (декабрь 2007 г.). «Расширяющийся транскриптом РНК-полимеразы III». Тенденции в генетике. 23 (12): 614–622. Дои:10.1016 / j.tig.2007.09.001. HDL:11381/1706964. PMID 17977614.
- ^ Dieci G, Giuliodori S, Catellani M, Percudani R, Ottonello S (март 2002 г.). «Внутригенная адаптация промотора и облегчение рециклинга РНК-полимеразы III в транскрипции SCR1, гена 7SL РНК Saccharomyces cerevisiae». Журнал биологической химии. 277 (9): 6903–6914. Дои:10.1074 / jbc.M105036200. PMID 11741971.
- ^ Шан С.О., Уолтер П. (февраль 2005 г.). «Ко-трансляционное нацеливание на белок с помощью частицы распознавания сигнала». Письма FEBS. 579 (4): 921–926. Дои:10.1016 / j.febslet.2004.11.049. PMID 15680975. S2CID 46046514.
- ^ Zwieb C, Eichler J (март 2002 г.). «Попадание в цель: частица, распознающая сигнал архей». Археи. 1 (1): 27–34. Дои:10.1155/2002/729649. ЧВК 2685543. PMID 15803656.
- ^ Ульбрандт Н.Д., Ньюитт Дж. А., Бернштейн HD (январь 1997 г.). «Частица распознавания сигнала E. coli необходима для встраивания подмножества белков внутренней мембраны». Клетка. 88 (2): 187–196. Дои:10.1016 / S0092-8674 (00) 81839-5. PMID 9008159. S2CID 15246619.
- ^ Abell BM, Pool MR, Schlenker O, Sinning I, High S (июль 2004 г.). «Частица распознавания сигнала опосредует посттрансляционное нацеливание у эукариот». Журнал EMBO. 23 (14): 2755–2764. Дои:10.1038 / sj.emboj.7600281. ЧВК 514945. PMID 15229647.
- ^ Шуенеманн Д., Гупта С., Перселло-Картье Ф., Климюк В.И., Джонс Д.Д., Нуссом Л., Хоффман Н.Е. (август 1998 г.). «Новая частица, распознающая сигнал, направляет светособирающие белки на мембраны тилакоидов». Труды Национальной академии наук Соединенных Штатов Америки. 95 (17): 10312–10316. Bibcode:1998PNAS ... 9510312S. Дои:10.1073 / пнас.95.17.10312. ЧВК 21505. PMID 9707644.
- ^ Zwieb C, van Nues RW, Rosenblad MA, Brown JD, Samuelsson T (январь 2005 г.). «Номенклатура для всех РНК частиц распознавания сигналов». РНК. 11 (1): 7–13. Дои:10.1261 / rna.7203605. ЧВК 1370686. PMID 15611297.
- ^ Zwieb C (август 1992 г.). «Распознавание тетрануклеотидной петли сигнальной РНК частицы распознавания белком SRP19». Журнал биологической химии. 267 (22): 15650–15656. PMID 1379233.
- ^ а б Hainzl T, Huang S, Sauer-Eriksson AE (июнь 2002 г.). «Структура комплекса РНК SRP19 и значение для сборки частиц распознавания сигнала». Природа. 417 (6890): 767–771. Bibcode:2002Натурал.417..767Х. Дои:10.1038 / природа00768. PMID 12050674. S2CID 2509475.
- ^ а б Яхьяева Е., Вовер Дж., Вовер И.К., Цвиб С. (июнь 2008 г.). «Мотив 5e эукариотической РНК частицы, распознающей сигнал, содержит консервативный аденозин для связывания SRP72». РНК. 14 (6): 1143–1153. Дои:10.1261 / rna.979508. ЧВК 2390789. PMID 18441046.
- ^ а б Weichenrieder O, Wild K, Strub K, Cusack S (ноябрь 2000 г.). «Структура и сборка Alu-домена сигнальной распознающей частицы млекопитающих». Природа. 408 (6809): 167–173. Bibcode:2000Натурал 408..167Вт. Дои:10.1038/35041507. PMID 11089964. S2CID 4427070.
- ^ а б Kuglstatter A, Oubridge C, Nagai K (2002). «Вызванные структурные изменения 7SL РНК во время сборки человеческих сигнальных распознающих частиц». Нат Структ Биол. 9 (10): 740–744. Дои:10.1038 / nsb843. PMID 12244299. S2CID 9543041.
- ^ Вальтер П., Блобель Г. (сентябрь 1983 г.). «Разборка и воссоздание частицы распознавания сигнала». Клетка. 34 (2): 525–533. Дои:10.1016/0092-8674(83)90385-9. PMID 6413076. S2CID 17907778.
- ^ Politz JC, Yarovoi S, Kilroy SM, Gowda K, Zwieb C, Pederson T (январь 2000 г.). «Компоненты частиц распознавания сигналов в ядрышке». Труды Национальной академии наук Соединенных Штатов Америки. 97 (1): 55–60. Bibcode:2000ПНАС ... 97 ... 55П. Дои:10.1073 / пнас.97.1.55. ЧВК 26615. PMID 10618370.
- ^ Брукс М.А., Равелли Р.Б., Маккарти А.А., Страб К., Кьюсак С. (май 2009 г.). «Структура SRP14 из частицы распознавания сигнала Schizosaccharomyces pombe». Acta Crystallographica Раздел D. 65 (Pt 5): 421–433. Дои:10.1107 / S0907444909005484. PMID 19390147.
- ^ Лю Л., Бен-Шломо Х, Сюй YX, Стерн М.З., Гончаров И., Чжан Ю., Михаэли С. (май 2003 г.). «Частица распознавания сигнала трипаносоматиды состоит из двух молекул РНК, гомолога 7SL РНК и новой тРНК-подобной молекулы». Журнал биологической химии. 278 (20): 18271–18280. Дои:10.1074 / jbc.M209215200. PMID 12606550.
- ^ Ханн BC, Стирлинг CJ, Уолтер П. (апрель 1992 г.). «Продукт гена SEC65 представляет собой субъединицу частицы, распознающей дрожжевой сигнал, необходимую для ее целостности». Природа. 356 (6369): 532–533. Bibcode:1992Натура.356..532H. Дои:10.1038 / 356532a0. PMID 1313947. S2CID 4287636.
- ^ Ремиш К., Уэбб Дж., Герц Дж., Прен С., Франк Р., Вингрон М., Добберштейн Б. (август 1989 г.). «Гомология белка 54К частицы распознавания сигнала, стыковочного белка и двух белков E. coli с предполагаемыми GTP-связывающими доменами» (PDF). Природа. 340 (6233): 478–482. Bibcode:1989Натура.340..478р. Дои:10.1038 / 340478a0. PMID 2502717. S2CID 4343347.
- ^ Бернштейн Х.Д., Пориц М.А., Штруб К., Хобен П.Дж., Бреннер С., Вальтер П. (август 1989 г.). «Модель распознавания сигнальной последовательности из аминокислотной последовательности 54К-субъединицы сигнальной распознающей частицы». Природа. 340 (6233): 482–486. Bibcode:1989Натура.340..482Б. Дои:10.1038 / 340482a0. PMID 2502718. S2CID 619959.
- ^ Яхьяева Э., Бхуйян С.Х., Инь Дж., Цвиб С. (июнь 2006 г.). «Белок SRP68 частицы распознавания сигнала человека: идентификация связывающих доменов РНК и SRP72». Белковая наука. 15 (6): 1290–1302. Дои:10.1110 / л.с. 051861406. ЧВК 2242529. PMID 16672232.
- ^ Яхьяева Э., Инь Дж., Цвиб С. (январь 2005 г.). «Идентификация РНК-связывающего домена в человеческом SRP72». Журнал молекулярной биологии. 345 (4): 659–666. Дои:10.1016 / j.jmb.2004.10.087. PMID 15588816.
дальнейшее чтение
- Kuglstatter A, Oubridge C, Nagai K (октябрь 2002 г.). «Вызванные структурные изменения 7SL РНК во время сборки человеческих сигнальных частиц». Структурная биология природы. 9 (10): 740–744. Дои:10.1038 / nsb843. PMID 12244299. S2CID 9543041.
- Ван Т., Тиан Ч., Чжан В., Ло К., Саркис П. Т., Ю Л, Лю Б., Ю Й, Ю XF (декабрь 2007 г.). «7SL РНК опосредует упаковку вириона противовирусной цитидиндезаминазы APOBEC3G». Журнал вирусологии. 81 (23): 13112–13124. Дои:10.1128 / JVI.00892-07. ЧВК 2169093. PMID 17881443.
- Уллу Э., Вайнер А.М. (декабрь 1984 г.). «Человеческие гены и псевдогены для компонента 7SL РНК частицы распознавания сигнала». Журнал EMBO. 3 (13): 3303–3310. Дои:10.1002 / j.1460-2075.1984.tb02294.x. ЧВК 557853. PMID 6084597.
- Энглерт М., Фелис М., Юнкер В., Байер Х (декабрь 2004 г.). «Новые вышестоящие и внутригенные элементы контроля для зависимой от РНК-полимеразы III транскрипции генов 7SL РНК человека». Биохимия. 86 (12): 867–874. Дои:10.1016 / j.biochi.2004.10.012. PMID 15667936.
- Обридж К., Куглштаттер А., Джовин Л., Нагаи К. (июнь 2002 г.). «Кристаллическая структура SRP19 в комплексе с S доменом РНК SRP и ее значение для сборки сигнальной частицы распознавания». Молекулярная клетка. 9 (6): 1251–1261. Дои:10.1016 / S1097-2765 (02) 00530-0. PMID 12086622.
- Ван Т., Тиан Ч., Чжан В., Саркис П. Т., Ю XF (январь 2008 г.). «Для упаковки вириона APOBEC3F необходимо взаимодействие с 7SL РНК, но не с геномной РНК ВИЧ-1 или Р-тельцами». Журнал молекулярной биологии. 375 (4): 1098–1112. Дои:10.1016 / j.jmb.2007.11.017. PMID 18067920.
внешняя ссылка
- База данных SRP (SRPDB): сопоставления РНК SRP и связанных белков, вторичные структуры РНК SRP и трехмерные модели
- Запись Rfam для РНК частицы распознавания сигнала типа Metazoan
- Запись Rfam для РНК бактериальной частицы, распознающей малый сигнал
- Запись Rfam для РНК бактериальной частицы с большим сигналом распознавания
- Запись Rfam для РНК частицы, распознающей сигнал грибка
- Запись Rfam для РНК частиц распознавания сигнала растений
- Запись Rfam для РНК частицы распознавания сигнала простейшими
- Запись Rfam для РНК частицы, распознающей сигнал архей
- Фильм о распознавании сигналов Dnatube







