Клеточная дифференциация - Cellular differentiation


Клеточная дифференциация это процесс, в котором ячейка меняется с одного тип ячейки другому.[2][3] Обычно клетка меняется на более специализированный тип. Дифференциация происходит много раз во время развития многоклеточный организм как он меняется с простого зигота к сложной системе ткани и типы клеток. Дифференциация продолжается во взрослом возрасте как взрослые стволовые клетки разделять и создавать полностью дифференцированные дочерние клетки во время восстановления тканей и во время нормального клеточного обмена. Некоторая дифференциация происходит в ответ на антиген воздействие. Дифференциация резко меняет размер, форму клетки, мембранный потенциал, метаболическая активность и отзывчивость на сигналы. Эти изменения во многом обусловлены тщательно контролируемыми модификациями в экспрессия гена и являются изучением эпигенетика. За некоторыми исключениями, клеточная дифференцировка почти никогда не связана с изменением ДНК сама последовательность. Таким образом, разные клетки могут иметь очень разные физические характеристики, несмотря на одинаковые геном.
Специализированный тип дифференцировки, известный как «терминальная дифференциация», важен для некоторых тканей, например нервной системы позвоночных, поперечнополосатых мышц, эпидермиса и кишечника. Во время терминальной дифференцировки клетка-предшественник, ранее способная к клеточному делению, навсегда покидает клеточный цикл, разрушает аппарат клеточного цикла и часто экспрессирует ряд генов, характерных для конечной функции клетки (например, миозин и актин для мышечной клетки). Дифференциация может продолжаться и после терминальной дифференцировки, если емкость и функции клетки претерпевают дальнейшие изменения.
Среди делящихся клеток есть несколько уровней потенция клеток, способность клетки дифференцироваться в другие типы клеток. Более высокая эффективность указывает на большее количество типов клеток, которые могут быть получены. Клетка, которая может дифференцироваться во все типы клеток, включая ткань плаценты, известна как тотипотент. У млекопитающих только зигота и последующие бластомеры являются тотипотентными, тогда как у растений многие дифференцированные клетки могут стать тотипотентными с помощью простых лабораторных методов. Клетка, которая может дифференцироваться во все типы клеток взрослого организма, известна как плюрипотентный. Такие клетки называются меристематические клетки в высших растениях и эмбриональные стволовые клетки у животных, хотя некоторые группы сообщают о наличии взрослых плюрипотентных клеток. Вирусно-индуцированная экспрессия четырех факторов транскрипции 4 октября, Sox2, c-Myc, и Klf4 (Факторы Яманака ) достаточно для создания плюрипотентных (iPS) клеток из взрослых фибробласты.[4] А мультипотентный клетка - это та, которая может дифференцироваться на несколько различных, но тесно связанных типов клеток.[5] Олигопотентные клетки более ограничены, чем мультипотентны, но все же могут дифференцироваться на несколько тесно связанных типов клеток.[5] В заключение, всесильный клетки могут дифференцироваться только в один тип клеток, но способны к самообновлению.[5] В цитопатология, уровень клеточной дифференциации используется как мера рак прогрессия. "Оценка «является маркером дифференцировки клетки в опухоли.[6]
Типы клеток млекопитающих
Тело млекопитающего состоит из трех основных категорий клеток: стволовые клетки, соматические клетки, и стволовые клетки. Каждый из примерно 37,2 триллиона (3,72x1013) клетки взрослого человека имеют собственную копию или копии геном кроме определенных типов ячеек, таких как красные кровяные клетки, в которых отсутствуют ядра в полностью дифференцированном состоянии. Большинство ячеек диплоид; у них есть по две копии каждого хромосома. Такие клетки, называемые соматическими клетками, составляют большую часть человеческого тела, например клетки кожи и мышц. Клетки дифференцируются, чтобы специализироваться на разных функциях.[7]
Клетки зародышевой линии - это любая линия клеток, которая дает начало гаметы - яйцеклетки и сперма - и, следовательно, переходят из поколения в поколение. Стволовые клетки, с другой стороны, обладают способностью делиться в течение неопределенного периода времени и давать начало специализированным клеткам. Их лучше всего описать в контексте нормального человеческого развития.[нужна цитата ]
Развитие начинается, когда сперма удобряет яйцо и создает одну клетку, которая может сформировать целый организм. В первые часы после оплодотворения эта клетка делится на идентичные клетки. У человека примерно через четыре дня после оплодотворения и после нескольких циклов клеточного деления эти клетки начинают специализироваться, образуя полую сферу клеток, называемую бластоциста.[8] Бластоциста имеет внешний слой клеток, а внутри этой полой сферы находится кластер клеток, называемый внутренняя клеточная масса. Клетки внутренней клеточной массы продолжают формировать практически все ткани человеческого тела. Хотя клетки внутренней клеточной массы могут образовывать практически все типы клеток человеческого тела, они не могут образовывать организм. Эти клетки называются плюрипотентный.[9]
Плюрипотентные стволовые клетки подвергаются дальнейшей специализации на мультипотентный клетки-предшественники которые затем дают начало функциональным клеткам. Примеры стволовых клеток и клеток-предшественников включают:[нужна цитата ]
- Радиальные глиальные клетки (эмбриональные нервные стволовые клетки), которые дают возбуждающие нейроны в мозге плода в процессе нейрогенез.[10][11][12]
- Гематопоэтические стволовые клетки (взрослые стволовые клетки) из Костный мозг которые приводят к красные кровяные клетки, белые кровяные клетки, и тромбоциты
- Мезенхимальные стволовые клетки (взрослые стволовые клетки) из Костный мозг которые дают начало стромальным клеткам, жировым клеткам и типам костных клеток
- Эпителиальный стволовые клетки (клетки-предшественники), которые дают начало различным типам клеток кожи
- Мышцы спутниковые ячейки (клетки-предшественники), которые способствуют дифференцировке мышечная ткань.
Путь, который управляется молекулами клеточной адгезии, состоящими из четырех аминокислот, аргинин, глицин, аспарагин, и серин, создается как клеточный бластомер отличает из однослойных бластула к трем основным слои половых клеток у млекопитающих, а именно эктодерма, мезодерма и энтодерма (перечислены от самого дистального (внешнего) до проксимального (внутреннего)). Эктодерма образует кожу и нервную систему, мезодерма образует кости и мышечную ткань, а энтодерма образует ткани внутренних органов.
Дедифференциация

Дедифференциация, или интеграция - это клеточный процесс, часто наблюдаемый в базальный формы жизни, такие как черви и амфибии при котором частично или окончательно дифференцированная клетка возвращается на более раннюю стадию развития, обычно как часть регенеративный обработать.[13][14] Дедифференцировка происходит и у растений.[15] Ячейки в культура клеток могут потерять свойства, которыми они изначально обладали, такие как экспрессия белка, или изменить форму. Этот процесс также называют дедифференцировкой.[16]
Некоторые считают, что дедифференцировка - это отклонение от нормального цикла разработки, которое приводит к рак,[17] в то время как другие считают, что это естественная часть иммунного ответа, утраченного людьми в какой-то момент в результате эволюции.
Небольшая молекула, названная обратный, а пурин аналог, был обнаружен, который, как было доказано, вызывает дедифференцировку в миотрубки. Эти дедифференцированные клетки могли затем повторно дифференцироваться в остеобласты и адипоциты.[18]

Механизмы

Каждый специализированный тип ячейки в организме выражает а подмножество из всех гены которые составляют геном того, что виды. Каждый тип ячейки определяется своим конкретным шаблоном регулируемая экспрессия генов. Таким образом, дифференцировка клеток представляет собой переход клетки от одного типа клеток к другому и включает переключение с одного паттерна экспрессии гена на другой. Клеточную дифференциацию в процессе развития можно понять как результат сеть регуляции генов. Регуляторный ген и его цис-регуляторные модули являются узлами в регуляторной сети генов; они получают ввод и создают вывод в другом месте сети.[19] В системная биология Подход к биологии развития подчеркивает важность изучения того, как механизмы развития взаимодействуют, создавая предсказуемые паттерны (морфогенез ). Однако недавно была предложена альтернативная точка зрения.[когда? ][кем? ]. На основе стохастический экспрессия генов, клеточная дифференцировка - результат дарвиновского избирательного процесса, происходящего среди клеток. В этом контексте белковые и генные сети являются результатом клеточных процессов, а не их причиной.[нужна цитата ]
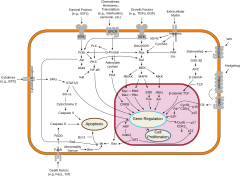
В то время как эволюционно консервативные молекулярные процессы участвуют в клеточных механизмах, лежащих в основе этих переключателей, в животное виды они сильно отличаются от хорошо охарактеризованных механизмы регуляции генов из бактерии, и даже от ближайших к ним животных одноклеточные родственники.[20] В частности, дифференцировка клеток у животных сильно зависит от биомолекулярные конденсаты регуляторных белков и усилитель Последовательности ДНК.
Клеточная дифференцировка часто контролируется клеточная сигнализация. Многие из сигнальных молекул, которые передают информацию от клетки к клетке во время контроля клеточной дифференцировки, называются факторы роста. Хотя подробности конкретных преобразование сигнала пути различаются, эти пути часто разделяют следующие общие этапы. Лиганд, продуцируемый одной клеткой, связывается с рецептором во внеклеточной области другой клетки, вызывая конформационное изменение рецептора. Форма цитоплазматического домена рецептора изменяется, и рецептор приобретает ферментативную активность. Затем рецептор катализирует реакции, которые фосфорилируют другие белки, активируя их. Каскад реакций фосфорилирования в конечном итоге активирует спящий фактор транскрипции или цитоскелетный белок, тем самым внося свой вклад в процесс дифференцировки в клетке-мишени.[21] Клетки и ткани могут различаться по компетенции, своей способности реагировать на внешние сигналы.[22]
Индукция сигнала относится к каскадам сигнализация события, во время которых клетка или ткань передает сигнал другой клетке или ткани, чтобы повлиять на ее судьбу в процессе развития.[22] Ямамото и Джеффри[23] исследовал роль хрусталика в формировании глаз у пещерных и поверхностных рыб, что стало ярким примером индукции.[22] Посредством взаимной трансплантации Ямамото и Джеффри[23] обнаружили, что везикула хрусталика у поверхностных рыб может вызывать развитие других частей глаза у пещерных и поверхностных рыб, в то время как везикула хрусталика у пещерных рыб - нет.[22]
Другие важные механизмы подпадают под категорию асимметричные деления клеток, деления, дающие начало дочерним клеткам с разными судьбами развития. Асимметричные деления клеток могут происходить из-за асимметрично выраженного материнского цитоплазматические детерминанты или из-за сигнализации.[22] В первом механизме отдельные дочерние клетки создаются во время цитокинез из-за неравномерного распределения регуляторных молекул в родительской клетке; отличная цитоплазма, которую наследует каждая дочерняя клетка, приводит к определенному паттерну дифференцировки для каждой дочерней клетки. Хорошо изученный пример формирования рисунка асимметричным делением: Построение осей тела у Drosophila. РНК молекулы являются важным типом сигнала контроля внутриклеточной дифференцировки. Молекулярно-генетические основы асимметричного деления клеток также были изучены у зеленых водорослей рода Volvox, модельная система для изучения того, как одноклеточные организмы могут эволюционировать в многоклеточные.[22] В Volvox carteri16 клеток в переднем полушарии 32-клеточного эмбриона делятся асимметрично, каждая из которых производит одну большую и одну маленькую дочерние клетки. Размер клетки в конце всех клеточных делений определяет, станет ли она специализированной зародышевой или соматической клеткой.[22][24]
Эпигенетический контроль
Поскольку каждая ячейка, независимо от типа ячейки, обладает одинаковым геном, определение типа клетки должно происходить на уровне ген выражение. В то время регуляция экспрессии генов может происходить через цис- и трансрегуляторные элементы включая гены промоутер и усилители, возникает проблема, как этот паттерн экспрессии сохраняется на протяжении многих поколений деление клеток. Как выясняется из, эпигенетический процессы играют решающую роль в регулировании решения принять судьбу стволовых, предшественников или зрелых клеток. В этом разделе основное внимание будет уделено млекопитающее стволовые клетки.
В системной биологии и математическом моделировании сетей регуляции генов предполагается, что определение судьбы клетки будет демонстрировать определенную динамику, такую как конвергенция аттрактора (аттрактор может быть точкой равновесия, предельным циклом или странный аттрактор ) или колебательный.[25]
Важность эпигенетического контроля
Первый вопрос, который можно задать, - это степень и сложность роли эпигенетических процессов в детерминации клеточной судьбы. Четкий ответ на этот вопрос можно увидеть в статье Листера Р. и другие. [26] об аберрантном эпигеномном программировании в человек индуцированные плюрипотентные стволовые клетки. Считается, что индуцированные плюрипотентные стволовые клетки (ИПСК) имитируют эмбриональные стволовые клетки по своим плюрипотентным свойствам между ними должно существовать несколько эпигенетических различий. Чтобы проверить это предсказание, авторы провели полногеномное профилирование Метилирование ДНК паттерны в нескольких линиях эмбриональных стволовых клеток человека (ESC), ИПСК и клеточных линиях предшественников.
женский жировой клетки легкое фибробласты, а фибробласты крайней плоти были перепрограммированы в индуцированное плюрипотентное состояние с помощью 4 октября, SOX2, KLF4, и МОЙ С гены. Сравнивались паттерны метилирования ДНК в ЭСК, ИПСК, соматических клетках. Lister R, и другие. наблюдали значительное сходство в уровнях метилирования между эмбриональными и индуцированными плюрипотентными клетками. Около 80% Динуклеотиды CG в ESC и iPSC были метилированы, то же самое верно только для 60% динуклеотидов CG в соматических клетках. Кроме того, соматические клетки обладали минимальными уровнями метилирования цитозина в динуклеотидах, не относящихся к CG, в то время как индуцированные плюрипотентные клетки обладали такими же уровнями метилирования, как и эмбриональные стволовые клетки, от 0,5 до 1,5%. Таким образом, в соответствии с их соответствующей транскрипционной активностью,[26] Паттерны метилирования ДНК, по крайней мере, на геномном уровне, подобны между ESC и iPSC.
Однако при более тщательном изучении паттернов метилирования авт. Обнаружили 1175 областей дифференциального метилирования динуклеотидов CG между по крайней мере одной линией ES или iPS клеток. Сравнивая эти области дифференциального метилирования с областями метилирования цитозина в исходных соматических клетках, 44-49% дифференциально метилированных областей отражали паттерны метилирования соответствующих соматических клеток-предшественников, в то время как 51-56% этих областей не были похожи на обоих предшественников. и линии эмбриональных клеток. В пробирке -индуцированная дифференцировка линий ИПСК привела к передаче 88% и 46% гипер- и гипометилированных дифференциально метилированных областей, соответственно.
Из этого исследования легко сделать два вывода. Во-первых, эпигенетические процессы в значительной степени вовлечены в определение клеточной судьбы, как видно из аналогичных уровней метилирования цитозина между индуцированными плюрипотентными и эмбриональными стволовыми клетками, что согласуется с их соответствующими паттернами транскрипция. Во-вторых, механизмы дедифференцировки (и, как следствие, дифференцировки) очень сложны и не могут быть легко дублированы, как видно по значительному количеству дифференциально метилированных областей между линиями ES и iPS клеток. Теперь, когда эти два момента установлены, мы можем изучить некоторые эпигенетические механизмы, которые, как считается, регулируют клеточную дифференцировку.
Механизмы эпигенетической регуляции
Фактор первопроходца | Факторы первопроходца (Oct4, Sox2, Nanog)
Три фактора транскрипции, OCT4, SOX2 и NANOG - первые два из которых используются в репрограммировании индуцированных плюрипотентных стволовых клеток (ИПСК), наряду с Klf4 и c-Myc - высоко экспрессируются в недифференцированных эмбриональных стволовых клетках и необходимы для поддержания их плюрипотентность.[27] Считается, что они достигают этого за счет изменений в хроматин структура, такая как гистоновая модификация и метилирование ДНК, чтобы ограничить или разрешить транскрипцию генов-мишеней. Несмотря на высокую экспрессию, их уровни требуют точного баланса для поддержания плюрипотентности, нарушение которого будет способствовать дифференцировке в разные клоны в зависимости от того, как меняются уровни экспрессии генов. Дифференциальное регулирование Октябрь-4 и SOX2 уровни, как было показано, предшествуют выбору судьбы зародышевого листка.[28] Повышенные уровни Oct4 и пониженные уровни Sox2 способствуют мезэндодермальный судьба, при этом Oct4 активно подавляет гены, связанные с нейронной эктодермальный судьба. Сходным образом, повышенные уровни Sox2 и пониженные уровни Oct4 способствуют дифференцировке в направлении нейральной эктодермальной судьбы, при этом Sox2 ингибирует дифференцировку в сторону мезэндодермальной судьбы. Независимо от клона клетки дифференцируются вниз, подавление NANOG был определен как необходимое условие для дифференциации.[28]
Репрессивный комплекс Polycomb (PRC2)
В сфере подавление гена, Поликомб репрессивный комплекс 2, один из двух классов Группа Поликомб (PcG) семейство белков, катализирует ди- и три-метилирование лизина 27 гистона H3 (H3K27me2 / me3).[27][29][30] Связываясь с нуклеосомой, меченной H3K27me2 / 3, PRC1 (также комплекс белков семейства PcG) катализирует моноубиквитинилирование гистона H2A по лизину 119 (H2AK119Ub1), блокируя РНК-полимераза II активности и приводит к подавлению транскрипции.[27] Нокаутные по PcG ES-клетки не дифференцируются эффективно в три зародышевых листка, а делеция генов PRC1 и PRC2 приводит к повышенной экспрессии генов, связанных с клонами, и незапланированной дифференцировке.[27] Предположительно, комплексы PcG ответственны за репрессию транскрипции, дифференцировку и гены, способствующие развитию.
Белки группы Trithorax (TrxG)
С другой стороны, при получении сигналов дифференцировки белки PcG рекрутируются на промоторы факторов транскрипции плюрипотентности. PcG-дефицитные ES-клетки могут начать дифференцировку, но не могут поддерживать дифференцированный фенотип.[27] Одновременно гены, способствующие дифференцировке и развитию, активируются регуляторами хроматина группы Trithorax (TrxG) и теряют репрессию.[27][30] Белки TrxG рекрутируются в областях с высокой транскрипционной активностью, где они катализируют триметилирование гистона H3 лизина 4 (H3K4me3 ) и способствуют активации гена за счет ацетилирования гистонов.[30] Комплексы PcG и TrxG вовлечены в прямую конкуренцию и считаются функционально антагонистическими, создавая при дифференцировке и развитии локусы, которые называют «двухвалентным доменом», и делая эти гены чувствительными к быстрой индукции или репрессии.[31]
Метилирование ДНК
Регуляция экспрессии генов дополнительно достигается за счет метилирования ДНК, при котором ДНК-метилтрансфераза -опосредованное метилирование остатков цитозина в динуклеотидах CpG поддерживает наследуемую репрессию, контролируя доступность ДНК.[31] Большинство сайтов CpG в эмбриональных стволовых клетках неметилированы и, по-видимому, связаны с нуклеосомами, несущими H3K4me3.[27] После дифференцировки небольшое количество генов, включая OCT4 и NANOG,[31] метилированы, а их промоторы репрессированы, чтобы предотвратить их дальнейшую экспрессию. Соответственно, эмбриональные стволовые клетки с дефицитом метилирования ДНК быстро попадают в апоптоз при дифференцировке in vitro.[27]
Расположение нуклеосом
В то время Последовательность ДНК большинства клеток организма одинаковы, паттерны связывания факторов транскрипции и соответствующие паттерны экспрессии генов различны. В значительной степени различия в связывании факторов транскрипции определяются доступностью хроматина их сайтов связывания через гистоновая модификация и / или пионерские факторы. В частности, важно знать, есть ли нуклеосома покрывает данный сайт связывания генома или нет. Это можно определить с помощью иммунопреципитация хроматина (ChIP) анализ.[32]
Ацетилирование и метилирование гистонов
ДНК-нуклеосомные взаимодействия характеризуются двумя состояниями: либо прочно связанными нуклеосомами, либо транскрипционно неактивными, называемыми гетерохроматин, или слабо связанный и обычно, но не всегда транскрипционно активный, называется эухроматин. Эти изменения в первую очередь объясняются эпигенетическими процессами метилирования и ацетилирования гистонов, а также их обратными деметилированием и деацетилированием. Эффекты ацетилирования и деацетилирования более предсказуемы. Ацетильная группа либо добавляется к положительно заряженным остаткам лизина в гистонах, либо удаляется из них с помощью ферментов, называемых гистоновые ацетилтрансферазы или гистоновые деактеилазы соответственно. Ацетильная группа предотвращает ассоциацию лизина с отрицательно заряженным остовом ДНК. Метилирование не так просто, поскольку ни метилирование, ни деметилирование не коррелируют с активацией или репрессией гена. Однако неоднократно было показано, что определенные метилирования либо активируют, либо репрессируют гены. Триметилирование лизина 4 на гистоне 3 (H3K4Me3) связано с активацией гена, тогда как триметилирование лизина 27 на гистоне 3 репрессирует гены.[33][34][35]
В стволовых клетках
Во время дифференциации стволовые клетки изменить профили экспрессии генов. Недавние исследования выявили роль позиционирования нуклеосом и модификаций гистонов во время этого процесса.[36] Есть два компонента этого процесса: выключение экспрессии генов эмбриональных стволовых клеток (ESC) и активация генов клеточных судеб. Лизинспецифическая деметилаза 1 (KDM1A ) считается, что предотвращает использование усилитель участки генов плюрипотентности, тем самым подавляя их транскрипцию.[37] Он взаимодействует с Комплекс Ми-2 / NuRD (ремоделирование нуклеосом и гистондеацетилаза) комплекс,[37] дающий пример, когда метилирование и ацетилирование не являются дискретными и взаимоисключающими, а являются взаимосвязанными процессами.
Роль передачи сигналов в эпигенетическом контроле
Последний вопрос, который следует задать, касается роли клеточная сигнализация во влиянии на эпигенетические процессы, управляющие дифференцировкой. Такая роль должна существовать, поскольку было бы разумно думать, что внешняя передача сигналов может приводить к эпигенетическому ремоделированию, точно так же, как она может приводить к изменениям в экспрессии генов посредством активации или репрессии различных факторов транскрипции. Доступных прямых данных о конкретных сигналах, влияющих на эпигеном, и большая часть текущих знаний об этом предмете состоит из предположений о вероятных кандидатах в регуляторы эпигенетического ремоделирования.[38] Сначала мы обсудим несколько основных кандидатов, которые, как считается, участвуют в индукции и поддержании как эмбриональных стволовых клеток, так и их дифференцированного потомства, а затем обратимся к одному из примеров конкретных сигнальных путей, в которых существуют более прямые доказательства их роли в эпигенетических изменениях.
Первый крупный кандидат Сигнальный путь Wnt. Путь Wnt участвует во всех стадиях дифференцировки, и лиганд Wnt3a может заменять сверхэкспрессию c-Myc в генерации индуцированных плюрипотентных стволовых клеток.[38] С другой стороны, нарушение бета-катенин, компонент сигнального пути Wnt, приводит к снижению пролиферации нейральных предшественников.
Факторы роста составляют второй основной набор кандидатов в эпигенетические регуляторы клеточной дифференцировки. Эти морфогены имеют решающее значение для развития и включают: костные морфогенетические белки, трансформирующие факторы роста (TGFs) и факторы роста фибробластов (FGFs). Было показано, что TGF и FGF поддерживают экспрессию OCT4, SOX2 и NANOG за счет передачи сигналов ниже по течению. Smad белки.[38] Истощение факторов роста способствует дифференцировке ESC, в то время как гены с двухвалентным хроматином могут становиться более ограничительными или разрешающими в своей транскрипции.[38]
Несколько других сигнальных путей также считаются первичными кандидатами. Цитокин факторы ингибирования лейкемии связаны с поддержанием ESC мыши в недифференцированном состоянии. Это достигается за счет активации пути Jak-STAT3, который, как было показано, необходим и достаточен для поддержания плюрипотентности мышиных ESC.[39] Ретиноевой кислоты может вызывать дифференцировку ЭСК человека и мыши,[38] и Notch сигнализация участвует в пролиферации и самообновлении стволовых клеток. В заключение, Соник ежик, помимо своей роли морфогена, способствует дифференцировке эмбриональных стволовых клеток и самообновлению соматических стволовых клеток.[38]
Проблема, конечно, в том, что кандидатура этих сигнальных путей была сделана в первую очередь на основании их роли в развитии и дифференцировке клеток. Хотя эпигенетическая регуляция необходима для управления клеточной дифференцировкой, их, безусловно, недостаточно для этого процесса. Прямая модуляция экспрессии генов посредством модификации факторов транскрипции играет ключевую роль, которую следует отличать от наследственных эпигенетических изменений, которые могут сохраняться даже в отсутствие исходных сигналов окружающей среды. В настоящее время существует лишь несколько примеров сигнальных путей, ведущих к эпигенетическим изменениям, которые изменяют судьбу клеток, и мы сосредоточимся на одном из них.
Выражение Shh (Sonic hedgehog) усиливает выработку ИМТ1, компонент комплекса PcG, распознающий H3K27me3. Это происходит Gli-зависимым образом, так как Gli1 и Gli2 являются последующими эффекторами Сигнальный путь ежа. В культуре Bmi1 опосредует способность пути Hedgehog способствовать самообновлению стволовых клеток молочной железы человека.[40] Как у людей, так и у мышей, исследователи показали, что Bmi1 сильно экспрессируется в пролиферирующих незрелых предшественниках гранулярных клеток мозжечка. Когда Bmi1 был нокаутирован у мышей, это привело к нарушению развития мозжечка, что привело к значительному снижению постнатальной массы мозга наряду с нарушениями в моторном контроле и поведении.[41] Отдельное исследование показало значительное снижение пролиферации нервных стволовых клеток наряду с увеличением пролиферации астроцитов у Bmi нулевых мышей.[42]
Альтернативная модель клеточной дифференцировки во время эмбриогенеза заключается в том, что позиционная информация основана на механической передаче сигналов цитоскелетом с использованием Волны эмбриональной дифференциации. Затем механический сигнал эпигенетически трансдуцируется через системы передачи сигнала (частью которых являются определенные молекулы, такие как Wnt), что приводит к дифференциальной экспрессии генов.
Таким образом, роль передачи сигналов в эпигенетическом контроле клеточных судеб у млекопитающих в значительной степени неизвестна, но существуют отдельные примеры, указывающие на вероятное существование других таких механизмов.
Влияние эластичности матрицы
Известно, что для выполнения цели регенерации различных тканей взрослые стебли мигрируют из своих ниш, прикрепляются к новым внеклеточным матрицам (ECM) и дифференцируются. Пластичность этих микроокружений уникальна для разных типов тканей. ВЦМ, окружающие мозг, мышцы и костные ткани, варьируются от мягких до жестких. Трансдукция стволовых клеток в эти типы клеток направляется не только сигналами хемокинов и передачей сигналов от клетки к клетке. Эластичность микросреды также может влиять на дифференцировку мезенхимальных стволовых клеток (МСК, которые происходят в костном мозге). Когда МСК помещаются на субстраты такой же жесткости, как мозг, мышцы и костные внеклеточные клетки, МСК приобретают свойства соответствующих клеток. типы.[43]Матричное зондирование требует, чтобы клетка прижалась к матрице в очаговых адгезиях, что запускает клеточный механопреобразователь для генерации сигнала, который сообщает, какая сила необходима для деформации матрицы. Чтобы определить ключевых игроков в спецификации происхождения на основе эластичности матрикса в MSC, были воспроизведены различные микросреды матрикса. Из этих экспериментов был сделан вывод, что фокальные адгезии МСК были клеточным механопреобразователем, воспринимающим различия в эластичности матрикса. Немышечные изоформы миозина IIa-c генерируют силы в клетке, которые приводят к передаче сигналов маркеров ранней приверженности. Немышечный миозин IIa генерирует наименьшее увеличение силы для немышечного миозина IIc. В клетке также есть факторы, которые ингибируют немышечный миозин II, такие как блеббистатин. Это делает клетку практически слепой к окружающей матрице.[43]Исследователи добились определенного успеха в создании свойств, подобных стволовым клеткам, в клетках HEK 239 за счет создания мягкого матрикса без использования факторов диффузии.[44] Свойства стволовых клеток, по-видимому, связаны с напряжением в актиновой сети клеток. Один идентифицированный механизм индуцированной матрицей дифференцировки - это индуцированные натяжением белки, которые ремоделируют хроматин в ответ на механическое растяжение.[45] Путь RhoA также участвует в этом процессе.
Смотрите также
- Межслойные силы в слиянии мембран
- Механизм Fusion
- Липидный бислой слияния
- Клеточно-клеточные фузогены
- CAF-1
- Список типов клеток человека, полученных из зародышевых листков
использованная литература
- ^ Кривень, И .; Röblitz, S .; Schütte, Ch. (2015). «Решение главного химического уравнения путем аппроксимации радиальных базисных функций с отслеживанием границ раздела». BMC Systems Biology. 9 (1): 67. Дои:10.1186 / s12918-015-0210-у. ЧВК 4599742. PMID 26449665.

- ^ Slack, J.M.W. (2013) Основная биология развития. Уайли-Блэквелл, Оксфорд.
- ^ Slack, J.M.W. (2007). «Метаплазия и трансдифференцировка: от чистой биологии к клинике». Обзоры природы Молекулярная клеточная биология. 8 (5): 369–378. Дои:10.1038 / nrm2146. PMID 17377526. S2CID 3353748.
- ^ Такахаши, К. Яманака, S (2006). «Индукция плюрипотентных стволовых клеток из эмбриональных и взрослых культур фибробластов мыши с помощью определенных факторов». Ячейка. 126 (4): 663–76. Дои:10.1016 / j.cell.2006.07.024. HDL:2433/159777. PMID 16904174. S2CID 1565219.
- ^ а б c Шелер, Ханс Р. (2007). «Возможности стволовых клеток: перечень». В Николаусе Кнёпффлере; Дагмар Шипански; Стефан Лоренц Зоргнер (ред.). Человеческие биотехнологии как социальный вызов. Издательство Ashgate. п. 28. ISBN 978-0-7546-5755-2.
- ^ "Словарь терминов по раку NCI". Национальный институт рака. Получено 1 ноября 2013.
- ^ Лодиш, Харви (2000). Молекулярная клеточная биология (4-е изд.). Нью-Йорк: У. Х. Фриман. Раздел 14.2. ISBN 978-0-7167-3136-8.
- ^ Кумар, Рани (2008). Учебник эмбриологии человека. И.К. Международный издательский дом. п. 22. ISBN 9788190675710.
- ^ Д. Биндер, Марк; Хирокава, Нобутака; Виндхорст, Уве (2009). Энциклопедия неврологии. Springer. ISBN 978-3540237358.
- ^ Ракич, П. (октябрь 2009 г.). «Эволюция неокортекса: взгляд из биологии развития». Обзоры природы. Неврология. 10 (10): 724–35. Дои:10.1038 / nrn2719. ЧВК 2913577. PMID 19763105.
- ^ Луи, JH; Hansen, DV; Кригштейн, АР (8 июля 2011 г.). «Развитие и эволюция неокортекса человека». Ячейка. 146 (1): 18–36. Дои:10.1016 / j.cell.2011.06.030. ЧВК 3610574. PMID 21729779.
- ^ Сыпь, БГ; Акман, JB; Ракич, П. (февраль 2016 г.). «Двунаправленная радиальная активность Са (2+) регулирует нейрогенез и миграцию во время раннего формирования кортикального столба». Достижения науки. 2 (2): e1501733. Bibcode:2016SciA .... 2E1733R. Дои:10.1126 / sciadv.1501733. ЧВК 4771444. PMID 26933693.
- ^ Стокум Д.Л. (2004). «Регенерация амфибий и стволовые клетки». Curr. Верхний. Microbiol. Иммунол. Актуальные темы микробиологии и иммунологии. 280: 1–70. Дои:10.1007/978-3-642-18846-6_1. ISBN 978-3-540-02238-1. PMID 14594207.
- ^ Казимир С.М., Гейтс ПБ, Пациент Р.К., Брокес Дж. П. (1988-12-01). «Доказательства дедифференцировки и метаплазии в регенерации конечностей земноводных в результате наследования метилирования ДНК». Развитие. 104 (4): 657–668. PMID 3268408.
- ^ Джайлз К.Л. (1971). «Дедифференцировка и регенерация мохообразных: выборочный обзор». Новозеландский ботанический журнал. 9 (4): 689–94. Дои:10.1080 / 0028825x0.1971.10430231. Архивировано из оригинал на 2008-12-04. Получено 2008-01-01.
- ^ Шнабель М., Марловиц С., Экхофф Г. и др. (Январь 2002 г.). «Связанные с дедифференцировкой изменения морфологии и экспрессии генов в первичных суставных хондроцитах человека в культуре клеток». Osteoarthr. Хрящ. 10 (1): 62–70. Дои:10.1053 / joca.2001.0482. PMID 11795984.
- ^ Продать S (декабрь 1993 г.). "Клеточное происхождение рака: дедифференцировка или задержка созревания стволовых клеток?". Environ. Перспектива здоровья. 101 (Дополнение 5): 15–26. Дои:10.2307/3431838. JSTOR 3431838. ЧВК 1519468. PMID 7516873.
- ^ Цонис П.А. (апрель 2004 г.). «Стволовые клетки из дифференцированных клеток». Мол. Интервал. 4 (2): 81–3. Дои:10.1124 / миль 4.2.4. PMID 15087480. Архивировано из оригинал на 2016-05-23. Получено 2010-12-26.
- ^ Бен-Табу де-Леон С., Дэвидсон Э. Х. (2007). «Регулирование генов: сеть контроля генов в разработке» (PDF). Annu Rev Biophys Biomol Struct. 36 (191): 191–212. Дои:10.1146 / annurev.biophys.35.040405.102002. PMID 17291181.
- ^ Ньюман, Стюарт А. (2020). «Дифференциация клеток: что мы узнали за 50 лет?». Журнал теоретической биологии. 485: 110031. Дои:10.1016 / j.jtbi.2019.110031. PMID 31568790.
- ^ Knisely, Карен; Гилберт, Скотт Ф. (2009). Биология развития (8-е изд.). Сандерленд, Массачусетс: Sinauer Associates. п. 147. ISBN 978-0-87893-371-6.
- ^ а б c d е ж г Рудель и Соммер; Эволюция механизмов развития. Биология развития 264, 15-37, 2003 Rudel, D .; Соммер, Р. Дж. (2003). «Эволюция механизмов развития». Биология развития. 264 (1): 15–37. Дои:10.1016 / S0012-1606 (03) 00353-1. PMID 14623229.
- ^ а б Ямамото Ю. и В. Р. Джеффри; Центральная роль хрусталика в дегенерации глаза пещерной рыбы. Наука 289 (5479), 631-633, 2000 Yamamoto, Y .; Джеффри, В. Р. (2000). «Центральная роль линзы в дегенерации пещерных рыбьих глаз». Наука. 289 (5479): 631–633. Bibcode:2000Sci ... 289..631Y. Дои:10.1126 / science.289.5479.631. PMID 10915628.
- ^ Кирк М.М., Рэнсик, С.Е. Макрэй, Д.Л. Кирк; Взаимосвязь между размером клетки и судьбой клетки в Volvox carteri. Журнал клеточной биологии 123, 191-208, 1993 Кирк, М. М .; Ransick, A .; McRae, S.E .; Кирк, Д. Л. (1993). «Взаимосвязь между размером клеток и их судьбой у Volvox carteri». Журнал клеточной биологии. 123 (1): 191–208. Дои:10.1083 / jcb.123.1.191. ЧВК 2119814. PMID 8408198.
- ^ Рабаджанте Дж. Ф., Бабьерра А. Л. (30 января 2015 г.). «Ветвление и колебания в эпигенетическом ландшафте детерминации клеточной судьбы». Прогресс в биофизике и молекулярной биологии. 117 (2–3): 240–9. Дои:10.1016 / j.pbiomolbio.2015.01.006. PMID 25641423.
- ^ а б Lister R; и другие. (2011). «Горячие точки аберрантного эпигеномного репрограммирования в индуцированных человеком плюрипотентных стволовых клетках». Природа. 471 (7336): 68–73. Bibcode:2011Натура 471 ... 68л. Дои:10.1038 / природа09798. ЧВК 3100360. PMID 21289626.
- ^ а б c d е ж г час Кристоферсен Н.С., Хелин К. (2010). «Эпигенетический контроль судьбы эмбриональных стволовых клеток». J Exp Med. 207 (11): 2287–95. Дои:10.1084 / jem.20101438. ЧВК 2964577. PMID 20975044.
- ^ а б Томсон, М; Liu, S.J .; Zou, L.N .; Смит, Z; Мейснер, А; Раманатан, S (2011). «Факторы плюрипотентности в эмбриональных стволовых клетках регулируют дифференцировку в зародышевые листы». Ячейка. 145 (6): 875–89. Дои:10.1016 / j.cell.2011.05.017. ЧВК 5603300. PMID 21663792.
- ^ Zhu, J .; и другие. (2013). «Полногеномные переходы состояний хроматина, связанные с сигналами развития и окружающей среды». Ячейка. 152 (3): 642–654. Дои:10.1016 / j.cell.2012.12.033. ЧВК 3563935. PMID 23333102.
- ^ а б c Гюнтер М.Г., Янг Р.А. (2010). «Репрессивная транскрипция» (PDF). Наука. 329 (5988): 150–1. Bibcode:2010Sci ... 329..150G. Дои:10.1126 / science.1193995. ЧВК 3006433. PMID 20616255.
- ^ а б c Мейснер А (2010). «Эпигенетические модификации плюрипотентных и дифференцированных клеток». Nat Biotechnol. 28 (10): 1079–88. Дои:10.1038 / nbt.1684. PMID 20944600. S2CID 205274850.
- ^ Обзор чипа
- ^ Кроган Нью-Джерси, Довер Дж., Вуд А., Шнайдер Дж., Хайдт Дж., Боатенг М.А., Дин К., Райан О.В., Гольшани А., Джонстон М., Гринблатт Дж. Ф., Шилатифард А. (март 2003 г.). «Комплекс Paf1 необходим для метилирования гистона H3 с помощью COMPASS и Dot1p: связывание удлинения транскрипции с метилированием гистона». Молекулярная клетка. 11 (3): 721–9. Дои:10.1016 / S1097-2765 (03) 00091-1. PMID 12667454.
- ^ Нг Х. Х., Роберт Ф., Янг Р. А., Струль К. (март 2003 г.). «Целенаправленное рекрутирование Set1 гистоновой метилазы путем удлинения Pol II обеспечивает локализованную метку и память о недавней транскрипционной активности». Молекулярная клетка. 11 (3): 709–19. Дои:10.1016 / S1097-2765 (03) 00092-3. PMID 12667453.
- ^ Бернштейн Б.Е., Камаль М., Линдблад-Тох К., Бекиранов С., Бейли Д.К., Хьюберт Д.Д., МакМахон С., Карлссон Е.К., Кульбокас Е.Дж., Джингерас Т.Р., Шрайбер С.Л., Ландер ES (январь 2005 г.). «Геномные карты и сравнительный анализ модификаций гистонов у человека и мыши». Ячейка. 120 (2): 169–81. Дои:10.1016 / j.cell.2005.01.001. PMID 15680324. S2CID 7193829.
- ^ Тейф В.Б., Вайнштейн Ю., Кодрон-Хергер М., Маллм Дж. П., Март С., Хёфер Т., Риппе К. (2012). «Позиционирование нуклеосом по всему геному во время развития эмбриональных стволовых клеток». Нат Структ Мол Биол. 19 (11): 1185–92. Дои:10.1038 / nsmb.2419. PMID 23085715. S2CID 34509771.
- ^ а б Уайт, В. А .; Билодо, S; Орландо, Д. А .; Hoke, H.A .; Frampton, G.M .; Foster, C.T .; Cowley, S.M .; Янг, Р. А. (2012). «Вывод из эксплуатации усилителя LSD1 во время дифференцировки эмбриональных стволовых клеток». Природа. 482 (7384): 221–5. Bibcode:2012Натура 482..221Вт. Дои:10.1038 / природа10805. ЧВК 4144424. PMID 22297846.
- ^ а б c d е ж Мохаммад Х.П., Бейлин С.Б. (2010). «Связь клеточной сигнализации и эпигенетического аппарата». Nat Biotechnol. 28 (10): 1033–8. Дои:10.1038 / nbt1010-1033. PMID 20944593. S2CID 6911946.
- ^ Нива Х., Бурдон Т., Камеры I, Смит А. (1998). «Самообновление плюрипотентных эмбриональных стволовых клеток опосредуется активацией STAT3». Genes Dev. 12 (13): 2048–60. Дои:10.1101 / gad.12.13.2048. ЧВК 316954. PMID 9649508.
- ^ Liu S; и другие. (2006). «Передача сигналов Hedgehog и Bmi-1 регулируют самообновление нормальных и злокачественных стволовых клеток молочной железы человека». Рак Res. 66 (12): 6063–71. Дои:10.1158 / 0008-5472.CAN-06-0054. ЧВК 4386278. PMID 16778178.
- ^ Leung C; и другие. (2004). «Bmi1 необходим для развития мозжечка и избыточно экспрессируется в медуллобластомах человека». Природа. 428 (6980): 337–41. Bibcode:2004Натура.428..337L. Дои:10.1038 / природа02385. PMID 15029199. S2CID 29965488.
- ^ Zencak D; и другие. (2005). «Потеря Bmi1 вызывает увеличение количества астроглиальных клеток и уменьшение популяции и пролиферации нервных стволовых клеток». J Neurosci. 25 (24): 5774–83. Дои:10.1523 / JNEUROSCI.3452-04.2005. ЧВК 6724881. PMID 15958744.
- ^ а б Энглер, AJ; Сен, S; Суини, HL; Discher, DE (август 2006 г.). «Эластичность матрицы определяет спецификацию происхождения стволовых клеток». Ячейка. 126 (4): 677–689. Дои:10.1016 / j.cell.2006.06.044. PMID 16923388. S2CID 16109483.
- ^ Го, Цзюнь; Ван, Юэсю; Сакс, Фредерик; Мэн, Фаньцзе (9 декабря 2014 г.). «Актиновый стресс в перепрограммировании клеток». Труды Национальной академии наук. 111 (49): E5252 – E5261. Bibcode:2014PNAS..111E5252G. Дои:10.1073 / pnas.1411683111. ISSN 0027-8424. ЧВК 4267376. PMID 25422450.
- ^ Гилак, Фаршид; Коэн, Дэниел М .; Эстес, Брэдли Т .; Гимбл, Джеффри М .; Лидтке, Вольфганг; Чен, Кристофер С. (2 июля 2009 г.). «Контроль судьбы стволовых клеток посредством физического взаимодействия с внеклеточной матрицей». Стволовая клетка. 5 (1): 17–26. Дои:10.1016 / j.stem.2009.06.016. ЧВК 2768283. PMID 19570510.



