Мезенхимальные стволовые клетки - Mesenchymal stem cell
| Мезенхимальные стволовые клетки | |
|---|---|
 Передача инфекции электронная микрофотография мезенхимальных стволовых клеток, демонстрирующих типичные ультраструктурный характеристики. | |
| Подробности | |
| Идентификаторы | |
| латинский | Cellula mesenchymatica praecursoria |
| MeSH | D059630 |
| TH | H2.00.01.0.00008 |
| Анатомические термины микроанатомии | |
Мезенхимальные стволовые клетки (МСК) также известный как мезенхимальные стромальные клетки или же медицинские сигнальные клетки находятся мультипотентный стромальные клетки это может различать в различные типы клеток, в том числе остеобласты (костные клетки), хондроциты (хрящевые клетки), миоциты (мышечные клетки) и адипоциты (жировые клетки, которые вызывают жировая ткань костного мозга ).[1][2][3]
Структура
Определение
Хотя условия мезенхимальные стволовые клетки (MSC) и стромальная клетка костного мозга много лет использовались взаимозаменяемо, ни один термин не является достаточно описательным:
- Мезенхима является эмбриональный соединительная ткань что получено из мезодерма и это отличает кроветворный и соединительная ткань, тогда как МСК не дифференцируются в гемопоэтические клетки.[4]
- Стромальные клетки представляют собой клетки соединительной ткани, которые образуют поддерживающую структуру, в которой находятся функциональные клетки ткани. Хотя это точное описание одной функции МСК, этот термин не может передать относительно недавно открытую роль МСК в восстановлении ткани.[5]
- Термин охватывает мультипотентные клетки, полученные из других не-костный мозг ткани, такие как плацента,[6] пуповина кровь, жировая ткань, взрослый мышца, строма роговицы[7] или пульпа зуба лиственный (детские) зубы.[8] Клетки не способны восстановить весь орган.
Морфология
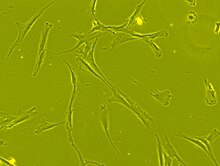

Мезенхимальные стволовые клетки морфологически характеризуются небольшим Тело клетки с несколькими клеточными отростками, длинными и тонкими. Тело клетки содержит большой круглый ядро с выдающимся ядрышко, окруженный мелкодисперсным хроматин частицы, придающие ядру четкий вид. Остальная часть тела клетки содержит небольшое количество аппарат Гольджи, шероховатой эндоплазматической сети, митохондрии и полирибосомы. Клетки длинные и тонкие, широко рассредоточены и соседние внеклеточный матрикс населен несколькими ретикулярный фибриллы, но лишены других типов коллаген фибриллы.[9][10] Эти отличительные морфологические особенности мезенхимальных стволовых клеток можно визуализировать без метки с помощью визуализации живых клеток.
Место расположения
Костный мозг
Костный мозг был первоначальным источником МСК,[11] и до сих пор является наиболее часто используемым. Эти стволовые клетки костного мозга не способствуют образованию клеток крови и, следовательно, не экспрессируют гемопоэтические стволовые клетки маркер CD34. Иногда их называют стромальные стволовые клетки костного мозга.[12]
Пуповинные клетки
Самые молодые и примитивные МСК могут быть получены из ткани пуповины, а именно Желе Уортона и пуповина пуповинная кровь. Однако в желе Wharton концентрация МСК намного выше, чем в пуповинной крови, которая является богатым источником гемопоэтические стволовые клетки. Пуповина доступна после родов. Обычно его выбрасывают и не представляют опасности для сбора. Эти МСК могут оказаться полезным источником МСК для клинического применения из-за их примитивных свойств и высокой скорости роста.[13]
Жировая ткань
Жировая ткань является еще одним источником МСК, и у них есть несколько преимуществ перед МСК костного мозга. МСК из жировой ткани (AdMSC), помимо того, что их легче и безопаснее выделять, чем МСК из костного мозга, можно получить в больших количествах.[11][14]
Молярные клетки
Развивающийся зачаток третьего моляра нижней челюсти является богатым источником МСК. Хотя они описываются как мультипотентные, вполне возможно, что они плюрипотентны. В конечном итоге они образуют эмаль, дентин, кровеносные сосуды, пульпу зуба и нервные ткани. Эти стволовые клетки способны дифференцироваться в хондроциты, кардиомиоциты, меланоциты, и гепатоцит -Подобные клетки in vitro.[8]
Амниотическая жидкость
Стволовые клетки присутствуют в амниотическая жидкость. 1 из 100 клеток, собранных во время амниоцентез представляют собой плюрипотентные мезенхимальные стволовые клетки.[15]
Функция
Способность к дифференциации
МСК обладают большой способностью к самообновлению, сохраняя при этом свою мультипотентность. Недавняя работа предполагает, что β-catenin посредством регуляции EZH2 является центральной молекулой в поддержании «стволовости» MSC.[16] Стандартный тест для подтверждения мультипотентности - это дифференциация клеток на остеобласты, адипоциты и хондроциты, а также на миоциты.
Было замечено, что МСК даже дифференцируются в нейроноподобные клетки,[17] но остаются сомнения относительно функциональности нейронов, происходящих от МСК.[18] Степень дифференциации культуры различается у разных людей и от того, как индуцируется дифференциация, например, химическая или механическая;[19] и неясно, является ли эта вариация следствием разного количества «истинных» клеток-предшественников в культуре или вариабельной способности дифференцировки предков индивидуумов. Емкость ячеек размножаться и различать как известно, уменьшается с возрастом донора, а также со временем в культуре. Точно так же неизвестно, связано ли это с уменьшением количества MSC или изменением существующих MSC.[нужна цитата ]
Иммуномодулирующие эффекты
МСК влияют на врожденные и специфические иммунные клетки. МСК продуцируют множество иммуномодулирующих молекул, включая простагландин E2 (PGE2),[20] оксид азота,[21] индоламин-2,3-диоксигеназа (Я ДЕЛАЮ), интерлейкин 6 (IL-6) и другие маркеры поверхности, такие как FasL,[22] PD-L1 и PD-L2.[23]
МСК влияют на макрофаги, нейтрофилы, NK-клетки, тучные клетки и дендритные клетки при врожденном иммунитете. МСК способны мигрировать к месту повреждения, где они поляризуются через макрофаги PGE2 в фенотипе M2, который характеризуется противовоспалительным действием.[24] Кроме того, PGE2 подавляет способность тучных клеток дегранулировать и продуцировать TNF-α.[25][26] Пролиферация и цитотоксическая активность NK-клеток ингибируется PGE2 и IDO. МСК также снижают экспрессию рецепторов NK-клеток - NKG2D, NKp44 и NKp30.[27] МСК подавляют респираторные обострения и апоптоз нейтрофилов за счет продукции цитокинов ИЛ-6 и ИЛ-8.[28] Дифференцировка и экспрессия маркеров поверхности дендритных клеток ингибируется IL-6 и PGE2 МСК.[29] Иммуносупрессивные эффекты МСК также зависят от ИЛ-10, но неясно, продуцируют ли они его в одиночку или только стимулируют выработку других клеток.[30]
МСК экспрессирует молекулы адгезии VCAM-1 и ICAM-1, которые позволяют Т-лимфоцитам прикрепляться к своей поверхности. Тогда МСК могут воздействовать на них с помощью молекул, которые имеют короткий период полураспада, и их действие находится в непосредственной близости от клетки.[21] К ним относятся оксид азота,[31] PGE2, HGF,[32] и активация рецептора PD-1.[33] МСК снижают пролиферацию Т-клеток между фазами клеточного цикла G0 и G1[34] и уменьшить экспрессию IFNγ клеток Th1 при одновременном увеличении экспрессии IL-4 клеток Th2.[35] МСК также подавляют пролиферацию В-лимфоцитов между фазами клеточного цикла G0 и G1.[33][36]
Антимикробные свойства
МСК производят несколько антимикробные пептиды (AMP) включая человека кателицидин LL-37,[37] β-дефенсины,[38] липокалин 2[39] и гепсидин.[40] Эти пептиды вместе с ферментом индоламин-2,3-диоксигеназа (IDO), отвечают за широкий спектр антибактериальной активности МСК.[41]
Клиническое значение

Мезенхимальные стволовые клетки могут активироваться и мобилизован при необходимости, но их эффективность, например, в случае восстановления мышц, в настоящее время довольно низка. Дальнейшие исследования механизмов действия МСК могут предоставить возможности для увеличения их способности к восстановлению тканей.[42][43]
Аутоиммунное заболевание
Клинические исследования, изучающие эффективность мезенхимальных стволовых клеток при лечении заболеваний, находятся в стадии предварительной разработки, особенно для понимания аутоиммунные заболевания, болезнь трансплантат против хозяина, болезнь Крона, рассеянный склероз, системная красная волчанка и системный склероз.[44][45] По состоянию на 2014 год ни одно качественное клиническое исследование не свидетельствует об эффективности, а в методах исследования существуют многочисленные несоответствия и проблемы.[45]
Прочие болезни
Многие из первых клинических успехов при использовании внутривенной трансплантации пришли к таким системным заболеваниям, как болезнь трансплантат против хозяина и сепсис. Прямая инъекция или размещение клеток в участке, нуждающемся в восстановлении, может быть предпочтительным методом лечения, поскольку сосудистая доставка страдает от «легочного эффект первого прохода «где клетки, введенные внутривенно, секвестрируются в легких.[46]
Обнаружение
Международное общество клеточной терапии (ISCT) предложило набор стандартов для определения МСК. Клетка может быть классифицирована как МСК, если она демонстрирует свойства пластической адгезии в нормальных условиях культивирования и имеет морфологию фибробластов. Фактически, некоторые утверждают, что МСК и фибробласты функционально идентичны.[47] Кроме того, МСК могут подвергаться остеогенной, адипогенной и хондрогенной дифференцировке. ex vivo. Культивированные МСК также экспрессируются на своей поверхности CD73, CD90 и CD105, при отсутствии выражения CD11b, CD14, CD19, CD34, CD45, CD79a и HLA-DR маркеры поверхности.[48]
Исследование
В большинстве современных методов культивирования по-прежнему используется подход колониеобразующих единиц фибробластов (КОЕ-Ф), когда неочищенный неочищенный костный мозг или очищенный фиколл костный мозг мононуклеарные клетки покрыты непосредственно в культура клеток тарелки или колбы. Мезенхимальные стволовые клетки, но не эритроциты или гематопоэтические клетки-предшественники, прикрепляются к пластику для тканевой культуры в течение 24-48 часов. Тем не менее, по крайней мере, одна публикация выявила популяцию неприлипающих МСК, которые не были получены методом прямого посева.[49]
Другой проточной цитометрии методы позволяют сортировать клетки костного мозга по определенным поверхностным маркерам, таким как СТРО-1.[50] Клетки STRO-1 +, как правило, более гомогенны и имеют более высокие показатели адгезии и более высокие скорости пролиферации, но точные различия между клетками STRO-1 + и МСК не ясны.[51]
Методы иммунного истощения с использованием таких методик, как MACS также использовались при отрицательной селекции МСК.[52]
Дополнение базальных сред фетальная бычья сыворотка или человек лизат тромбоцитов распространено в культуре MSC. Перед использованием лизатов тромбоцитов для посева МСК рекомендуется процесс инактивации патогенов для предотвращения передачи патогенов.[53]
Новое исследование под названием «Трансплантация сфероидов мезенхимальных стволовых клеток человека, полученных из ЭСК, облегчает спонтанный остеоартрит у макак-резусов.[54]
История
В 1924 году родился в России морфолог. Максимов Александр Александрович (русский: Александр Александрович Максимов); использовали обширные гистологические данные для идентификации особого типа клеток-предшественников в мезенхиме, которые развиваются в разные типы клеток крови.[55]
Ученые Эрнест А. Маккалох и Джеймс Э. Тилль впервые выявили клональную природу клеток костного мозга в 1960-х годах.[56][57] An ex vivo анализ для изучения клоногенного потенциала мультипотентных клеток костного мозга был позже описан в 1970-х Friedenstein и его коллегами.[58][59] В этой системе анализа стромальные клетки назывались колониеобразующими единичными фибробластами (КОЕ-f).
Первые клинические испытания МСК были завершены в 1995 году, когда группе из 15 пациентов были введены культивированные МСК для проверки безопасности лечения. С тех пор было начато более 200 клинических испытаний. Однако большинство из них все еще находятся на стадии тестирования.[6]
Последующие эксперименты показали пластичность клеток костного мозга и то, как их судьба определяется сигналами окружающей среды. Культивирование стромальных клеток костного мозга в присутствии остеогенных стимулов, таких как аскорбиновая кислота, неорганический фосфат и дексаметазон может способствовать их дифференциации на остеобласты. Напротив, добавление трансформирующий фактор роста-бета (TGF-b) может вызывать хондрогенный маркеры.[нужна цитата ]
Смотрите также
- Костный мозг
- Фибробласт
- Внутримембранозная оссификация
- Мезенхима
- Мультипотентность
- Подкладка шнуром
- Жировая ткань костного мозга (МЖТ)
- Список типов клеток человека, полученных из зародышевых листков
Рекомендации
- ^ Анкрум Дж. А., Онг Дж. Ф., Карп Дж. М. (март 2014 г.). «Мезенхимальные стволовые клетки: невосприимчивые, не иммунные». Природа Биотехнологии. 32 (3): 252–60. Дои:10.1038 / nbt.2816. ЧВК 4320647. PMID 24561556.
- ^ Махла RS (2016). «Применение стволовых клеток в регенеративной медицине и терапии болезней». Международный журнал клеточной биологии. 2016: 6940283. Дои:10.1155/2016/6940283. ЧВК 4969512. PMID 27516776.
- ^ Каплан, Арнольд И. (июнь 2017 г.). «Мезенхимальные стволовые клетки: время менять название!». Трансляционная медицина стволовых клеток. 6 (6): 1445–1451. Дои:10.1002 / sctm.17-0051. ISSN 2157-6564. ЧВК 5689741. PMID 28452204.
- ^ Порселлини А (2009). «Регенеративная медицина: обзор». Revista Brasileira de Hematologia e Hemoterapia. 31 (Приложение 2). Дои:10.1590 / S1516-84842009000800017.
- ^ Валеро М.С., Охотник HD, Лю Дж., Цзоу К., Боппарт, Мэриленд (2012). «Эксцентрические упражнения способствуют появлению мезенхимальных стволовых клеток в скелетных мышцах». PLOS ONE. 7 (1): e29760. Bibcode:2012PLoSO ... 729760V. Дои:10.1371 / journal.pone.0029760. ЧВК 3256189. PMID 22253772.
- ^ а б Ван С., Цюй Х, Чжао Р.К. (апрель 2012 г.). «Клиническое применение мезенхимальных стволовых клеток». Журнал гематологии и онкологии. 5: 19. Дои:10.1186/1756-8722-5-19. ЧВК 3416655. PMID 22546280.
- ^ Бранч MJ, Хашмани К., Диллон П., Джонс Д.Р., Дуа Х.С., Хопкинсон А. (август 2012 г.). «Мезенхимальные стволовые клетки в лимбальной строме роговицы человека». Исследовательская офтальмология и визуализация. 53 (9): 5109–16. Дои:10.1167 / iovs.11-8673. PMID 22736610.
- ^ а б Лю Дж, Ю Ф, Сунь Й, Цзян Б., Чжан В., Ян Дж, Сюй Г., Лян А., Лю С. (март 2015 г.). «Краткие обзоры: характеристики и потенциальные применения мезенхимальных стволовых клеток человека, полученных из тканей зубов». Стволовые клетки. 33 (3): 627–38. Дои:10.1002 / шток.1909. PMID 25447379.
- ^ Неттер, Фрэнк Х. (1987). Костно-мышечная система: анатомия, физиология и нарушения обмена веществ. Саммит, Нью-Джерси: Ciba-Geigy Corporation. п. 134. ISBN 978-0-914168-88-1.
- ^ Брайтон, Коннектикут, Хант Р.М. (июль 1991 г.). «Ранние гистологические и ультраструктурные изменения костной мозоли при переломе костного мозга». Журнал костной и суставной хирургии. Американский объем. 73 (6): 832–47. Дои:10.2106/00004623-199173060-00006. PMID 2071617.
- ^ а б Стриога М., Вишванатан С., Даринскас А., Слаби О., Михалек Дж. (Сентябрь 2012 г.). «То же самое или не то же самое? Сравнение мезенхимальных стволовых и стромальных клеток из жировой ткани и мезенхимальных стволовых и стромальных клеток из костного мозга». Стволовые клетки и развитие. 21 (14): 2724–52. Дои:10.1089 / scd.2011.0722. PMID 22468918.
- ^ Грегори Калифорния, Prockop DJ, Spees JL (июнь 2005 г.). «Негематопоэтические стволовые клетки костного мозга: молекулярный контроль роста и дифференцировки». Экспериментальные исследования клеток. Молекулярный контроль дифференцировки стволовых клеток. 306 (2): 330–5. Дои:10.1016 / j.yexcr.2005.03.018. PMID 15925588.
- ^ Liau LL, Ruszymah BH, Ng MH, Law JX (январь 2020 г.). "Характеристики и клиническое применение мезенхимальных стромальных клеток Wharton, полученных из желе". Текущие исследования в области трансляционной медицины. 68 (1): 5–16. Дои:10.1016 / j.retram.2019.09.001. PMID 31543433. Получено 23 мая 2020.
- ^ Баннелл Б.А., Флат М., Гальярди С., Патель Б., Рипол С. (июнь 2008 г.). «Стволовые клетки жирового происхождения: выделение, распространение и дифференциация». Методы. Методы исследования стволовых клеток. 45 (2): 115–20. Дои:10.1016 / j.ymeth.2008.03.006. ЧВК 3668445. PMID 18593609.
- ^ "Что такое пуповинная ткань?". CordAdvantage.com. 30 октября 2018.
- ^ Сен, Буэр; Рай, Кристофер Р .; Се, Чжихуэй; Шанкаран, Джейантт; Узер, Гюнес; Стайнер, Майя; Мейер, Марк; Дудакович, Амель; Wijnen, Andre J .; Рубин, Джанет (5 февраля 2020 г.). «β-катенин сохраняет стволовое состояние стромальных клеток костного мозга мышей за счет активации EZH2». Журнал исследований костей и минералов. 35 (6): 1149–1162. Дои:10.1002 / jbmr.3975. ISSN 0884-0431. ЧВК 7295671. PMID 32022326.
- ^ Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, et al. (Июль 2002 г.). «Плюрипотентность мезенхимальных стволовых клеток, полученных из костного мозга взрослого». Природа. 418 (6893): 41–9. Дои:10.1038 / природа00870. PMID 12077603. S2CID 47162269.
- ^ Франко Ламберт А. П., Фрага Зандонаи А., Бонатто Д., Кантарелли Мачадо Д., Пегас Энрикес Д. А. (март 2009 г.). «Дифференциация взрослых стволовых клеток, полученных из жировой ткани человека, в нейрональную ткань: работает ли она?». Дифференциация; Исследования в области биологического разнообразия. 77 (3): 221–8. Дои:10.1016 / j.diff.2008.10.016. PMID 19272520.
- ^ Энглер AJ, Сен S, Суини HL, Discher DE (август 2006 г.). «Эластичность матрицы определяет происхождение стволовых клеток». Клетка. 126 (4): 677–89. Дои:10.1016 / j.cell.2006.06.044. PMID 16923388. S2CID 16109483.
- ^ Спаггиари Г.М., Абдельразик Х., Беккетти Ф., Моретта Л. (июнь 2009 г.). «МСК ингибируют созревание и функцию ДК из моноцитов, избирательно вмешиваясь в образование незрелых ДК: центральная роль простагландина Е2, производного от МСК». Кровь. 113 (26): 6576–83. Дои:10.1182 / кровь-2009-02-203943. PMID 19398717.
- ^ а б Ren G, Zhao X, Zhang L, Zhang J, L'Huillier A, Ling W и др. (Март 2010 г.). «Воспалительные цитокин-индуцированные молекула-1 межклеточной адгезии и молекула-1 адгезии сосудистых клеток в мезенхимальных стволовых клетках имеют решающее значение для иммуносупрессии». Журнал иммунологии. 184 (5): 2321–8. Дои:10.4049 / jimmunol.0902023. ЧВК 2881946. PMID 20130212.
- ^ Akiyama K, Chen C, Wang D, Xu X, Qu C, Yamaza T и др. (Май 2012 г.). «Иммунорегуляция, индуцированная мезенхимальными стволовыми клетками, включает апоптоз Т-клеток, опосредованный FAS-лигандом / FAS». Стволовая клетка. 10 (5): 544–55. Дои:10.1016 / j.stem.2012.03.007. ЧВК 3348385. PMID 22542159.
- ^ Дэвис Л.С., Хелдринг Н., Кадри Н., Ле Блан К. (март 2017 г.). «Секреция мезенхимальными стромальными клетками лигандов запрограммированной смерти-1 регулирует иммуносупрессию, опосредованную Т-клетками». Стволовые клетки. 35 (3): 766–776. Дои:10.1002 / шток.2509. ЧВК 5599995. PMID 27671847.
- ^ Ким Дж., Хематти П. (декабрь 2009 г.). «Макрофаги, образованные мезенхимальными стволовыми клетками: новый тип альтернативно активируемых макрофагов». Экспериментальная гематология. 37 (12): 1445–53. Дои:10.1016 / j.exphem.2009.09.004. ЧВК 2783735. PMID 19772890.
- ^ Браун Дж. М., Немет К., Кушнир-Сухов Н. М., Меткалф Д. Д., Мезей Е. (апрель 2011 г.). «Стромальные клетки костного мозга подавляют функцию тучных клеток посредством COX2-зависимого механизма». Клиническая и экспериментальная аллергия. 41 (4): 526–34. Дои:10.1111 / j.1365-2222.2010.03685.x. ЧВК 3078050. PMID 21255158.
- ^ Кей Л.Дж., Йео В.В., Пичелл П.Т. (апрель 2006 г.). «Простагландин E2 активирует рецепторы EP2 для подавления дегрануляции тучных клеток легких человека». Британский журнал фармакологии. 147 (7): 707–13. Дои:10.1038 / sj.bjp.0706664. ЧВК 1751511. PMID 16432506.
- ^ Spaggiari GM, Capobianco A, Becchetti S, Mingari MC, Moretta L (февраль 2006 г.). «Взаимодействия мезенхимальных стволовых клеток с естественными клетками-киллерами: доказательство того, что активированные NK-клетки способны убивать МСК, тогда как МСК могут ингибировать индуцированную IL-2 пролиферацию NK-клеток». Кровь. 107 (4): 1484–90. Дои:10.1182 / кровь-2005-07-2775. HDL:11567/267587. PMID 16239427.
- ^ Раффагелло Л., Бьянки Дж., Бертолотто М., Монтекукко Ф., Буска А., Даллегри Ф. и др. (Январь 2008 г.). «Мезенхимальные стволовые клетки человека подавляют апоптоз нейтрофилов: модель сохранения нейтрофилов в нише костного мозга». Стволовые клетки. 26 (1): 151–62. Дои:10.1634 / стволовые клетки.2007-0416. PMID 17932421.
- ^ Цзян ХХ, Чжан И, Лю Б., Чжан С.Х., У И, Ю ХД, Мао Н. (май 2005 г.). «Мезенхимальные стволовые клетки человека подавляют дифференцировку и функцию дендритных клеток, происходящих из моноцитов». Кровь. 105 (10): 4120–6. Дои:10.1182 / кровь-2004-02-0586. PMID 15692068.
- ^ Ма С., Се Н, Ли В., Юань Б., Ши И, Ван И (февраль 2014 г.). «Иммунобиология мезенхимальных стволовых клеток». Гибель клеток и дифференциация. 21 (2): 216–25. Дои:10.1038 / cdd.2013.158. ЧВК 3890955. PMID 24185619.
- ^ Ren G, Zhang L, Zhao X, Xu G, Zhang Y, Roberts AI, et al. (Февраль 2008 г.). «Опосредованная мезенхимальными стволовыми клетками иммуносупрессия происходит за счет согласованного действия хемокинов и оксида азота». Стволовая клетка. 2 (2): 141–50. Дои:10.1016 / j.stem.2007.11.014. PMID 18371435.
- ^ Ди Никола М., Карло-Стелла С., Магни М., Миланези М., Лонгони П.Д., Маттеуччи П. и др. (Май 2002 г.). «Стромальные клетки костного мозга человека подавляют пролиферацию Т-лимфоцитов, вызванную клеточными или неспецифическими митогенными стимулами». Кровь. 99 (10): 3838–43. Дои:10.1182 / blood.v99.10.3838. PMID 11986244. S2CID 5889200.
- ^ а б Аугелло А., Тассо Р., Негрини С.М., Аматейс А., Индивери Ф., Cancedda Р., Пеннеси Дж. (Май 2005 г.). «Мезенхимные клетки-предшественники костного мозга ингибируют пролиферацию лимфоцитов путем активации пути запрограммированной смерти 1». Европейский журнал иммунологии. 35 (5): 1482–90. Дои:10.1002 / eji.200425405. PMID 15827960.
- ^ Glennie S, Soeiro I., Dyson PJ, Lam EW, Dazzi F (апрель 2005 г.). «Мезенхимальные стволовые клетки костного мозга вызывают анергию при задержке деления активированных Т-клеток». Кровь. 105 (7): 2821–7. Дои:10.1182 / кровь-2004-09-3696. PMID 15591115. S2CID 33590543.
- ^ Аггарвал С., Питтенгер М.Ф. (февраль 2005 г.). «Мезенхимальные стволовые клетки человека модулируют ответы аллогенных иммунных клеток». Кровь. 105 (4): 1815–22. Дои:10.1182 / кровь-2004-04-1559. PMID 15494428.
- ^ Corcione A, Benvenuto F, Ferretti E, Giunti D, Cappiello V, Cazzanti F и др. (Январь 2006 г.). «Мезенхимальные стволовые клетки человека модулируют функции В-клеток». Кровь. 107 (1): 367–72. Дои:10.1182 / кровь-2005-07-2657. PMID 16141348.
- ^ Краснодембская А, Сонг Й, Фанг Х, Гупта Н., Сериков В., Ли Дж. У., Маттай М.А. (декабрь 2010 г.). «Антибактериальный эффект мезенхимальных стволовых клеток человека частично опосредован секрецией антимикробного пептида LL-37». Стволовые клетки. 28 (12): 2229–38. Дои:10.1002 / шток.544. ЧВК 3293245. PMID 20945332.
- ^ Сун Д.К., Чанг Ю.С., Сун С.И., Ю Х.С., Ан С.Ю., Пак В.С. (март 2016 г.). «Антибактериальный эффект мезенхимальных стволовых клеток против Escherichia coli опосредован секрецией бета-дефенсина-2 посредством передачи сигналов толл-подобного рецептора 4». Клеточная микробиология. 18 (3): 424–36. Дои:10,1111 / см. 12522. ЧВК 5057339. PMID 26350435.
- ^ Гупта Н., Краснодембская А., Капетанаки М., Mouded M, Тан X, Сериков В., Маттай М.А. (июнь 2012 г.). «Мезенхимальные стволовые клетки увеличивают выживаемость и бактериальный клиренс при мышиной пневмонии, вызванной Escherichia coli». Грудная клетка. 67 (6): 533–9. Дои:10.1136 / thoraxjnl-2011-201176. ЧВК 3358432. PMID 22250097.
- ^ Алькаяга-Миранда Ф., Куэнка Дж., Мартин А., Контрерас Л., Фигероа Ф. Е., Хури М. (октябрь 2015 г.). «Комбинированная терапия мезенхимальных стволовых клеток менструального происхождения и антибиотиками улучшает выживаемость при сепсисе». Исследование стволовых клеток и терапия. 6: 199. Дои:10.1186 / s13287-015-0192-0. ЧВК 4609164. PMID 26474552.
- ^ Майзель Р., Брокерс С., Хеселер К., Дегистиричи О, Бюлле Х, Войте С. и др. (Апрель 2011 г.). «Человеческие, но не мышиные мультипотентные мезенхимальные стромальные клетки проявляют антимикробную эффекторную функцию широкого спектра, опосредованную индоламин-2,3-диоксигеназой». Лейкемия. 25 (4): 648–54. Дои:10.1038 / leu.2010.310. PMID 21242993.
- ^ Heirani-Tabasi A, Hassanzadeh M, Hemmati-Sadeghi S, Shahriyari M, Raeesolmohaddeseen M (2015). «Мезенхимальные стволовые клетки; определение будущего регенеративной медицины». Журнал генов и клеток. 1 (2): 34–39. Дои:10.15562 / gnc.15. S2CID 87157970.
- ^ Андерсон Дж. Д., Йоханссон Х. Дж., Грэм С. С., Вестерлунд М., Фам М. Т., Брамлет С. С. и др. (Март 2016 г.). «Комплексный протеомный анализ экзосом мезенхимальных стволовых клеток выявляет модуляцию ангиогенеза посредством передачи сигналов ядерного фактора-KappaB». Стволовые клетки. 34 (3): 601–13. Дои:10.1002 / шток.2298. ЧВК 5785927. PMID 26782178.
- ^ Фигероа Ф.Е., Каррион Ф., Вильянуэва С., Хури М. (2012). «Лечение аутоиммунных заболеваний мезенхимальными стволовыми клетками: критический обзор». Биологические исследования. 45 (3): 269–77. Дои:10.4067 / S0716-97602012000300008. PMID 23283436.
- ^ а б Шарма Р.Р., Поллок К., Хьюбел А., Маккенна Д. (май 2014 г.). «Мезенхимальные стволовые или стромальные клетки: обзор клинического применения и производственной практики». Переливание. 54 (5): 1418–37. Дои:10.1111 / trf.12421. ЧВК 6364749. PMID 24898458.
- ^ Fischer UM, Harting MT, Jimenez F, Monzon-Posadas WO, Xue H, Savitz SI и др. (Июнь 2009 г.). «Легочный ход - главное препятствие для внутривенной доставки стволовых клеток: эффект первого прохождения через легкие». Стволовые клетки и развитие. 18 (5): 683–92. Дои:10.1089 / scd.2008.0253. ЧВК 3190292. PMID 19099374.
- ^ Hematti P (май 2012 г.). «Мезенхимальные стромальные клетки и фибробласты: случай ошибочной идентификации?». Цитотерапия. 14 (5): 516–21. Дои:10.3109/14653249.2012.677822. PMID 22458957.
- ^ Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D и др. (1 января 2006 г.). «Минимальные критерии для определения мультипотентных мезенхимальных стромальных клеток. Заявление о позиции Международного общества клеточной терапии». Цитотерапия. 8 (4): 315–7. Дои:10.1080/14653240600855905. PMID 16923606.
- ^ Ван К., Хе Кью, Маккейг М., Марш Д., Ли Джи (январь 2006 г.). «Неадгезивная клеточная популяция культуры костного мозга человека является дополнительным источником мезенхимальных стволовых клеток (МСК)». Журнал ортопедических исследований. 24 (1): 21–8. Дои:10.1002 / jor.20023. PMID 16419965.
- ^ Gronthos S, Graves SE, Ohta S, Simmons PJ (декабрь 1994 г.). «Фракция STRO-1 + костного мозга взрослого человека содержит остеогенные предшественники». Кровь. 84 (12): 4164–73. Дои:10.1182 / blood.V84.12.4164.bloodjournal84124164. PMID 7994030.
- ^ Ойаджоби Б.О., Ломри А., Хотт М., Мари П.Дж. (март 1999 г.). «Выделение и характеристика клоногенных предшественников остеобластов человека, иммунизированных из стромы костного мозга плода с использованием моноклональных антител STRO-1». Журнал исследований костей и минералов. 14 (3): 351–61. Дои:10.1359 / jbmr.1999.14.3.351. PMID 10027900.
- ^ Tondreau T, Lagneaux L, Dejeneffe M, Delforge A, Massy M, Mortier C, Bron D (1 января 2004 г.). «Выделение мезенхимальных стволовых клеток костного мозга путем пластической адгезии или отрицательного отбора: фенотип, кинетика пролиферации и потенциал дифференцировки». Цитотерапия. 6 (4): 372–9. Дои:10.1080/14653240410004943. PMID 16146890.
- ^ Иудикон П., Фиораванти Д., Бонанно Дж., Мицели М., Лаворино С., Тотта П. и др. (Январь 2014). «Свободный от патогенов лизат тромбоцитов с низким содержанием плазмы и распространение мезенхимальных стволовых клеток человека». Журнал трансляционной медицины. 12: 28. Дои:10.1186/1479-5876-12-28. ЧВК 3918216. PMID 24467837.
- ^ Цзян Б., Фу Икс, Ян Л., Ли С., Чжао Д., Ван Х, Дуань И, Янь И, Ли Э, Ву К., Инглис Б., Цзи В., Сюй Р., Си В. (2019). «Трансплантация сфероидов мезенхимальных стволовых клеток человека, полученных из ЭСК, улучшает спонтанный остеоартрит у макак-резусов». Тераностика. 9 (22): 6587–6600. Дои:10.7150 / thno.35391. ЧВК 6771254. PMID 31588237.
- ^ Продам S (16 августа 2013 г.). Справочник по стволовым клеткам. Springer Science & Business Media. п. 143. ISBN 978-1-4614-7696-2.
- ^ Беккер А.Дж., Маккалок Э.А., Тиль Дж. Э. (февраль 1963 г.). «Цитологическая демонстрация клональной природы колоний селезенки, полученных из трансплантированных клеток костного мозга мыши». Природа. 197 (4866): 452–4. Bibcode:1963Натура.197..452Б. Дои:10.1038 / 197452a0. HDL:1807/2779. PMID 13970094. S2CID 11106827.
- ^ Симинович Л., Маккулок Э.А., Тиль Дж. Э. (декабрь 1963 г.). «Распределение колониеобразующих клеток среди колоний селезенки». Журнал клеточной и сравнительной физиологии. 62 (3): 327–36. Дои:10.1002 / jcp.1030620313. HDL:1807/2778. PMID 14086156.
- ^ Friedenstein AJ, Deriglasova UF, Kulagina NN, Panasuk AF, Rudakowa SF, Luriá EA, Ruadkow IA (1974). «Предшественники фибробластов в различных популяциях гемопоэтических клеток, обнаруженные методом анализа колоний in vitro». Экспериментальная гематология. 2 (2): 83–92. PMID 4455512.
- ^ Фриденштейн А.Ю., Горская Ю.Ф., Кулагина Н.Н. (сентябрь 1976 г.). «Предшественники фибробластов в нормальных и облученных кроветворных органах мышей». Экспериментальная гематология. 4 (5): 267–74. PMID 976387.
дальнейшее чтение
- Мерфи МБ, Moncivais K, Caplan AI (ноябрь 2013 г.). «Мезенхимальные стволовые клетки: экологически чистая терапия для регенеративной медицины». Экспериментальная и молекулярная медицина. 45 (11): e54. Дои:10.1038 / emm.2013.94. ЧВК 3849579. PMID 24232253.
внешняя ссылка
- «Информационный бюллетень по мезенхимальным стволовым клеткам». Европейская стволовая клетка. Июнь 2012 г. Архивировано с оригинал 27 ноября 2016 г.. Получено 25 июн 2012. проверенный учеными и не слишком технический
- «Исследование мезенхимальных стволовых клеток». Университет Джона Хопкинса. Архивировано из оригинал 15 октября 2017 г.. Получено 26 июн 2012.
