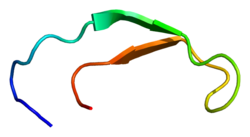Гепсидин - Hepcidin
| Гепсидин | |
|---|---|
 Структура решения гепсидина-25.[3] | |
| Идентификаторы | |
| Символ | Гепсидин |
| Pfam | PF06446 |
| ИнтерПро | IPR010500 |
| SCOP2 | 1 мин. 4 этаж / Объем / СУПФАМ |
| OPM суперсемейство | 153 |
| Белок OPM | 1м4э |
| противомикробный пептид гепсидина | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | HAMP | ||||||
| Ген NCBI | 57817 | ||||||
| HGNC | 15598 | ||||||
| OMIM | 606464 | ||||||
| RefSeq | NM_021175 | ||||||
| UniProt | P81172 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 19 q13.1 | ||||||
| |||||||
Гепсидин это белок что у людей кодируется HAMP ген. Гепсидин - ключевой регулятор проникновения утюг в циркуляцию у млекопитающих.[4]
В условиях аномально высокого уровня гепсидина, таких как воспаление, сывороточное железо падает из-за улавливания железа в макрофаги и клетки печени и снижение всасывания железа в кишечнике. Обычно это приводит к анемии из-за недостаточного количества сывороточного железа, доступного для развития. красные кровяные тельца. Когда уровень гепсидина аномально низкий, например, гемохроматоз, возникает перегрузка железом из-за повышенного ферропортин опосредованный отток железа из хранилища и повышенное всасывание железа в кишечнике.
Структура
Гепсидин существует как препрогормон (84 аминокислоты), прогормон (60 аминокислот) и гормон (25 аминокислот). Метаболиты гепсидина из двадцати и 22 аминокислот также присутствуют в моче. Удаление 5 N-концевые аминокислоты приводят к потере функции. Превращение прогепсидина в гепсидин опосредуется конвертазой прогормона. фурин.[5] Это преобразование может регулироваться альфа-1. антитрипсин.[6]
Гепсидин - это плотно свернутый полипептид с 32% бета-лист характер и заколка для волос конструкция стабилизирована 4 дисульфид облигации. Структура гепсидина была определена с помощью раствора ЯМР.[3] ЯМР-исследования показали новую модель гепсидина: при температуре окружающей среды белок взаимно преобразуется между двумя конформациями, которые можно индивидуально разрешить путем изменения температуры. Структура раствора гепсидина определялась при 325 К и 253 К в переохлажденной воде. Рентгеновский анализ сокристалл с Fab выявили структуру, аналогичную структуре высокотемпературного ЯМР.[7]
Функция

Гепсидин - регулятор обмена железа. Гепсидин ингибирует транспорт железа, связываясь с каналом экспорта железа. ферропортин который расположен на базолатеральной поверхности кишечника энтероциты и плазматическая мембрана ретикулоэндотелиальных клеток (макрофаги ). В конечном итоге гепсидин расщепляет белок-переносчик в лизосома. Ингибирование ферропортина предотвращает экспорт железа, и железо удерживается в клетках.[8][9] Ингибируя ферропортин, гепсидин предотвращает энтероциты от попадания железа в печеночная портальная система, тем самым снижая всасывание железа с пищей. Высвобождение железа из макрофагов также снижается за счет ингибирования ферропортина. Повышенная активность гепсидина частично отвечает за снижение доступности железа, наблюдаемое при анемии хронического воспаления, такой как почечная недостаточность.[10]
Любая из нескольких мутаций гепсидина приводит к ювенильный гемохроматоз. Большинство случаев ювенильного гемохроматоза связано с мутациями в гемоювелин.[11] Мутации в TMPRSS6 могут вызывать анемию из-за нарушения регуляции гепсидина.[12]
Гепсидин обладает сильным антимикробным действием против кишечная палочка штамм ML35P и Neisseria cinerea и более слабая антимикробная активность против Эпидермальный стафилококк, Золотистый стафилококк и Streptococcus agalactiae. Он также активен против грибка. грибковые микроорганизмы албиканс, но не действует против Синегнойная палочка.[13]
Регулирование
Синтез и секреция гепсидина печенью контролируется запасами железа в макрофагах, воспаление, гипоксия и эритропоэз. Макрофаги связываются с гепатоцитом, чтобы регулировать выброс гепсидина в кровоток через восемь различных белков: гемоювелин, наследственный белок гемохроматоза, рецептор трансферрина 2 костный морфогенный белок 6 (BMP6), матриптаза-2, неогенин, рецепторы BMP и трансферрин.[14]
Эритроферрон, продуцируемый в эритробластах, был идентифицирован как ингибитор гепсидина и, таким образом, обеспечивает большее количество железа для синтеза гемоглобина в таких ситуациях, как стрессовый эритропоэз.[15][16]
Витамин Д было показано, что он снижает гепсидин в клеточных моделях, изучающих транскрипцию, и при введении в больших дозах людям-добровольцам. Оптимальная функция гепсидина может быть основана на адекватном присутствии витамина D в крови.[17]
История
Первоначально этот пептид был назван LEAP-1, что означает «экспрессируемый печенью антимикробный белок», когда он был впервые описан в 2000 году.[18] Позже был открыт пептид, связанный с воспалением, названный «гепсидин» после того, как было обнаружено, что он продуцируется в печени («геп-») и, по-видимому, обладает бактерицидными свойствами («-цид» для «уничтожения»).[19] Хотя в первую очередь он синтезируется в печени, меньшие количества синтезируются в других тканях, таких как жировые клетки.[20]
Гепсидин был впервые обнаружен в человек моча и сыворотка в 2000 г.[21]
Вскоре после этого открытия исследователи обнаружили, что производство гепсидина в мышей увеличивается в условиях перегрузки железом, а также при воспалении. Генетически модифицированный мыши, созданные для сверхэкспрессии гепсидина, умерли вскоре после рождения от тяжелого дефицита железа, что снова указывает на центральную, а не избыточную роль в регуляции железа. Первое свидетельство связи гепсидина с клиническим состоянием, известным как анемия воспаления пришел из лаборатории Нэнси Эндрюс в Бостоне, когда исследователи изучили ткани двух пациентов с опухоли с тяжелым микроцитарная анемия который не ответил на добавки железа. Ткань опухоли, по-видимому, чрезмерно продуцирует гепсидин и содержит большое количество гепсидина. мРНК. Удаление опухолей хирургическим путем вылечило анемию.
В совокупности эти открытия предполагают, что гепсидин регулирует всасывание железа в организме.
Клиническое значение
Есть много заболеваний, при которых недостаточное усвоение железа способствует недостаток железа и железодефицитная анемия. Лечение будет зависеть от присутствующих уровней гепсидина, поскольку пероральное лечение вряд ли будет эффективным, если гепсидин блокирует энтеральную абсорбцию, и в каких случаях парентеральное железо лечение было бы целесообразным. Исследования показали, что измерение гепсидина полезно для выбора оптимального лечения,[22] хотя, поскольку это не широко доступно, С-реактивный белок (CRP) используется как суррогатный маркер.
β-талассемия, один из самых распространенных врожденный анемии, возникает из-за частичного или полного отсутствия синтеза β-глобина. Чрезмерное всасывание железа является одним из основных признаков β-талассемии и может привести к тяжелой заболеваемости и смертности. Серийные анализы мышей с β-талассемией показывают гемоглобин уровень со временем снижается, в то время как концентрация железа в печень, селезенка, и почки заметно увеличивается. Перегрузка железом связана с низким уровнем гепсидина. У пациентов с β-талассемией также низкий уровень гепсидина. Наблюдения заставили исследователей предположить, что при β-талассемии усваивается больше железа, чем требуется для эритропоэз. Повышение экспрессии гепсидина у мышей с β-талассемией ограничивает перегрузку железом, а также снижает образование нерастворимых мембраносвязанный глобины и активные формы кислорода, а также улучшает анемию.[23] Мыши с повышенной экспрессией гепсидина также продемонстрировали увеличение продолжительности жизни их красные клетки, обращение неэффективных эритропоэз и спленомегалия, и увеличение общего гемоглобин уровни. На основании этих данных исследователи предположили, что терапия для повышения уровня гепсидина или действовать как гепсидин агонисты может помочь в лечении аномального всасывания железа у людей с β-талассемией и родственными заболеваниями.[24] В более поздних исследованиях на мышах[25] эритроферрон было предложено быть фактором, ответственным за подавление гепсидина. Коррекция уровней гепсидина и железа у этих мышей не улучшила их анемию.
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000105697 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б PDB: 1М4Ф; Хантер Х. Н., Фултон Д. Б., Ганц Т., Фогель Х. Дж. (Октябрь 2002 г.). «Структура раствора человеческого гепсидина, пептидного гормона с антимикробной активностью, который участвует в захвате железа и наследственном гемохроматозе». J. Biol. Chem. 277 (40): 37597–603. Дои:10.1074 / jbc.M205305200. PMID 12138110.
- ^ Ганц Т. (август 2003 г.). «Гепсидин, ключевой регулятор метаболизма железа и медиатор анемии воспаления». Кровь. 102 (3): 783–8. Дои:10.1182 / кровь-2003-03-0672. PMID 12663437.
- ^ Валор Э.В., Ганц Т. (2008). «Посттрансляционный процессинг гепсидина в гепатоцитах человека опосредуется прогормоновой конвертазой фурин». Blood Cells Mol. Дис. 40 (1): 132–8. Дои:10.1016 / j.bcmd.2007.07.009. ЧВК 2211381. PMID 17905609.
- ^ Пандур Э., Надь Дж., Пур В.С., Сарняй А., Хусар А., Мисета А., Сипос К. (апрель 2009 г.). «Альфа-1-антитрипсин связывает внутриклеточно препрогепсидин и прогепсидин в сыворотке». FEBS J. 276 (7): 2012–21. Дои:10.1111 / j.1742-4658.2009.06937.x. PMID 19292870. S2CID 28974553.
- ^ PDB: 3H0T; Джордан Дж. Б., Поппе Л., Ханиу М., Арведсон Т., Сайед Р., Ли В., Коно Х, Ким Х., Шнир П. Д., Харви Т. С., Миранда Л. П., Читам Дж., Сасу Би Джей (сентябрь 2009 г.). «Новый взгляд на гепсидин, дисульфидные связи, динамика и структура». J. Biol. Chem. 284 (36): 24155–67. Дои:10.1074 / jbc.M109.017764. ЧВК 2782009. PMID 19553669.
- ^ Росси Э (август 2005 г.). «Гепсидин - гормон, регулирующий железо». Clin Biochem Rev. 26 (3): 47–9. ЧВК 1240030. PMID 16450011.
- ^ Гулек С., Андерсон Дж. Дж., Коллинз Дж. Ф. (август 2014 г.). «Механические и регуляторные аспекты всасывания железа в кишечнике». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени. 307 (4): G397–409. Дои:10.1152 / ajpgi.00348.2013. ЧВК 4137115. PMID 24994858.
- ^ Эшби Д.Р., Гейл Д.П., Басбридж М., Мерфи К.Г., Дункан Н.Д., Кэрнс Т.Д., Таубе Д.Х., Блум С.Р., Там Ф.В., Чепмен Р.С., Максвелл PH, Чой П. (май 2009 г.). «Уровни гепсидина в плазме повышены, но чувствительны к терапии эритропоэтином при заболевании почек». Почка Int. 75 (9): 976–81. Дои:10.1038 / ки.2009.21. PMID 19212416.
- ^ Core AB, Canali S, Babitt JL (2014). «Передача сигналов гемоджувелина и костного морфогенетического белка (BMP) в гомеостазе железа». Границы фармакологии. 5: 104. Дои:10.3389 / fphar.2014.00104. ЧВК 4026703. PMID 24860505.
- ^ Железодефицитная анемия: новые идеи для медицинских работников: издание 2011 г.. ООО «Шоларли Медиа». Декабрь 2012 г. ISBN 978-1-4649-8960-5.
- ^ «Гепсидин P81172». UniProt. 15 декабря 1998 г.
- ^ Чжао Н, Чжан А.С., Эннс Калифорния (2013). «Регуляция железа гепсидином». J Clin Invest. 123 (6): 2337–43. Дои:10.1172 / JCI67225. ЧВК 3668831. PMID 23722909.
- ^ Кури, М.Дж. «Эритроферрон: недостающее звено в регуляции железа». Гематолог. Американское общество гематологии. Получено 26 августа 2015.
- ^ Каутц Л., Юнг Дж., Валор Э.В., Ривелла С., Немет Е., Ганц Т. (июль 2014 г.). «Идентификация эритроферрона как эритроидного регулятора метаболизма железа». Природа Генетика. 46 (7): 678–84. Дои:10,1038 / нг.2996. ЧВК 4104984. PMID 24880340.
- ^ Баккетта Дж., Зарицкий Дж. Дж., Си Дж. Л., Чун Р. Ф., Лисс Т. С., Завала К., Наяк А., Весселинг-Перри К., Вестерман М., Холлис Б. В., Салуски И. Б., Хьюисон М. (2014). «Подавление железо-регулирующего гепсидина витамином D». Варенье. Soc. Нефрол. 25 (3): 564–72. Дои:10.1681 / ASN.2013040355. ЧВК 3935584. PMID 24204002.
- ^ Краузе А., Нейтц С., Мегерт Х. Дж., Шульц А., Форссманн В. Г., Шульц-Кнаппе П., Адерманн К. (сентябрь 2000 г.). «LEAP-1, новый человеческий пептид с высокой степенью дисульфидной связи, проявляет антимикробную активность». FEBS Lett. 480 (2–3): 147–50. Дои:10.1016 / S0014-5793 (00) 01920-7. PMID 11034317. S2CID 9161764.
- ^ Park CH, Valore EV, Waring AJ, Ganz T (март 2001 г.). «Гепсидин, мочевой антимикробный пептид, синтезируемый в печени». J. Biol. Chem. 276 (11): 7806–10. Дои:10.1074 / jbc.M008922200. PMID 11113131.
- ^ Бекри С., Гуаль П., Анти Р., Лучиани Н., Дахман М., Рамеш Б., Ианнелли А., Стаччини-Микс А., Казанова Д., Бен Амор I, Сен-Поль МС, Хуэт ПМ, Садул Д. Л., Гугенхайм Дж., Срай С.К., Тран А., Ле Маршан-Брюстель Y (сентябрь 2006 г.). «Повышенная экспрессия гепсидина в жировой ткани при тяжелом ожирении не зависит от диабета и НАСГ». Гастроэнтерология. 131 (3): 788–96. Дои:10.1053 / j.gastro.2006.07.007. PMID 16952548.
- ^ Кемна Э.Х., Тьялсма Х., Виллемс Х.Л., Свинкелс Д.В. (январь 2008 г.). «Гепсидин: от открытия к дифференциальной диагностике». Haematologica. 93 (1): 90–7. Дои:10.3324 / haematol.11705. PMID 18166790.
- ^ Брегман Д.Б., Моррис Д., Кох Т.А., Хе А., Гудноу Л.Т. (февраль 2013 г.). «Уровни гепсидина предсказывают невосприимчивость к пероральной терапии железом у пациентов с железодефицитной анемией». Являюсь. J. Hematol. 88 (2): 97–101. Дои:10.1002 / ajh.23354. PMID 23335357. S2CID 42656065.
- ^ Гарденги С., Рамос П., Маронджу М.Ф., Мельчиори Л., Бреда Л., Гай Е., Мюрхед К., Рао Н., Рой С.Н., Эндрюс Н. , Grady RW, Rivella S (декабрь 2010 г.). «Гепсидин как терапевтическое средство для ограничения перегрузки железом и улучшения анемии у мышей с β-талассемией». J. Clin. Вкладывать деньги. 120 (12): 4466–77. Дои:10.1172 / JCI41717. ЧВК 2993583. PMID 21099112.
- ^ Kroot JJ, Tjalsma H, Fleming RE, Swinkels DW (декабрь 2011 г.). «Гепсидин при нарушениях железа у человека: диагностические значения». Clin. Chem. 57 (12): 1650–69. Дои:10.1373 / Clinchem.2009.140053. PMID 21989113.
- ^ Моура IC, Гермина О. (2015). «Эритроферрон: недостающее звено в β-талассемии?». Кровь. 126 (17): 1974–5. Дои:10.1182 / кровь-2015-09-665596. PMID 26494918.
дальнейшее чтение
- Камашелла C (2005). «Понимание гомеостаза железа посредством генетического анализа гемохроматоза и родственных заболеваний». Кровь. 106 (12): 3710–7. Дои:10.1182 / кровь-2005-05-1857. PMID 16030190.
внешняя ссылка
- гепсидин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Intrinsic LifeSciences - Исследовательский центр гепсидина, компания BioIron
- Hepcidinanalysis.com - Сервис для измерения гепсидина: научные исследования, пациенты и клинические испытания
- Страница банка данных белков
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для человеческого гепсидина