Конденсин - Condensin

Конденсины большие белковые комплексы которые играют центральную роль в хромосома сборка и сегрегация во время митоз и мейоз (Рисунок 1).[1][2] Их субъединицы первоначально были идентифицированы как основные компоненты митотических хромосом, собранных в Xenopus яичные экстракты.[3]
Субъединичный состав
Эукариотические типы

Много эукариотический клетки обладают двумя разными типами комплексов конденсина, известными как конденсин I и конденсин II, каждая из которых состоит из пяти субъединиц (рис. 2).[4] Конденсины I и II имеют одну и ту же пару ядерных субъединиц, SMC2 и SMC4, которые принадлежат к большому семейству хромосомных АТФазы, известный как SMC белки (SMC означает Структурное поддержание хромосом).[5][6] Каждый из комплексов содержит отдельный набор не относящихся к SMC регуляторных субъединиц (a клейсин подразделение[7] и пара HEAT повтор субъединицы).[8] Оба комплекса большие, с общей молекулярная масса 650-700 кДа.
| Сложный | Субъединица | Классификация | Позвоночные | D. melanogaster | C. elegans | С. cerevisiae | С. Помбе | A. thaliana | С. merolae | T. thermophila |
|---|---|---|---|---|---|---|---|---|---|---|
| конденсин I и II | SMC2 | АТФаза | CAP-E / SMC2 | SMC2 | МИКС-1 | Smc2 | Вырезать14 | CAP-E1 и -E2 | SMC2 | Scm2 |
| конденсин I и II | SMC4 | АТФаза | CAP-C / SMC4 | SMC4 / глюон | SMC-4 | Smc4 | Cut3 | CAP-C | SMC4 | Smc4 |
| конденсин I | CAP-D2 | HEAT повтор | CAP-D2 | CAP-D2 | DPY-28 | Ycs4 | Cnd1 | CAB72176 | CAP-D2 | Cpd1 и 2 |
| конденсин I | CAP-G | HEAT повтор | CAP-G | CAP-G | CAP-G1 | Ycg1 | Cnd3 | BAB08309 | CAP-G | Cpg1 |
| конденсин I | CAP-H | клейсин | CAP-H | CAP-H / Barren | DPY-26 | Brn1 | Cnd2 | AAC25941 | CAP-H | Cph1,2,3,4 и 5 |
| конденсин II | CAP-D3 | HEAT повтор | CAP-D3 | CAP-D3 | HCP-6 | - | - | At4g15890.1 | CAP-D3 | - |
| конденсин II | CAP-G2 | HEAT повтор | CAP-G2 | - | CAP-G2 | - | - | CAP-G2 / HEB1 | CAP-G2 | - |
| конденсин II | CAP-H2 | клейсин | CAP-H2 | CAP-H2 | КЛЭ-2 | - | - | CAP-H2 / HEB2 | CAP-H2 | - |
| конденсин IОКРУГ КОЛУМБИЯ | Вариант SMC4 | АТФаза | - | - | DPY-27 | - | - | - | - | - |
Конденсины ядерных субъединиц (SMC2 и SMC4) консервативны среди всех эукариотический виды, изученные на сегодняшний день. Не-SMC субъединицы, уникальные для конденсина I, также консервативны среди эукариот, но встречаемость не-SMC субъединиц, уникальных для конденсина II, сильно варьируется среди видов.
- Например, плодовая мушка Drosophila melanogaster не имеет гена субъединицы CAP-G2 конденсина II.[9] У других видов насекомых также часто отсутствуют гены субъединиц CAP-D3 и / или CAP-H, что указывает на то, что субъединицы, не относящиеся к SMC, уникальные для конденсина II, находились ниже высокого уровня. давление отбора во время эволюции насекомых.[10]
- В нематода Caenorhabditis elegans обладает как конденсинами I, так и II. Этот вид, однако, уникален в том смысле, что он имеет третий комплекс (тесно связанный с конденсином I), который участвует в хромосомном уровне. генная регуляция, т.е. компенсация дозировки.[11] В этом комплексе, известном как конденсин IОКРУГ КОЛУМБИЯаутентичная субъединица SMC4 заменяется ее вариантом DPY-27 (рис. 2).
- Некоторые виды, например грибы (например, зародышевые дрожжи Saccharomyces cerevisiae и делящиеся дрожжи Schizosaccharomyces pombe ), лишены всех регуляторных субъединиц, уникальных для конденсина II.[12][13] С другой стороны, одноклеточная примитивная красная водоросль Cyanidioschyzon merolae, чей геном сравним с размером генома дрожжей, имеет конденсины I и II.[14] Таким образом, нет очевидной связи между наличием конденсина II и размером эукариотических геномов.
- В инфузория Tetrahymena thermophila имеет только конденсин I. Тем не менее, есть несколько паралоги для двух его регуляторных субъединиц (CAP-D2 и CAP-H), и некоторые из них специфически локализуются либо в макронуклеус (отвечает за экспрессию гена) или микронуклеус (отвечает за воспроизведение).[15] Таким образом, этот вид имеет множественные комплексы конденсина I, которые имеют разные регуляторные субъединицы и обнаруживают четкую ядерную локализацию.[16] Это очень уникальное свойство, которое не встречается у других видов.
Прокариотические типы
Прокариотический у видов также есть конденсиноподобные комплексы, которые играют важную роль в хромосомных (нуклеоид ) организация и сегрегация. Прокариотические конденсины можно разделить на два типа: SMC-ScpAB[17] и MukBEF.[18] Много эубактериальный и архей виды имеют SMC-ScpAB, тогда как подгруппа эубактерий (известная как γ-протеобактерии ) включая кишечная палочка есть МукБЭФ. ScpA и MukF принадлежат к семейству белков, называемых «клейсинами»,[7] тогда как ScpB и MukF недавно были классифицированы в новое семейство белков, названных «коршун».[19]
| Сложный | Субъединица | Классификация | Б. subtilis | Caulobacter | Кишечная палочка |
|---|---|---|---|---|---|
| SMC-ScpAB | SMC | АТФаза | SMC / BsSMC | SMC | - |
| SMC-ScpAB | ScpA | клейсин | ScpA | ScpA | - |
| SMC-ScpAB | ScpB | летающий змей | ScpB | ScpB | - |
| MukBEF | MukB | АТФаза | - | - | MukB |
| MukBEF | MukE | летающий змей | - | - | MukE |
| MukBEF | MukF | клейсин | - | - | MukF |
Несмотря на сильно различающиеся первичные структуры соответствующих субъединиц между SMC-ScpAB и MukBEF, разумно считать, что эти два комплекса играют сходные, если не идентичные функции в организации и динамике прокариотических хромосом, основываясь на их молекулярной архитектуре и дефектных клеточных фенотипах. Поэтому оба комплекса часто называют прокариотическими (или бактериальными) конденсинами. Недавние исследования сообщают о наличии третьего комплекса, связанного с MukBEF (называемого MksBEF), у некоторых видов бактерий.[20]
Молекулярные механизмы
Молекулярные структуры

Димеры SMC, которые действуют как центральные субъединицы конденсинов, имеют очень характерную V-образную форму, каждое плечо которой состоит из антипараллельных спиральных катушек (рисунок 3; см. SMC белки подробнее).[21][22] Длина каждого плеча спиральной катушки достигает ~ 50 нм, что соответствует длине ~ 150 п.н. двухцепочечная ДНК (дцДНК). В эукариотических комплексах конденсина I и II субъединица клейзина соединяет два головных домена димера SMC и связывается с двумя повторяющимися субъединицами HEAT (Рисунок 1).[23][24]
Ранние исследования выяснили структуру частей бактериальных конденсинов, таких как MukBEF.[25][26] и SMC-ScpA.[27][28] В эукариотических комплексах описано несколько структур субкомплексов и субдоменов, включая шарнирные и рычажные домены димера SMC2-SMC4,[29][30] субкомплекс CAP-G (ycg1) / CAP-H (brn1),[31][32] и подкомплекс CAP-D2 (ycs4) / CAP-H (brn1).[24] С другой стороны, быстрая скорость атомно-силовая микроскопия продемонстрировал, что рукава димера SMC гораздо более гибкие, чем ожидалось.[33]
Молекулярная активность
Конденсин I очищенный от Xenopus яичные экстракты это ДНК -стимулированный АТФаза и показывает способность вводить положительные сверхспиральное натяжение в дцДНК в АТФ -гидролиззависимый способ (положительный суперспирализация Мероприятия).[34][35] Аналогичная активность была обнаружена в конденсинах других организмов.[36][37] Активирована положительная суперспиральная активность in vitro к Cdk1 фосфорилирование, предполагая, что это, вероятно, одна из физиологических активностей, непосредственно участвующих в сборке митотических хромосом.[38] Предполагается, что эта активность конденсина I помогает складывать ДНК и способствует топоизомераза II -опосредованное разрешение сестринских хроматид.[39] Рано эксперименты с одной молекулой ДНК также продемонстрировали в реальном времени, что конденсин I способен уплотнять ДНК в зависимости от АТФ-гидролиза.[40]
Совсем недавно, эксперименты с одной молекулой продемонстрировали, что конденсин I почкующихся дрожжей способен перемещаться вдоль дцДНК (мотор Мероприятия)[41] и «выдавить» петли ДНК (экструзия петли Мероприятия)[42] зависимым от гидролиза АТФ образом. В последних экспериментах активность отдельных комплексов конденсина на ДНК визуализировалась в режиме реального времени. флуоресцентная визуализация, показывая, что конденсин I действительно является двигателем быстрого вытеснения петли и что один комплекс конденсина I может вытеснять 1500 п.н. ДНК в секунду строго АТФ-зависимым образом. Было высказано предположение, что конденсин I закрепляет ДНК между субъединицами Ycg1-Brn1.[31] и асимметрично вытягивает ДНК, образуя большие петли. Более того, было показано, что комплексы конденсина могут пересекать друг друга, образуя динамические петлевые структуры и изменяя их размеры.[43]
Неизвестно, как конденсины могут действовать на нуклеосомная ДНК. Недавняя разработка системы восстановления выявила гистон сопровождающий ФАКТ как важный компонент сборки хромосомы, опосредованной конденсином I. in vitro, что дает важный ключ к решению этой проблемы.[44] Также было показано, что конденсины могут собирать хромосомоподобные структуры в бесклеточных экстрактах даже в условиях, когда сборка нуклеосом в значительной степени подавлена.[45] Это наблюдение указывает на то, что конденсины могут, по крайней мере, частично работать с ненуклеосомной ДНК в физиологических условиях.
В настоящее время доступна лишь ограниченная информация о функциональном вкладе отдельных субъединиц конденсинов в их активность. Димер SMC2-SMC4 обладает способностью повторно отжигать комплементарные одноцепочечная ДНК.[46] Эта деятельность не требует АТФ. Для эукариотических комплексов сообщалось, что HEAT повтор субъединицы участвуют в связывании ДНК[31][47] и к сборке хромосомных осей.[48] Гибкий и расширяемый характер ТЕПЛО повторяется может лежать в основе динамического действия конденсинов и архитектуры митотических хромосом.[49][50]
Математическое моделирование
Несколько попыток математического моделирования и компьютерное моделирование сборки митотических хромосом на основе молекулярной активности конденсинов. Типичные примеры включают моделирование на основе выдавливания петель,[51] стохастические попарные контакты[52] и комбинация петлевых и межконденсинных притяжений.[53]
Функции сборки и сегрегации хромосом
Митоз

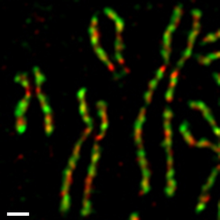
В клетках культуры ткани человека два комплекса конденсина регулируются по-разному во время митотический клеточный цикл (Рисунок 4).[54][55] Конденсин II присутствует в ядро клетки в течение межфазный и участвует в ранней стадии конденсации хромосом в профаза ядро. С другой стороны, конденсин I присутствует в цитоплазма во время интерфазы и получает доступ к хромосомам только после ядерная оболочка разрушается (NEBD) в конце профазы. В течение прометафаза и метафаза, конденсин I и конденсин II взаимодействуют для сборки палочковидных хромосом, в которых два сестринские хроматиды полностью разрешены. Такая дифференциальная динамика двух комплексов наблюдается в Xenopus яичные экстракты,[56] ооциты мышей,[57] и нервные стволовые клетки,[58] что указывает на то, что он является частью фундаментального регуляторного механизма, законсервированного среди различных организмов и типов клеток. Скорее всего, этот механизм обеспечивает упорядоченное действие двух комплексов: сначала конденсина II, а затем - конденсина I.[59]
На метафаза хромосомы, конденсины I и II обогащены по центральной оси неперекрывающимся образом (рис. 5). Эксперименты по истощению in vivo[4][58][60] и эксперименты по истощению иммунитета в Xenopus яичные экстракты[56] демонстрируют, что эти два комплекса выполняют разные функции в сборке метафазных хромосом. Клетки, дефицитные по функциям конденсина, не блокируются на определенной стадии клеточного цикла, демонстрируя дефекты сегрегации хромосом (т. Е. Анафазные мостики) и прогрессируя через аномальный цитокинез.[61][62]
Относительный вклад конденсинов I и II в митоз варьирует у разных видов эукариот.. Например, каждый из конденсинов I и II играет важную роль в эмбриональном развитии мышей.[58] У них есть как перекрывающиеся, так и неперекрывающиеся функции во время митотического клеточного цикла. С другой стороны, конденсин II не важен для митоза у примитивных водорослей. С. merolae[14] и наземный завод A. thaliana.[63] Любопытно, что конденсин II играет доминирующую роль над конденсином I в C. elegans ранние эмбрионы.[11] Эта особенность могла быть связана с тем, что C. elegans имеет особую структуру хромосомы, известную как холоцентрические хромосомы. Грибы, такие как С. cerevisiae[13] и С. Помбе[12] не имеют конденсина II с первого раза. Эти различия между видами эукариот имеют важное значение для эволюции архитектуры хромосом (см. Раздел «Эволюционные последствия» ниже).
| разновидность | М. musculus | D. melanogaster | C. elegans | С. cerevisiae | С. Помбе | A. thaliana | C. merolae |
|---|---|---|---|---|---|---|---|
| размер генома | ~ 2,500 Мб | 140 Мб | 100 Мб | 12 Мб | 14 Мб | 125 Мб | 16 Мб |
| конденсин I | существенный | существенный | незначительный | существенный | существенный | существенный | существенный |
| конденсин II | существенный | несущественный | существенный | - | - | несущественный | несущественный |
Недавно стало возможным, что зависимые от клеточного цикла структурные изменения хромосом отслеживаются с помощью основанного на геноме метода, известного как Hi-C (High-throughput захват конформации хромосомы ).[64] Влияние дефицита конденсина на конформацию хромосом было изучено у почкующихся дрожжей,[65][66] делящиеся дрожжи,[67][68] и куриные клетки DT40.[69] Результаты этих исследований убедительно подтверждают мнение о том, что конденсины играют решающую роль в сборке митотических хромосом и что конденсины I и II выполняют разные функции в этом процессе. Более того, количественный анализ изображений позволяет исследователям подсчитать количество комплексов конденсина, присутствующих на метафазных хромосомах человека.[70]
Мейоз
Конденсины также играют важную роль в сборке и сегрегации хромосом в мейоз. Сообщалось о генетических исследованиях в С. cerevisiae,[71] D. melanogaster,[72][73] и C. elegans.[74] У мышей потребность в субъединицах конденсина в мейозе была решена с помощью экспериментов по блокированию с помощью антител.[57] и условный нокаут гена анализы.[75] В мейозе I млекопитающих функциональный вклад конденсина II оказывается больше, чем вклад конденсина I. Как было показано в митозе,[58] однако два комплекса конденсина имеют как перекрывающиеся, так и неперекрывающиеся функции в мейозе. В отличие от когезин, специфичных для мейоза субъединиц конденсинов не идентифицировано.
Хромосомные функции вне митоза или мейоза
Недавние исследования показали, что конденсины участвуют в большом количестве функций хромосом за пределами митоз или же мейоз.[59]
- В бутоньерки, конденсин I (единственный конденсин в этом организме) участвует в регуляции числа копий рДНК повторение[76] а также в кластеризации тРНК гены.[77]
- В делящиеся дрожжи, конденсин I участвует в регуляции репликативная контрольная точка[78] и кластеризация генов, транскрибируемых РНК-полимеразой III.[79]
- В C. elegans, третий конденсиновый комплекс (конденсин IОКРУГ КОЛУМБИЯ), относящийся к конденсину I, регулирует структуру Х-хромосом высшего порядка как главный регулятор компенсация дозировки.[80]
- В D. melanogaster субъединицы конденсина II способствуют растворению политенные хромосомы[81] и формирование хромосомные территории[82] в яичниках камеры медсестры. Имеются доказательства того, что они негативно регулируют трансвекция в диплоидных клетках. Также сообщалось, что компоненты конденсина I необходимы для обеспечения правильного экспрессия гена в нейроны после выхода из клеточного цикла.[83]
- В A. thaliana, конденсин II необходим для толерантности к избыточному стрессу бором, возможно, за счет облегчения повреждения ДНК.[63]
- В клетках млекопитающих, вероятно, конденсин II участвует в регуляции интерфазной архитектуры и функции хромосом. Напр., В человеческих клетках конденсин II участвует в инициации разрешения сестринских хроматид во время S фазы, задолго до митотической профазы, когда сестринские хроматиды становятся цитологически видимыми.[84]
- В мышке межфазный ядра, перицентромерные гетерохроматин на разных хромосомах связывается друг с другом, образуя большую структуру, известную как хромоцентры. Клетки, дефицитные по конденсину II, но не по конденсину I, обнаруживают гиперкластеризацию хромоцентров, указывая тем самым, что конденсин II играет специфическую роль в подавлении кластеризации хромоцентров.[58]
- В то время как ранние исследования предполагали возможность того, что конденсины могут напрямую участвовать в регулировании экспрессия гена, некоторые недавние исследования опровергают эту гипотезу.[85][86]
Посттрансляционные модификации
Субъединицы конденсина подвергаются различным посттрансляционным модификациям в зависимости от клеточного цикла. Среди них наиболее изученным примером является фосфорилирование.[87] Например, Cdk1 (Циклинзависимая киназа 1) активирует конденсин I,[38] в то время как CK2 (Казеинкиназа 2) отрицательно регулируют его активность.[88]
| сложный | подразделение | разновидность | сайт фосфорилирования | киназа | ссылка |
|---|---|---|---|---|---|
| конденсин I и II | SMC4 | С. Помбе | T19 | Cdk1 | [12] |
| С. cerevisiae | много | Cdk1 | [89] | ||
| конденсин I | CAP-D2 | X. laevis | Т1314, Т1348, Т1353 | Cdk1 | [38][44] |
| CAP-H | Х. сапиенс | S570 | CK2 | [88] | |
| Х. сапиенс | S70 | Аврора Б | [90] | ||
| С. Помбе | S5, S41, S52 | Аврора Б | [90][91] | ||
| CAP-D2, -G, -H | Х. сапиенс | - | Аврора Б | [92] | |
| С. cerevisiae | много | поло / Cdc5 | [37] | ||
| конденсин II | CAP-D3 | Х. сапиенс | T1415 | Cdk1 | [93] |
| Х. сапиенс | S1419 | Plk1 | [93] | ||
| CAP-G2 | Х. сапиенс | T1010 (связывание PBD) | ? | [94] | |
| CAP-H2 | Х. сапиенс | S492 | Mps1 | [95] | |
| D. melanogaster | - | CK1α | [96] |
Сообщается, что в D. melanogaster субъединица CAP-H2 конденсина II разлагается под действием SCFSlimb убиквитинлигаза.[97]
Актуальность для болезней
Было продемонстрировано, что MCPH1, один из белков, ответственных за первичный микроцефалия, обладает способностью отрицательно регулировать конденсин II.[98] В mcph1 В клетках пациента конденсин II (но не конденсин I) гиперактивируется, что приводит к преждевременной конденсации хромосом в фазе G2 (то есть перед входом в митоз).[99] Однако нет доказательств того, что неправильная регуляция конденсина II напрямую связана с этиологией mcph1 микроцефалия. Совсем недавно сообщалось, что гипоморфный мутации в субъединицах конденсина I или II вызывают микроцефалию у людей.[100] У мышей гипоморфный мутации в субъединицах конденсина II вызывают специфические дефекты в Т-клетка разработка,[101] ведущий к Лимфома Т-клеток.[102] Интересно отметить, что типы клеток со специализированными режимами деления клеток, такими как нервные стволовые клетки и Т-клетки, особенно чувствительны к мутациям в субъединицах конденсина.
Эволюционные последствия
Прокариоты имеют примитивные типы конденсинов,[17][18] указывая, что эволюционное происхождение конденсинов предшествует происхождению гистонов. Тот факт, что конденсины I и II широко консервативны среди существующих видов эукариот, сильно указывает на то, что последний общий предок эукариот (LECA ) имели оба комплекса.[59] Поэтому разумно предположить, что некоторые виды, такие как грибы, потеряли конденсин II во время эволюция.
Тогда почему многие эукариоты иметь два разных комплекса конденсина? Как обсуждалось выше, относительный вклад конденсинов I и II в митоз варьирует у разных организмов. Они играют не менее важную роль в митозе млекопитающих, тогда как конденсин I играет преобладающую роль по сравнению с конденсином II у многих других видов. У этих видов конденсин II мог быть адаптирован для различных несущественных функций, кроме митоз.[63][81] Хотя не существует очевидной взаимосвязи между появлением конденсина II и размером геномов, похоже, что функциональный вклад конденсина II становится большим по мере увеличения размера генома.[14][58] Относительный вклад двух комплексов конденсина в архитектуру митотических хромосом также изменяется во время развития, оказывая влияние на морфологию митотических хромосом.[56] Таким образом, баланс конденсинов I и II, по-видимому, отрегулирован как в эволюции, так и в развитии.
Родственники
У эукариотических клеток есть два дополнительных класса Белок SMC комплексы. Cohesin содержит SMC1 и SMC3 и участвует в слипании сестринских хроматид. Комплекс SMC5 / 6 содержит SMC5 и SMC6 и участвует в рекомбинационной репарации.
Смотрите также
- хромосома
- нуклеоид
- митоз
- мейоз
- клеточный цикл
- когезин
- Белок SMC
- АТФаза
- HEAT повтор
- Топоизомераза II
- ДНК суперспираль
Рекомендации
- ^ Хирано Т. (2016). «Организация хромосом на основе конденсина от бактерий до позвоночных». Клетка. 164 (5): 847–857. Дои:10.1016 / j.cell.2016.01.033. PMID 26919425.
- ^ Калицис П., Чжан Т., Маршалл К.М., Нильсен С.Ф., Хадсон Д.Ф. (2017). «Конденсин, мастер-организатор генома». Хромосома Res. 25 (1): 61–76. Дои:10.1007 / s10577-017-9553-0. PMID 28181049. S2CID 28241964.CS1 maint: использует параметр авторов (связь)
- ^ Хирано Т., Кобаяши Р., Хирано М. (1997). «Конденсины, комплекс конденсации хромосом, содержащий XCAP-C, XCAP-E и гомолог Xenopus белка Drosophila Barren». Клетка. 89 (4): 511–21. Дои:10.1016 / S0092-8674 (00) 80233-0. PMID 9160743. S2CID 15061740.
- ^ а б Оно Т., Лосада А., Хирано М., Майерс М.П., Нойвальд А.Ф., Хирано Т. (2003). «Дифференциальный вклад конденсина I и конденсина II в архитектуру митотических хромосом в клетках позвоночных». Клетка. 115 (1): 109–21. Дои:10.1016 / s0092-8674 (03) 00724-4. PMID 14532007. S2CID 18811084.CS1 maint: несколько имен: список авторов (связь)
- ^ Ульманн Ф (2016). «Комплексы SMC: от ДНК до хромосом». Nat. Преподобный Мол. Cell Biol. 17 (7): 399–412. Дои:10.1038 / nrm.2016.30. PMID 27075410. S2CID 20398243.
- ^ Яцкевич С, Родос Дж, Нэсмит К. (2019). «Организация хромосомной ДНК комплексами SMC». Анну. Преподобный Жене. 53: 445–482. Дои:10.1146 / annurev-genet-112618-043633. PMID 31577909.CS1 maint: использует параметр авторов (связь)
- ^ а б Schleiffer A, Kaitna S, Maurer-Stroh S, Glotzer M, Nasmyth K, Eisenhaber F (2003). «Клейсины: суперсемейство бактериальных и эукариотических белков-партнеров SMC». Мол. Клетка. 11 (3): 571–5. Дои:10.1016 / S1097-2765 (03) 00108-4. PMID 12667442.
- ^ Нойвальд А.Ф., Хирано Т. (2000). «Повторы HEAT, связанные с конденсинами, когезинами и другими комплексами, участвующими в функциях, связанных с хромосомами». Genome Res. 10 (10): 1445–52. Дои:10.1101 / гр.147400. ЧВК 310966. PMID 11042144.
- ^ Херцог С., Нагаркар Джайсвал С., Урбан Е., Ример А., Фишер С., Хайдманн С.К. (2013). «Функциональное вскрытие субъединицы конденсина Cap-G Drosophila melanogaster показывает ее исключительную ассоциацию с конденсином I». PLOS Genet. 9 (4): e1003463. Дои:10.1371 / journal.pgen.1003463. ЧВК 3630105. PMID 23637630.CS1 maint: несколько имен: список авторов (связь)
- ^ Кинг, Томас Д; Леонард, Кристофер Дж; Купер, Джейкоб С; Нгуен, Сын; Джойс, Эрик Ф; Фаднис, Нитин; Такахаши, Ая (октябрь 2019 г.). «Периодические потери и быстрая эволюция комплекса конденсина II у насекомых». Молекулярная биология и эволюция. 36 (10): 2195–2204. Дои:10.1093 / molbev / msz140. ЧВК 6759200. PMID 31270536.
- ^ а б Csankovszki G, Collette K, Spahl K, Carey J, Снайдер M, Петти E, Patel U, Tabuchi T, Liu H, McLeod I., Thompson J, Sarkeshik A, Yates J, Meyer BJ, Hagstrom K (2009). «Три различных комплекса конденсина контролируют динамику хромосомы C. elegans». Curr. Биол. 19 (1): 9–19. Дои:10.1016 / j.cub.2008.12.006. ЧВК 2682549. PMID 19119011.
- ^ а б c Сутани Т., Юаса Т., Томонага Т., Дохмае Н., Такио К., Янагида М. (1999). «Конденсиновый комплекс делящихся дрожжей: важная роль субъединиц, не относящихся к SMC, для конденсации и фосфорилирования Cdc2 Cut3 / SMC4». Genes Dev. 13 (17): 2271–83. Дои:10.1101 / gad.13.17.2271. ЧВК 316991. PMID 10485849.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Фриман Л, Арагон-Алькаид Л, Струнников А (2000). «Конденсиновый комплекс управляет конденсацией хромосом и митотической передачей рДНК». J. Cell Biol. 149 (4): 811–824. Дои:10.1083 / jcb.149.4.811. ЧВК 2174567. PMID 10811823.
- ^ а б c Фудзивара Т., Танака К., Куроива Т., Хирано Т. (2013). «Пространственно-временная динамика конденсинов I и II: эволюционное понимание примитивной красной водоросли Cyanidioschyzon merolae». Мол. Биол. Клетка. 24 (16): 2515–27. Дои:10.1091 / mbc.E13-04-0208. ЧВК 3744952. PMID 23783031.CS1 maint: несколько имен: список авторов (связь)
- ^ Ховард-Тилль Р., Лойдл Дж. (2018). «Конденсины способствуют индивидуализации и сегрегации хромосом во время митоза, мейоза и амитоза у Tetrahymena thermophila». Мол. Биол. Клетка. 29 (4): 466–478. Дои:10.1091 / mbc.E17-07-0451. ЧВК 6014175. PMID 29237819.
- ^ Ховард-Тилль, Рэйчел; Тиан, Мяо; Лойдл, Йозеф; Коэн-Фикс, Орна (15 мая 2019 г.). «Специализированный комплекс конденсина участвует в созревании соматических ядер». Молекулярная биология клетки. 30 (11): 1326–1338. Дои:10.1091 / mbc.E18-08-0487. ЧВК 6724606. PMID 30893010.
- ^ а б Маскаренхас Дж., Соппа Дж., Струнников А.В., Грауманн П.Л. (2002). «Зависимая от клеточного цикла локализация двух новых прокариотических белков сегрегации и конденсации хромосом в Bacillus subtilis, которые взаимодействуют с белком SMC». EMBO J. 21 (12): 3108–18. Дои:10.1093 / emboj / cdf314. ЧВК 126067. PMID 12065423.
- ^ а б Ямазоэ М., Оноги Т., Сунако Ю., Ники Х., Яманака К., Ичимура Т., Хирага С. (1999). «Комплексное образование белков MukB, MukE и MukF, участвующих в разделении хромосом у Escherichia coli». EMBO J. 18 (21): 5873–84. Дои:10.1093 / emboj / 18.21.5873. ЧВК 1171653. PMID 10545099.
- ^ Палецек Дж. Дж., Грубер С. (2015). «Белки капусты: суперсемейство партнеров SMC / клейзина, сохраненных у бактерий, архей и эукариот». Структура. 23 (12): 2183–2190. Дои:10.1016 / j.str.2015.10.004. PMID 26585514.
- ^ Петрушенко З.М., Она З, Рыбенков В.В. (2011). «Новое семейство бактериальных конденсинов». Мол. Микробиол. 81 (4): 881–896. Дои:10.1111 / j.1365-2958.2011.07763.x. ЧВК 3179180. PMID 21752107.CS1 maint: несколько имен: список авторов (связь)
- ^ Мелби Т. Е., Чампальо С. Н., Бриско Дж., Эриксон Х. П. (1998). «Симметричная структура структурного поддержания хромосом (SMC) и белков MukB: длинные антипараллельные спиральные спирали, сложенные на гибком шарнире». J. Cell Biol. 142 (6): 1595–1604. Дои:10.1083 / jcb.142.6.1595. ЧВК 2141774. PMID 9744887.
- ^ Андерсон Д.Е., Лосада А., Эриксон Н.П., Хирано Т. (2002). «Конденсин и когезин демонстрируют разные формы плеч с характерными углами поворота». J. Cell Biol. 156 (6): 419–424. Дои:10.1083 / jcb.200111002. ЧВК 2173330. PMID 11815634.
- ^ Онн I, Аоно Н., Хирано М., Хирано Т. (2007). «Реконструкция и субъединичная геометрия конденсиновых комплексов человека». EMBO J. 26 (4): 1024–1034. Дои:10.1038 / sj.emboj.7601562. ЧВК 1852836. PMID 17268547.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Хасслер М., Шалтиэль И.А., Кшонсак М., Саймон Б., Меркель Ф., Таричен Л., Бейли Х. Дж., Макошек Дж., Браво С., Мец Дж., Хенниг Дж., Херинг СН (2019). «Структурные основы асимметричного конденсинового АТФазного цикла». Mol Cell. 74 (6): 1175–1188.e24. Дои:10.1016 / j.molcel.2019.03.037. ЧВК 6591010. PMID 31226277.CS1 maint: несколько имен: список авторов (связь)
- ^ Феннелл-Феззи Р., Градиа С.Д., Акей Д., Бергер Дж. М. (2005). «Субъединица MukF конденсина Escherichia coli: архитектура и функциональная связь с клейзинами». EMBO J. 24 (11): 1921–1930. Дои:10.1038 / sj.emboj.7600680. ЧВК 1142612. PMID 15902272.CS1 maint: несколько имен: список авторов (связь)
- ^ Woo JS, Lim JH, Shin HC, Suh MK, Ku B, Lee KH, Joo K, Robinson H, Lee J, Park SY, Ha NC, Oh BH (2009). «Структурные исследования бактериального комплекса конденсина выявляют АТФ-зависимое нарушение межсубъединичных взаимодействий». Клетка. 136 (1): 85–96. Дои:10.1016 / j.cell.2008.10.050. PMID 19135891. S2CID 4608756.CS1 maint: несколько имен: список авторов (связь)
- ^ Бюрманн Ф., Шин Х.С., Баскин Дж., Сох Ю.М., Хименес-Ойя В., Ким Ю.Г., О Б.Х., Грубер С. (2013). «Асимметричный SMC-клейзиновый мостик в прокариотическом конденсине». Nat. Struct. Мол. Биол. 20 (3): 371–379. Дои:10.1038 / nsmb.2488. PMID 23353789. S2CID 21584205.CS1 maint: несколько имен: список авторов (связь)
- ^ Камада К., Мията М., Хирано Т. (2013). «Молекулярные основы активации SMC-АТФазы: роль внутренних структурных изменений регуляторного субкомплекса ScpAB». Структура. 21 (4): 581–594. Дои:10.1016 / j.str.2013.02.016. PMID 23541893.CS1 maint: несколько имен: список авторов (связь)
- ^ Гризе Дж. Дж., Витте Дж., Хопфнер К. П. (2010). «Структура и ДНК-связывающая активность шарнирного домена конденсина мыши подчеркивают общие и разнообразные особенности белков SMC». Нуклеиновые кислоты Res. 38 (10): 3454–3465. Дои:10.1093 / nar / gkq038. ЧВК 2879519. PMID 20139420.CS1 maint: несколько имен: список авторов (связь)
- ^ Soh Y, Bürmann F, Shin H, Oda T, Jin KS, Toseland CP, Kim C, Lee H, Kim SJ, Kong M, Durand-Diebold M, Kim Y, Kim HM, Lee NK, Sato M, Oh B, Грубер С (2015). «Молекулярная основа формирования стержня SMC и его растворение при связывании ДНК». Мол. Клетка. 57 (2): 290–303. Дои:10.1016 / j.molcel.2014.11.023. ЧВК 4306524. PMID 25557547.CS1 maint: несколько имен: список авторов (связь)
- ^ а б c Кшонсак М, Меркель Ф, Бишт С., Мец Дж., Рыбин В., Хасслер М, Херинг Ч. (2017). «Структурная основа механизма ремня безопасности, который прикрепляет конденсин к хромосомам». Клетка. 171 (3): 588–600.e24. Дои:10.1016 / j.cell.2017.09.008. ЧВК 5651216. PMID 28988770.CS1 maint: несколько имен: список авторов (связь)
- ^ Хара, Кодаи; Киношита, Казухиса; Мигита, Томоко; Мураками, Кей; Симидзу, Кеничиро; Такеучи, Кодзо; Хирано, Тацуя; Хашимото, Хироши (12 марта 2019 г.). «Структурная основа взаимодействий HEAT-клейзин в субкомплексе конденсина I человека». Отчеты EMBO. 20 (5). Дои:10.15252 / наб.201847183. ЧВК 6501013. PMID 30858338.
- ^ Eeftens JM, Katan AJ, Kschonsak M, Hassler M, de Wilde L, Dief EM, Haering CH, Dekker C (2016). «Димеры Condensin Smc2-Smc4 гибкие и динамичные». Сотовый представитель. 14 (8): 1813–1818. Дои:10.1016 / j.celrep.2016.01.063. ЧВК 4785793. PMID 26904946.CS1 maint: несколько имен: список авторов (связь)
- ^ Кимура К., Хирано Т. (1997). «АТФ-зависимая положительная суперспирализация ДНК 13S конденсином: биохимическое значение для конденсации хромосом». Клетка. 90 (4): 625–634. Дои:10.1016 / s0092-8674 (00) 80524-3. PMID 9288743. S2CID 15876604.
- ^ Кимура К., Рыбенков В.В., Крисона Н.Дж., Хирано Т., Коццарелли Н.Р. (1999). «13S конденсин активно реконфигурирует ДНК, создавая глобальные позитивные корни: последствия для конденсации хромосом». Клетка. 98 (2): 239–248. Дои:10.1016 / s0092-8674 (00) 81018-1. PMID 10428035. S2CID 16671030.CS1 maint: несколько имен: список авторов (связь)
- ^ Хагстром К.А., Холмс В.Ф., Коццарелли Н.Р., Мейер Б.Дж. (2002). «Конденсин C. elegans способствует архитектуре митотической хромосомы, организации центромер и сегрегации сестринских хроматид во время митоза и мейоза». Genes Dev. 16 (6): 729–742. Дои:10.1101 / gad.968302. ЧВК 155363. PMID 11914278.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Сен-Пьер Дж., Дузих М., Базиль Ф., Паскариу М., Бонней Э., Сове В., Рацима Х, Д'Амур Д. (2009). «Полокиназа регулирует конденсацию митотических хромосом за счет гиперактивации активности суперспирализации конденсиновой ДНК». Mol Cell. 120 (Pt 7): 1245–1255. Дои:10.1016 / j.molcel.2009.04.013. PMID 19481522.CS1 maint: несколько имен: список авторов (связь)
- ^ а б c Кимура К., Хирано М., Кобаяши Р., Хирано Т. (1998). «Фосфорилирование и активация 13S конденсина с помощью Cdc2 in vitro». Наука. 282 (5388): 487–490. Дои:10.1126 / science.282.5388.487. PMID 9774278.
- ^ Бакстер Дж., Сен Н., Мартинес В. Л., Де Карандини М. Е., Шварцман Дж. Б., Диффли Дж. Ф., Арагон Л. (2011). «Положительная суперспирализация митотической ДНК приводит к декатенации топоизомеразой II у эукариот». Наука. 331 (6022): 1328–1332. Дои:10.1126 / science.1201538. PMID 21393545. S2CID 34081946.CS1 maint: несколько имен: список авторов (связь)
- ^ Стрик Т.Р., Кавагути Т., Хирано Т. (2004). «Обнаружение в реальном времени уплотнения ДНК одной молекулы конденсином I». Curr. Биол. 14 (10): 874–880. Дои:10.1016 / j.cub.2004.04.038. PMID 15186743. S2CID 10078994.CS1 maint: несколько имен: список авторов (связь)
- ^ Теракава Т., Бишт С., Эфтенс Дж. М., Деккер С., Херинг С.Х., Грин ЕС (2017). «Конденсиновый комплекс - это механохимический двигатель, который перемещается вдоль ДНК». Наука. 358 (6363): 672–676. Дои:10.1126 / science.aan6516. ЧВК 5862036. PMID 28882993.CS1 maint: несколько имен: список авторов (связь)
- ^ Ганджи М., Шалтиэль И.А., Бишт С., Ким Э., Каличава А., Херинг С.Х., Деккер С. (2018). «Визуализация экструзии петли ДНК конденсином в реальном времени». Наука. 360 (6384): 102–105. Дои:10.1126 / science.aar7831. ЧВК 6329450. PMID 29472443.CS1 maint: несколько имен: список авторов (связь)
- ^ Ким Э., Керсемакерс Дж., Шалтиэль И.А., Херинг С.Х., Деккер С. (2020). «ДНК-петля, экструдирующая комплексы конденсина, может пересекать друг друга». Природа. 579 (7799): 438–442. Дои:10.1038 / s41586-020-2067-5. PMID 32132705. S2CID 212407150.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Синтоми К., Такахаши Т.С., Хирано Т. (2015). «Восстановление митотических хроматид с минимальным набором очищенных факторов». Nat Cell Biol. 17 (8): 1014–1023. Дои:10.1038 / ncb3187. PMID 26075356. S2CID 8332012.CS1 maint: несколько имен: список авторов (связь)
- ^ Синтоми К., Иноуэ Ф, Ватанабэ Х, Осуми К., Осуги М., Хирано Т. (2017). "Сборка митотических хромосом, несмотря на истощение нуклеосом в Xenopus яичные экстракты ". Наука. 356 (6344): 1284–1287. Дои:10.1126 / science.aam9702. PMID 28522692.CS1 maint: несколько имен: список авторов (связь)
- ^ Сутани Т., Янагида М. (1997). «Активность ренатурации ДНК комплекса SMC, участвующего в конденсации хромосом». Природа. 388 (6644): 798–801. Дои:10.1038/42062. PMID 9285594. S2CID 4332572.
- ^ Piazza I, Rutkowska A, Ori A, Walczak M, Metz J, Pelechano V, Beck M, Haering CH (2014). «Ассоциация конденсина с хромосомами зависит от связывания ДНК его субъединицами HEAT-повторов». Нат Структ Мол Биол. 21 (6): 560–568. Дои:10.1038 / nsmb.2831. PMID 24837193. S2CID 10741875.CS1 maint: несколько имен: список авторов (связь)
- ^ Киношита К., Кобаяши Т.Дж., Хирано Т. (2015). «Балансировка двух субъединиц HEAT конденсина I поддерживает динамическую сборку хромосомных осей». Dev Cell. 33 (1): 94–106. Дои:10.1016 / j.devcel.2015.01.034. PMID 25850674.CS1 maint: несколько имен: список авторов (связь)
- ^ Йошимура SH, Хирано Т. (2016). "HEAT повторы - универсальные массивы амфифильных спиралей, работающих в тесноте?". J. Cell Sci. 129 (21): 3963–3970. Дои:10.1242 / jcs.185710. PMID 27802131.
- ^ Каппель С., Захариа Ю., Дёлькер Н., Грубмюллер Н. (2010). «Необычное гидрофобное ядро придает исключительную гибкость повторяющимся белкам HEAT». Биофиз. J. 99 (5): 1596–1603. Дои:10.1016 / j.bpj.2010.06.032. ЧВК 2931736. PMID 20816072.CS1 maint: несколько имен: список авторов (связь)
- ^ Голобородько, Антон; Имакаев, Максим В; Марко, Джон Ф; Мирный, Леонид (18 мая 2016 г.). «Уплотнение и сегрегация сестринских хроматид посредством экструзии активной петли». eLife. 5. Дои:10.7554 / eLife.14864. ЧВК 4914367. PMID 27192037.
- ^ Ченг, Тэмми МК; Хигер, Себастьян; Chaleil, Raphaël AG; Мэтьюз, Ник; Стюарт, Энгус; Райт, Джон; Лим, Кармей; Бейтс, Пол А; Ульманн, Франк (29 апреля 2015 г.). «Простая биофизическая модель имитирует конденсацию хромосом почкующихся дрожжей». eLife. 4: e05565. Дои:10.7554 / eLife.05565. ЧВК 4413874. PMID 25922992.
- ^ Сакаи, Юдзи; Мотидзуки, Ацуши; Киношита, Казухиса; Хирано, Тацуя; Татикава, Масаси; Морозов, Александр В. (18 июня 2018 г.). «Моделирование функций конденсина в формировании хромосом и сегрегации». PLOS вычислительная биология. 14 (6): e1006152. Дои:10.1371 / journal.pcbi.1006152. ЧВК 6005465. PMID 29912867.
- ^ Оно Т, Фанг Й, Спектор Д.Л., Хирано Т. (2004). «Пространственная и временная регуляция Конденсинов I и II в сборке митотических хромосом в клетках человека». Мол. Биол. Клетка. 15 (7): 3296–308. Дои:10.1091 / mbc.E04-03-0242. ЧВК 452584. PMID 15146063.
- ^ Хирота Т., Герлих Д., Кох Б., Элленберг Дж., Петерс Дж. М. (2004). «Отличительные функции конденсина I и II в сборке митотических хромосом». J. Cell Sci. 117 (Pt 26): 6435–45. Дои:10.1242 / jcs.01604. PMID 15572404.
- ^ а б c Синтоми К., Хирано Т. (2011). «Относительное соотношение конденсина I и II определяет форму хромосом». Genes Dev. 25 (14): 1464–1469. Дои:10.1101 / gad.2060311. ЧВК 3143936. PMID 21715560.
- ^ а б Ли Дж., Огуши С., Сайто М., Хирано Т. (2011). «Конденсины I и II необходимы для построения двухвалентных хромосом в ооцитах мышей». Мол. Биол. Клетка. 22 (18): 3465–3477. Дои:10.1091 / mbc.E11-05-0423. ЧВК 3172270. PMID 21795393.CS1 maint: несколько имен: список авторов (связь)
- ^ а б c d е ж Нишиде К., Хирано Т. (2014). «Перекрывающиеся и неперекрывающиеся функции конденсинов I и II в делениях нервных стволовых клеток». PLOS Genet. 10 (12): e1004847. Дои:10.1371 / journal.pgen.1004847. ЧВК 4256295. PMID 25474630.
- ^ а б c Хирано Т. (2012). «Конденсины: универсальные организаторы хромосом с разнообразными функциями». Genes Dev. 26 (4): 1659–1678. Дои:10.1101 / gad.194746.112. ЧВК 3418584. PMID 22855829.
- ^ Green LC, Kalitsis P, Chang TM, Cipetic M, Kim JH, Marshall O, Turnbull L, Whitchurch CB, Vagnarelli P, Samejima K, Earnshaw WC, Choo KH, Hudson DF (2012). «Противопоставление роли конденсина I и конденсина II в формировании митотических хромосом». J. Cell Sci. 125 (Pt6): 1591–1604. Дои:10.1242 / jcs.097790. ЧВК 3336382. PMID 22344259.CS1 maint: несколько имен: список авторов (связь)
- ^ Сака Ю., Сутани Т., Ямасита Ю., Сайто С., Такеучи М., Накасеко Ю., Янагида М. (1994). «Делящиеся дрожжи cut3 и cut14, члены вездесущего семейства белков, необходимы для конденсации и сегрегации хромосом в митозе». EMBO J. 13 (20): 4938–4952. Дои:10.1002 / j.1460-2075.1994.tb06821.x. ЧВК 395434. PMID 7957061.CS1 maint: несколько имен: список авторов (связь)
- ^ Hudson DF, Vagnarelli P, Gassmann R, Earnshaw WC (2003). «Конденсин необходим для сборки негистонового белка и структурной целостности митотических хромосом позвоночных». Dev. Клетка. 5 (2): 323–336. Дои:10.1016 / с1534-5807 (03) 00199-0. PMID 12919682.CS1 maint: несколько имен: список авторов (связь)
- ^ а б c Сакамото Т., Инуи Ю.Т., Урагучи С., Йошизуми Т., Мацунага С., Мастуи М., Умеда М., Фукуи К., Фудзивара Т. (2011). «Конденсин II уменьшает повреждение ДНК и необходим для устойчивости к стрессу от перегрузки бором у Arabidopsis». Растительная клетка. 23 (9): 3533–3546. Дои:10.1105 / tpc.111.086314. ЧВК 3203421. PMID 21917552.CS1 maint: несколько имен: список авторов (связь)
- ^ Наумова Н, Имакаев М, Фуденберг Г, Жан Й., Ладжой Б.Р., Мирный Л.А., Деккер Дж. (2013). «Организация митотической хромосомы». Наука. 342 (6161): 948–953. Дои:10.1126 / science.1236083. ЧВК 4040465. PMID 24200812.CS1 maint: несколько имен: список авторов (связь)
- ^ Шалбеттер С.А., Голобородько А., Фуденберг Г., Белтон Дж. М., Майлз С., Ю. М., Деккер Дж., Мирный Л., Бакстер Дж. (2017). "SMC комплексы дифференциально компактных митотических хромосом в соответствии с геномным контекстом". Nat Cell Biol. 19 (9): 1071–1080. Дои:10.1038 / ncb3594. ЧВК 5640152. PMID 28825700.CS1 maint: несколько имен: список авторов (связь)
- ^ Лазар-Стефанита Л., Сколари В.Ф., Мерси Дж., Мюллер Х., Герен TM, Тьерри А., Моззиконачи Дж., Кошул Р. (2017). «Когезины и конденсины управляют четырехмерной динамикой дрожжевых хромосом во время клеточного цикла». EMBO J. 36 (18): 2684–2697. Дои:10.15252 / embj.201797342. ЧВК 5599795. PMID 28729434.CS1 maint: несколько имен: список авторов (связь)
- ^ Kakui Y, Rabinowitz A, Barry DJ, Uhlmann F (2017). «Конденсин-опосредованное ремоделирование митотического хроматина у делящихся дрожжей». Нат Жене. 49 (10): 1553–1557. Дои:10,1038 / нг.3938. ЧВК 5621628. PMID 28825727.CS1 maint: несколько имен: список авторов (связь)
- ^ Танизава Х., Ким К.Д., Ивасаки О., Нома К.И. (2017). «Архитектурные изменения генома делящихся дрожжей во время клеточного цикла». Нат Структ Мол Биол. 24 (11): 965–976. Дои:10.1038 / nsmb.3482. ЧВК 5724045. PMID 28991264.CS1 maint: несколько имен: список авторов (связь)
- ^ Gibcus, Johan H .; Самедзима, Кумико; Голобородько, Антон; Самедзима, Итару; Наумова Наталья; Нюблер, Йоханнес; Канемаки, Масато Т .; Се, Линьфэн; Полсон, Джеймс Р .; Эрншоу, Уильям С.; Мирный, Леонид А .; Деккер, Джоб (9 февраля 2018 г.). «Путь образования митотических хромосом». Наука. 359 (6376): eaao6135. Дои:10.1126 / science.aao6135. ЧВК 5924687. PMID 29348367.
- ^ Вальтер, Найк; Хоссейн, М. Юлиус; Politi, Антонио З .; Кох, Биргит; Кюблбек, Мориц; Ødegård-Fougner, Øyvind; Лампе, Марко; Элленберг, янв (2 июля 2018 г.). «Количественная карта конденсинов человека дает новое понимание архитектуры митотических хромосом». Журнал клеточной биологии. 217 (7): 2309–2328. Дои:10.1083 / jcb.201801048. ЧВК 6028534. PMID 29632028.
- ^ Ю. Х. Г., Кошланд Д. Е. (2003). «Мейотический конденсин необходим для правильного уплотнения хромосом, сборки SC и разрешения зависимых от рекомбинации хромосомных связей». J. Cell Biol. 163 (5): 937–947. Дои:10.1083 / jcb.200308027. ЧВК 2173617. PMID 14662740.
- ^ Хартл Т.А., Суини С.Дж., Кнеплер П.Дж., Bosco G (2008). «Condensin II разрешает хромосомные ассоциации, чтобы сделать возможным сегрегацию анафазы I в мейозе самцов дрозофилы». PLOS Genet. 4 (10): e1000228. Дои:10.1371 / journal.pgen.1000228. ЧВК 2562520. PMID 18927632.CS1 maint: несколько имен: список авторов (связь)
- ^ Резник Т.Д., Дедж К.Дж., Сян Ю., Хоули Р.С., Ан С., Орр-Уивер Т.Л. (2009). «Мутации в хромосомном комплексе-пассажире и комплексе конденсина по-разному влияют на разборку синаптонемного комплекса и конфигурацию метафазы I в мейозе самок дрозофилы». Генетика. 181 (3): 875–887. Дои:10.1534 / генетика.108.097741. ЧВК 2651061. PMID 19104074.CS1 maint: несколько имен: список авторов (связь)
- ^ Чан Р.К., Северсон А.Ф., Мейер Б.Дж. (2004). «Конденсин реструктурирует хромосомы при подготовке к мейотическим делениям». J. Cell Biol. 167 (4): 613–625. Дои:10.1083 / jcb.200408061. ЧВК 2172564. PMID 15557118.CS1 maint: несколько имен: список авторов (связь)
- ^ Хулард М., Годвин Дж., Метсон Дж., Ли Дж., Хирано Т., Нэсмит К. (2015). «Конденсин придает продольную жесткость хромосом». Nat Cell Biol. 17 (6): 771–81. Дои:10.1038 / ncb3167. ЧВК 5207317. PMID 25961503.CS1 maint: несколько имен: список авторов (связь)
- ^ Джозука К., Терасава М., Огава Х., Огава Т., Хориучи Т. (2006). «Конденсин, загруженный на сайт барьера репликационной вилки в гене рРНК, повторяется во время фазы S FOB1-зависимым образом, чтобы предотвратить сокращение длинного повторяющегося массива в Saccharomyces cerevisiae». Mol Cell Biol. 26 (6): 2226–2236. Дои:10.1128 / MCB.26.6.2226-2236.2006. ЧВК 1430289. PMID 16507999.
- ^ Haeusler RA, Pratt-Hyatt M, Good PD, Gipson TA, Engelke DR (2008). «Кластеризация генов тРНК дрожжей опосредуется специфической ассоциацией конденсина с комплексами транскрипции генов тРНК». Genes Dev. 22 (16): 2204–2214. Дои:10.1101 / gad.1675908. ЧВК 2518813. PMID 18708579.
- ^ Аоно Н., Сутани Т., Томонага Т., Мочида С., Янагида М. (2002). «Cnd2 выполняет двойную роль в митотической конденсации и интерфазе». Природа. 417 (6885): 197–202. Дои:10.1038 / 417197a. PMID 12000964. S2CID 4332524.CS1 maint: несколько имен: список авторов (связь)
- ^ Ивасаки О, Танака А, Танизава Х, Гревал С.И., Нома К. (2010). «Центромерная локализация диспергированных генов Pol III у делящихся дрожжей». Мол. Биол. Клетка. 21 (2): 254–265. Дои:10.1091 / mbc.e09-09-0790. ЧВК 2808234. PMID 19910488.CS1 maint: несколько имен: список авторов (связь)
- ^ Крейн Э, Биан К., МакКорд Р.П., Ладжуа Б.Р., Уиллер Б.С., Ральстон Э.Дж., Узава С., Деккер Дж., Мейер Б.Дж. (2015). «Конденсин-управляемое ремоделирование топологии Х-хромосомы во время дозовой компенсации». Природа. 523 (7559): 210–244. Дои:10.1038 / природа14450. ЧВК 4498965. PMID 26030525.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Хартл Т.А., Смит Х.Ф., Bosco G (2008). «Выравнивание хромосом и трансвекция противодействуют конденсину II». Наука. 322 (5906): 1384–1387. Дои:10.1126 / science.1164216. PMID 19039137. S2CID 5154197.
- ^ Бауэр CR, Хартл Т.А., Bosco G (2012). «Конденсин II способствует формированию хромосомных территорий, вызывая осевое уплотнение полиплоидных интерфазных хромосом». PLOS Genet. 8 (8): e1002873. Дои:10.1371 / journal.pgen.1002873. ЧВК 3431300. PMID 22956908.
- ^ Хассан А., Арагуас Родригес П., Хайдманн С.К., Уолмсли Е.Л., Огхи Г.Н., Саутхолл Т.Д. (2020). «Субъединица конденсина I Cap-G необходима для правильной экспрессии генов во время созревания постмитотических нейронов». eLife. 9: e55159. Дои:10.7554 / eLife.55159. ЧВК 7170655. PMID 32255428.CS1 maint: использует параметр авторов (связь)
- ^ Оно Т., Ямасита Д., Хирано Т. (2013). «Конденсин II инициирует разделение сестринских хроматид во время S фазы». J. Cell Biol. 200 (4): 429–441. Дои:10.1083 / jcb.201208008. ЧВК 3575537. PMID 23401001.CS1 maint: несколько имен: список авторов (связь)
- ^ Пол MR, Марковиц Т.Э., Hochwagen A, Ercan S (2018). «Истощение конденсина вызывает разуплотнение генома без изменения уровня глобальной экспрессии генов у Saccharomyces cerevisiae». Генетика. 210 (1): 331–344. Дои:10.1534 / генетика.118.301217. ЧВК 6116964. PMID 29970489.CS1 maint: несколько имен: список авторов (связь)
- ^ Hocquet C, Robellet X, Modolo L, Sun XM, Burny C, Cuylen-Haering S, Toselli E, Clauder-Münster S, Steinmetz L, Haering CH, Marguerat S, Bernard P (2018). «Конденсин контролирует клеточные уровни РНК посредством точной сегрегации хромосом вместо прямого регулирования транскрипции». eLife. 7: e38517. Дои:10.7554 / eLife.38517. ЧВК 6173581. PMID 30230473.CS1 maint: несколько имен: список авторов (связь)
- ^ Базиль Ф, Сен-Пьер Дж, Д'Амур Д. (2010). «Трехступенчатая модель активации конденсина во время конденсации митотических хромосом». Клеточный цикл. 9 (16): 3243–3255. Дои:10.4161 / cc.9.16.12620. PMID 20703077.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Такемото А., Кимура К., Янагисава Дж., Йокояма С., Ханаока Ф. (2006). «Отрицательная регуляция конденсина I посредством CK2-опосредованного фосфорилирования». EMBO J. 25 (22): 5339–5348. Дои:10.1038 / sj.emboj.7601394. ЧВК 1636611. PMID 17066080.CS1 maint: несколько имен: список авторов (связь)
- ^ Робелле Икс, Таттикота И, Ван Ф, Ви Т.Л., Паскариу М., Шанкар С., Боннейл Э, Браун С.М., Д'Амур Д. (2015). «Высокочувствительный фосфопереключатель, запускаемый Cdk1, управляет морфогенезом хромосомы во время деления клетки». Genes Dev. 29 (4): 426–439. Дои:10.1101 / gad.253294.114. ЧВК 4335297. PMID 25691469.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Тада К., Сусуму Х, Сакуно Т, Ватанабэ Ю. (2011). «Ассоциация конденсина с гистоном H2A формирует митотические хромосомы». Природа. 474 (7352): 477–483. Дои:10.1038 / природа10179. PMID 21633354. S2CID 205225378.CS1 maint: несколько имен: список авторов (связь)
- ^ Накадзава Н., Мехротра Р., Эбе М., Янагида М. (2011). «Конденсин, фосфорилированный Aurora-B-подобной киназой Ark1, постоянно требуется до тех пор, пока не будет телофаза в режиме, отличном от Top2». J Cell Sci. 124 (Pt 11): 1795–1807. Дои:10.1242 / jcs.078733. PMID 21540296.CS1 maint: несколько имен: список авторов (связь)
- ^ Липп Дж. Дж., Хирота Т., Позер I, Петерс Дж. М. (2007). «Аврора B контролирует ассоциацию конденсина I, но не конденсина II, с митотическими хромосомами». J Cell Sci. 120 (Pt 7): 1245–1255. Дои:10.1242 / jcs.03425. PMID 17356064.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Абэ С., Нагасака К., Хираяма Ю., Кодзука-Хата Х, Ояма М., Аояги Ю., Обусе С., Хирота Т. (2011). «Начальная фаза конденсации хромосом требует Cdk1-опосредованного фосфорилирования субъединицы CAP-D3 конденсина II». Genes Dev. 25 (8): 863–874. Дои:10.1101 / gad.2016411. ЧВК 3078710. PMID 21498573.CS1 maint: несколько имен: список авторов (связь)
- ^ Ким Дж.Х., Шим Дж., Джи М.Дж., Чон И, Бонг С.М., Чан Й.Дж., Юн Е.К., Ли С.Дж., Ким КГ, Ким Й.Х., Ли Си, Ли Би Би, Ким К.Т. (2014). «Компонент конденсина NCAPG2 регулирует прикрепление микротрубочек к кинетохорам посредством привлечения Polo-подобной киназы 1 к кинетохорам». Nat Commun. 5: 4588. Дои:10.1038 / ncomms5588. PMID 25109385.CS1 maint: несколько имен: список авторов (связь)
- ^ Кагами Ю., Нихира К., Вада С., Оно М., Хонда М., Йошида К. (2014). «Фосфорилирование Mps1 конденсина II контролирует конденсацию хромосом в начале митоза». J. Cell Biol. 205 (6): 781–790. Дои:10.1083 / jcb.201308172. ЧВК 4068140. PMID 24934155.CS1 maint: несколько имен: список авторов (связь)
- ^ Штаб-квартира Нгуена, Най Дж., Бастер Д.В., Клебба Дж. Э., Роджерс Г.К., Bosco G (2015). «Казеинкиназа I альфа дрозофилы регулирует спаривание гомологов и организацию генома путем модуляции уровней Cap-H2 субъединицы конденсина II». PLOS Genet. 11 (2): e1005014. Дои:10.1371 / journal.pgen.1005014. ЧВК 4344196. PMID 25723539.CS1 maint: несколько имен: список авторов (связь)
- ^ Бастер Д.В., Дэниел С.Г., штаб-квартира Нгуена, Виндлер С.Л., Скварек Л.С., Петерсон М., Робертс М., Месерв Дж. Х., Хартл Т., Клебба Д. Э., Билдер Д., Боско Дж., Роджерс Г. К. (2013). «Убиквитинлигаза SCFSlimb подавляет реорганизацию ядра, опосредованную конденсином II, за счет разрушения Cap-H2». J. Cell Biol. 201 (1): 49–63. Дои:10.1083 / jcb.201207183. ЧВК 3613687. PMID 23530065.CS1 maint: несколько имен: список авторов (связь)
- ^ Ямасита Д., Синтоми К., Оно Т., Гаввовидис И., Шиндлер Д., Нейтцель Х., Тримборн М., Хирано Т. (2011). «MCPH1 регулирует конденсацию и формирование хромосом как композитный модулятор конденсина II». J. Cell Biol. 194 (6): 841–854. Дои:10.1083 / jcb.201106141. ЧВК 3207293. PMID 21911480.CS1 maint: несколько имен: список авторов (связь)
- ^ Тримборн М., Шиндлер Д., Нейтцель Н., Хирано Т. (2006). «Неправильная регуляция конденсации хромосом в первичной микроцефалии MCPH1 опосредуется конденсином II». Клеточный цикл. 5 (3): 322–326. Дои:10.4161 / cc.5.3.2412. PMID 16434882.CS1 maint: несколько имен: список авторов (связь)
- ^ Мартин КА, Мюррей Дж., Кэрролл П., Лейтч А., Маккензи К. Дж., Халачев М., Фетит А. Е., Кейт С., Бикнелл Л. С., Флейто А., Готье П., Холл Е. А., Джосс С., Соареш Дж., Сильва Дж., Бобер М. Б., Дукер А. , Wise CA, Куигли AJ, Phadke SR, Расшифровка исследования нарушений развития., Wood AJ, Vagnarelli P, Jackson AP (2016). «Мутации в генах, кодирующих белки комплекса конденсина, вызывают микроцефалию из-за отказа декатенации при митозе». Genes Dev. 30 (19): 2158–2172. Дои:10.1101 / gad.286351.116. ЧВК 5088565. PMID 27737959.CS1 maint: несколько имен: список авторов (связь)
- ^ Гослинг К.М., Макаров Л.Е., Теодоратос А., Ким Ю.Х., Уиттл Б., Руи Л., Ву Х., Хонг Н.А., Кеннеди Г.К., Фриц Д.А., Йетс А.Л., Гуднау С.К., Фарер А.М. (2007). «Мутация в субъединице конденсина II хромосомы, бета-клейзине, специфически нарушает развитие Т-клеток». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 104 (30): 12445–12450. Дои:10.1073 / pnas.0704870104. ЧВК 1941488. PMID 17640884.CS1 maint: несколько имен: список авторов (связь)
- ^ Вудворд Дж., Тейлор Г.К., Соарес Д.К., Бойл С., Си Д., Рид Д., Чатот К., Вукович М., Тарратс Н., Джеймисон Д., Кэмпбелл К.Дж., Блит К., Акоста Д.С., Илстра Б., Арендс М.Дж., Кранк К.Р., Джексон А.П. , Бикмор В.А., Вуд А.Дж. (2016). «Мутация Condensin II вызывает Т-клеточную лимфому из-за тканеспецифической нестабильности генома». Genes Dev. 30 (19): 2173–2186. Дои:10.1101 / gad.284562.116. ЧВК 5088566. PMID 27737961.CS1 maint: несколько имен: список авторов (связь)
внешняя ссылка
- конденсин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
