Стойкий карбен - Persistent carbene

А стойкий карбен (также известен как стабильный карбен) является разновидностью карбен демонстрируя особую стабильность. Самые известные примеры и самая большая подгруппа - это N-гетероциклические карбены (NHC)[1] (иногда называют Карбены Ардуенго), например диаминокарбены с общей формулой (R2N)2C:, где R обычно представляют собой алкильные и арильные группы. Группы могут быть связаны, чтобы дать гетероциклический карбены, такие как производные имидазол, имидазолин, тиазол или же триазол.
Традиционно карбены считаются настолько реактивными, что их изучали лишь косвенно, например путем улавливания реакций. Ситуация резко изменилась с появлением стойких карбенов. Хотя они являются достаточно реактивными веществами, т.е. димеризация многие из них могут быть выделены как чистые вещества.
Стойкие карбены могут присутствовать в синглет или триплетные состояния причем карбены в синглетном состоянии более стабильны. Относительная стабильность этих соединений лишь частично обусловлена стерическое препятствие громоздкими группами. Некоторые синглетные карбены термодинамически стабильный при отсутствии влаги и (в большинстве случаев) кислород, и могут быть изолированы и храниться неограниченное время. Другие димеризуются медленно в течение нескольких дней. Карбены триплетного состояния имеют период полураспада измеряется в секундах, поэтому его можно наблюдать, но нельзя сохранить.
История
Ранние доказательства
В 1957 г. Рональд Бреслоу предложил относительно стабильный нуклеофильный карбен, а тиазол-2-илиден производная, участвовала в каталитический цикл из витамин B1 (тиамин), который дает фуроин из фурфурол.[2][3] В этом цикле витамин тиазолий кольцо заменяет атом водорода (присоединенный к углероду 2 кольца) на остаток фурфурола. В дейтерированная вода, C2-протон было обнаружено, что быстро обменивается на дейтрон в статистическом равновесие.[4]
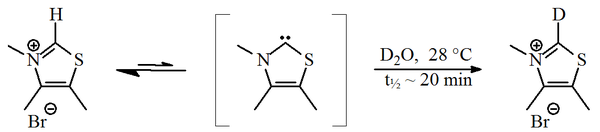
Было предложено, чтобы этот обмен происходил через тиазол-2-илиден. В 2012 г. изоляция так называемого Бреслоу промежуточный Сообщалось.[5][6]
В 1960 г. Ханс-Вернер Ванцлик и коллеги предположили, что карбены, полученные из дигидроимидазол-2-илиден были произведены вакуумный пиролиз соответствующего 2-трихлорметила дигидроимидазол соединения с потерей хлороформ.[7][8][9] Они предположили, что карбен существует в равновесии с его димер, а тетрааминоэтилен производная, так называемая Равновесие Ванзлика. Это предположение было опровергнуто Лемаль и соавторы в 1964 году, которые представили доказательства того, что димер не диссоциирует;[10] и Винбергом в 1965 году.[11] Однако последующие эксперименты Денка, Херрманна и других подтвердили это равновесие, хотя и при определенных обстоятельствах.[12][13]
Выделение стойких карбенов
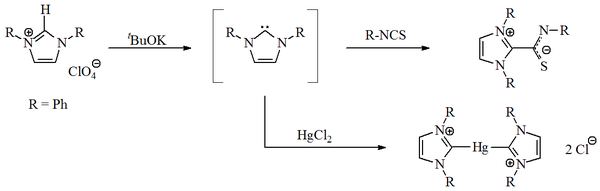
В 1970 году группа Ванзлика произвела имидазол-2-илиденкарбены путем депротонирования имидазолий соль.[14] Ванзлик, а также [Роальд Хоффманн],[9][15] предположил, что эти карбены на основе имидазола должны быть более стабильными, чем их 4,5-дигидроаналоги, из-за типа Хюккеля. ароматичность. Однако Ванзлик не выделил имидазол-2-илидены, а вместо этого выделил их координационные соединения с Меркурий и изотиоцианат:
В 1988 г. Гай Бертран и другие изолировали фосфинокарбен. Эти виды могут быть представлены как λ3-фосфинокарбен или λ5-фосфаацетилен:[16][17]

Эти соединения были названы «двухтактными карбенами» из-за разного сродства к электрону атомов фосфора и кремния. Они проявляют как карбеновые, так и алкиновый реактивность. Рентгеновская структура этой молекулы не была получена, и на момент публикации оставались некоторые сомнения относительно их точной карбенической природы.
В 1991 году Ардуенго и его коллеги получили стабильный, изолированный и кристаллический диаминокарбен, который может быть представлен в виде карбена или илида азота и углерода.[18] к депротонирование хлорида имидазолия с сильным основанием:

Этот карбен, предшественник большого семейства карбенов с имидазол-2-илиденовым ядром, оказался неограниченно стабильным при комнатной температуре (в отсутствие кислорода и влаги) и плавился при 240–241 ° C без разложения. Еще одним интересным химическим свойством этого илидового соединения был характерный резонанс в 13C ЯМР спектр при 211 м.д. для атома карбеновой кислоты.[19] В рентгеновский снимок структура[20] выявлено более длинное N – C длина облигаций в кольце карбена, чем в исходном соединении имидазолия, что указывает на то, что было очень мало двойная связь характер этих облигаций.
Первый стабильный на воздухе илидовый карбен, хлорированный член семейства имидазол-2-илидена, был получен в 1997 году.[21]
В 2000 году Бертран получил дополнительные карбены фосфанильного типа, включая (фосфанил) (трифторметил) карбен, стабильные в растворе при -30 ° C.[22] и умеренно стабильный (амино) (арил) карбен только с одним гетероатомом, примыкающим к карбеновому атому.[23][24]
Факторы, влияющие на стабильность карбенов, стабилизированных гетероатомом

(внешний зритель )
Стабильность карбенов Ардуенго изначально приписывалась объемным N-адамантил заместители, что предотвращает димеризацию карбена из-за стерическое препятствие. Замена N-адамантильных групп на метил группы также обеспечивают стабильные NHC.[25] Таким образом, имидазол-2-илидены являются термодинамически стабильный.
Также предполагалось, что двойная связь между атомами углерода 4 и 5 основной цепи имидазолиевого кольца, которая придает ароматический характер этой системе, важна для стабильности карбена. Это предположение было опровергнуто в 1995 году группой Ардуенго, которая получила производную от дигидроимидазол-2-илиден, лишенный двойной связи.[26] Термодинамическая стабильность в этом соединении и роль стерической защиты в предотвращении димеризации были предметом некоторых споров.[27][28]

О первом ациклическом стойком карбене было сообщено в 1996 г.[29] таким образом показывая, что циклический каркас не нужен для их стабильности. В отличие от циклических производных ациклические карбены гибки в отношении вращения связей с карбеновым атомом. Измеряя барьер для вращения этих облигаций, степень их двойная связь характер можно было измерить, и илидский природу этого карбена можно было определить. Как и циклические диаминокарбены, беспрепятственные варианты имеют тенденцию к димеризации.[28][30][31]
Наиболее стойкие карбены стабилизируются двумя фланкирующими азотными центрами. Аминотиокарбен и аминооксикарбен - выбросы.[32] и [33]. В этих стабильных соединениях атом карбена находится между атомом азота и либо сера или атом кислорода:
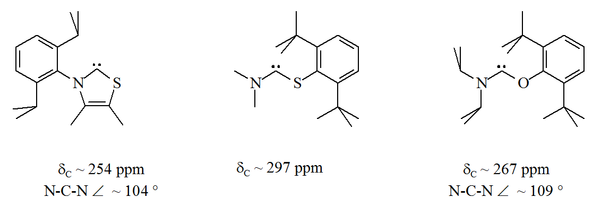
В отличие от NHC, эти карбены не являются термодинамически стабильными, но имеют тенденцию к димеризации.
В бис (диизопропиламино) циклопропенилиден, который стабилен при комнатной температуре, атом карбена соединен с двумя атомами углерода в трехчленное кольцо, которое сохраняет ароматичность и геометрию циклопропенилиден звенеть. Этот пример продемонстрировал, что присутствие гетероатомов рядом с карбеном также не обязательно для стабильности.[34]
Классы стабильных карбенов
Ниже приведены примеры выделенных на сегодняшний день стабильных карбенов:
Имидазол-2-илидены
Первые выделенные стабильные карбены были основаны на имидазол кольцо, причем водород в углероде 2 кольца (между двумя атомами азота) удален, а другие атомы водорода заменены различными группами. Эти имидазол-2-илидены по-прежнему являются наиболее стабильным и наиболее изученным семейством стойких карбенов.
Синтезирован значительный диапазон имидазол-2-илиденов, в том числе те, в которых 1,3-положения функционализированы с помощью алкил, арил,[25] алкилокси, алкиламино, алкилфосфино[35] и даже хиральный заместители:[35]
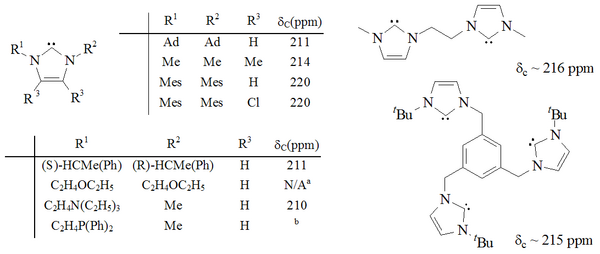

(внешний зритель )
В частности, замена двух хлор атомы двух атомов водорода в положениях 4 и 5 кольца дали первый устойчивый на воздухе карбен.[21] Его дополнительная стабильность, вероятно, является следствием электроноакцепторный эффект от хлор заместители, уменьшающие электронная плотность на атоме углерода, несущем одинокая пара, через индукция через сигма-магистраль.
Синтезированы также молекулы, содержащие две и даже три имидазол-2-илиденовые группы.[36][37]
Карбены на основе имидазола термодинамически стабильны и обычно имеют диагностические свойства. 13Значения химического сдвига ЯМР 13С для карбенового углерода составляют 210–230 м.д. Обычно рентгеновские структуры этих молекул показывают валентные углы N-C-N 101–102 °.
Триазол-5-илидены
Другое семейство стойких карбенов основано на 1,2,4-триазол кольцо с незаполненными орбиталями в углероде 5 этого кольца. В триазол-5-илидены изображенные ниже были впервые подготовлены Эндерсом и его сотрудниками[38] к вакуумный пиролиз из-за потери метанола из 2-метокситриазолов. Сообщалось только об ограниченном диапазоне этих молекул, при этом трифенилзамещенная молекула коммерчески доступна.
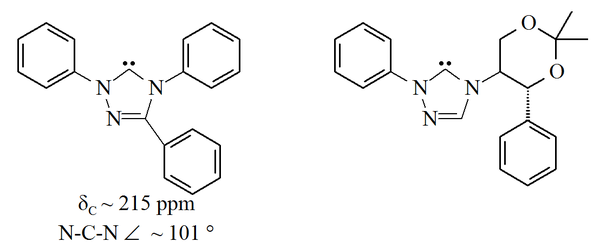
Триазол карбены на основе термодинамики и имеют диагностическую 13Значения химического сдвига ЯМР 13С между 210–220 м.д. для карбенового углерода. Рентгеновская структура трифенилзамещенного карбена, представленного выше, показывает валентный угол N-C-N примерно 101 °. Предшественник 5-метокситриазола для этого карбена был получен обработкой соли триазолия метоксидом натрия, который действует как нуклеофил.[38] Это может указывать на то, что эти карбены менее ароматичны, чем имидазол-2-илидены, поскольку предшественники имидазолия не реагируют с нуклеофилами из-за потери ароматичности.
Другие диаминокарбены
Два указанных выше семейства можно рассматривать как частные случаи более широкого класса соединений, в которых атом карбена соединяет два атома азота. Ряд таких диаминокарбенов был получен в основном Роджер Алдер исследовательская группа. В некоторых из этих соединений звено N-C-N является членом 5- или 6-членного неароматического кольца,[26][27][39] включая бициклический пример. В других примерах соседние атомы азота связаны только через атом карбена и могут быть или не быть частью отдельных колец.[29][30][31]

В отличие от ароматических имидазол-2-илиденов или триазол-5-илиденов, эти карбены, по-видимому, не являются термодинамически стабильными, как показано димеризацией некоторых беспрепятственных циклических и ациклических примеров.[27][30] Исследования[28] предполагают, что эти карбены димеризуются посредством димеризации, катализируемой кислотой (как в Равновесие Ванзлика ).
Диаминокарбены имеют диагностический 13Значения химического сдвига ЯМР 13С между 230–270 м.д. для углеродного атома. Рентгеновская структура дигидроимидазол-2-илидена показывает валентный угол N-C-N примерно 106 °, в то время как угол ациклического карбена составляет 121 °, и оба они больше, чем для имидазол-2-илиденов.
Гетероамино карбены
Существует несколько вариантов стабильных карбенов, указанных выше, где один из атомов азота, примыкающих к карбеновому центру ( α азота) был заменен альтернативным гетероатомом, таким как кислород, сера или фосфор.[16][17][32][33]
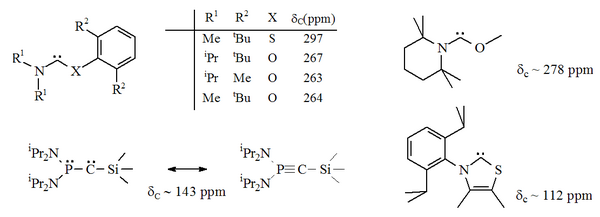
В частности, формальное замещение серой одного из атомов азота в имидазоле дает ароматическое гетероциклическое соединение тиазол. Карбен на основе тиазола (аналог карбена, постулированного Бреслоу)[40] был подготовлен и охарактеризован методом рентгеновской кристаллографии.[32] Были получены другие неароматические аминокарбены с атомами O, S и P, соседними (т.е. альфа) с карбеновым центром, например тио- и оксиминий на основе карбенов охарактеризованы методом рентгеновской кристаллографии.[33]
С кислород и сера двухвалентный, стерический защита карбенового центра ограничена, особенно когда блок N-C-X является частью кольца. Эти ациклические карбены имеют диагностическую 13Значения химического сдвига ЯМР 13С между 250–300 ppm для карбенового углерода, более слабое поле, чем любые другие типы стабильного карбена. Рентгеновские структуры показали валентные углы N-C-X примерно 104 ° и 109 ° соответственно.
Карбены, которые формально являются производными имидазол-2-илиденов путем замещения серы, кислорода или других веществ. халькогены за обе α-нитрогены, как ожидается, будут нестабильными, так как они могут диссоциировать на алкин (Р1C≡CR2) и углерод дихалькогенид (ИКС1= C = X2).[нужна цитата ]
Неаминные карбены
Реакция сероуглерод (CS2) с дефицитом электронов ацетилен производные предлагается давать переходные 1,3-дитиолий карбены (т.е. где X1 = X2 = S), которые затем димеризуются, давая производные от тетратиафульвен. Таким образом, возможно, что обратный процесс может происходить в подобных карбенах.[41][42]
Карбены Бертрана
В стойких карбенах Бертрана ненасыщенный углерод связан с фосфор и кремний.[43] Однако эти соединения, по-видимому, проявляют некоторые щелочные свойства, и после публикации точная карбеновая природа этих красных масел обсуждалась.[17]
Другие нуклеофильные карбены
Один стабильный N-гетероциклический карбен[44] имеет структуру, аналогичную боразин с одним бор атом заменен на метиленовая группа. В результате получается плоское 6-электронное соединение.
Циклопропенилидены
Другое семейство карбенов основано на циклопропенилиден ядро, трехуглеродное кольцо с двойной связью между двумя атомами, примыкающими к карбеновому. Примером этой семьи является бис (диизопропиламино) циклопропенилиден.[34]
Триплетные карбены
В 2001, Хидео Томиока и его сотрудники смогли произвести сравнительно стабильный триплетный карбен (бис (9-антрил) карбен, с периодом полураспада 19 минут), используя делокализация электронов.[45][46]

В 2006 г. та же группа сообщила о тройном карбене с период полураспада 40 минут.[47] Этот карбен производится фотохимический разложение из диазометан предшественник на 300 нанометр свет в бензоле с выбросом азот газ.
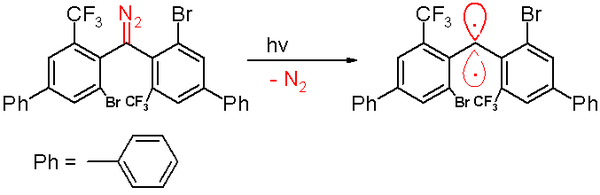
Воздействие кислорода (триплетный бирадикал) превращает этот карбен в соответствующий бензофенон. Соединение дифенилметана образуется, когда оно улавливается циклогекса-1,4-диен. Как и другие карбены, этот вид содержит большие объемные заместители, а именно бром и трифторметильные группы на фенильных кольцах, которые защищают карбен и предотвращают или замедляют процесс димеризации до 1,1,2,2-тетра (фенил) алкена. На основе компьютерное моделирование, то расстояние двухвалентного атома углерода к его соседям составляет 138 пикометры с угол связи 158,8 °. Плоскости фенильных групп почти перпендикулярны друг другу ( двугранный угол составляет 85,7 °).
Мезоионные карбены
Мезоионные карбены (MIC) аналогичны N-гетероциклическим карбенам (NHC), за исключением того, что канонические резонансные структуры с изображенным карбеном невозможно нарисовать без добавления дополнительных зарядов. Мезоионные карбены также называют аномальными N-гетероциклическими карбенами (aNHC) или удаленными N-гетероциклическими карбенами (rNHC). Можно выделить множество свободных карбенов, которые стабильны при комнатной температуре. Другие свободные карбены нестабильны и подвержены межмолекулярному разложению.
Химические свойства
Основность и нуклеофильность
Имидазол-2-илидены представляют собой сильные основания, имеющие pKa ок. 24 для конъюгированной кислоты в диметилсульфоксид (ДМСО):[48]

Однако дальнейшая работа показала, что диаминокарбены будут депротонировать растворитель ДМСО, в результате чего образующийся анион вступает в реакцию с образующейся солью амидиния.
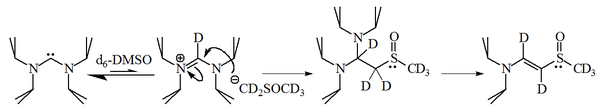
Реакция имидазол-2-илиденов с 1-бромгексан дает 90% 2-замещенного аддукта, и только 10% соответствующего алкен, что указывает на то, что эти молекулы также разумно нуклеофильный.
Значения pKa для конъюгированных кислот нескольких семейств NHC были исследованы в водном растворе. Значения pKa ионов триазолия лежат в диапазоне 16,5 - 17,8,[49] примерно на 3 единицы pKa более кислый, чем родственные ионы имидазолия.[50]
Димеризация
Когда-то считалось, что стабильные карбены обратимо димериз через так называемый Равновесие Ванзлика. Однако имидазол-2-илидены и триазол-5-илидены являются термодинамически стабильными и не димеризуются, и их хранили в решение при отсутствии воды и воздуха годами. Предположительно это связано с ароматный природа этих карбенов, которая теряется при димеризации. Фактически имидазол-2-илидены настолько термодинамически стабильны, что только в очень ограниченных условиях эти карбены могут димеризоваться.
Чен и Татон[51] сделал дважды связанный диимидазол-2-илиден с помощью депротонирующий соответствующая соль диимидазолия. Только депротонирование двусвязной соли диимидазолия с более коротким метиленовый мостик (-CH2-) привел к димеру дикарбена:

Если бы этот димер существовал как дикарбен, электрон одинокие пары карбеновый углерод будет вынужден находиться в непосредственной близости. Предположительно полученный отталкивающий электростатический взаимодействия будут иметь значительный дестабилизирующий эффект. Чтобы избежать этого электронного взаимодействия, карбен единицы димериз.
С другой стороны, гетероаминокарбены (например р2N-C: -ИЛИ или R2N-C: -SR) и неароматические карбены, такие как диаминокарбены (например р2N-C: -NR2) демонстрировали димеризацию,[52] хотя и довольно медленно. Предполагается, что это связано с высоким барьером для синглетное состояние димеризация:
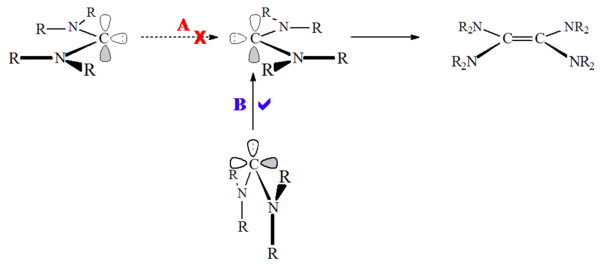
Диаминокарбены на самом деле не димеризуются, а скорее образуют димер путем реакции через формамидиний соли, протонированные вещества-предшественники.[28] Соответственно, эту реакцию можно катализировать кислотой. Эта реакция происходит потому, что в отличие от карбенов на основе имидазолия, при протонировании карбена не происходит потери ароматичности.
В отличие от димеризации триплетное состояние карбены, эти синглетное состояние карбены не подходят лицом к лицу ("наименьшее движение"), а скорее карбен одинокая пара атакует пустой углерод р-орбитальный («не наименьшее движение»). Димеризация карбена может катализироваться как кислотами, так и металлами.
Реактивность
Химия стабильных карбенов до конца не изучена. Однако Эндерс и другие.[38][53][54] выполнили ряд органических реакций с участием триазол-5-илидена. Эти реакции описаны ниже и могут рассматриваться как модель для других карбенов.

| а | 3,6-дифенил-1,2,4,5-тетразин, толуол | 92% | е | 2 экв., PhNCO, толуол, кипячение с обратным холодильником | 92% | |
|---|---|---|---|---|---|---|
| б | RXH, RT | 95–97% | ж | CS2, толуол или PhNCS, THF, RT | 71–90% | |
| c | О2, S8, или Se, толуол, кипячение с обратным холодильником | 54–68% | грамм | Малеимид, ТГФ, RT | 47–84% | |
| d | р1CH = CHR2, THF, RT | 25–68% | час | Диметилацетилендикарбоксилат, ТГФ, кипячение с обратным холодильником | 21% |
Эти карбены склонны вести себя в нуклеофильный мода (е и ж), выполняя реакции вставки (б), реакции присоединения (c), [2+1] циклоприсоединения (d, грамм и час), [4 + 1] циклоприсоединения (а) а также простой депротонации. Реакции вставки (б), вероятно, происходит через депротонирование, в результате чего образуется нуклеофил (−XR), который может атаковать образовавшуюся соль, создавая впечатление вставки H-X.
Сообщенный стабильный изотиазол карбен (2), полученный из перхлората изотиазолия (1)[55] был допрошен,[56] кто смог только изолировать 2-имино-2H-тиет (4). Промежуточный 3 был предложен через реакция перегруппировки. Этот карбен больше не считается стабильным.[57]

Комплексообразование карбенов
Было показано, что имидазол-2-илидены, триазол-5-илидены (и, в меньшей степени, диаминокарбены) координируются с множеством элементов, от щелочных металлов, элементы основной группы, переходные металлы и даже лантаноиды и актиниды. А периодическая таблица элементов дает некоторое представление о комплексах, которые были получены, и во многих случаях они были идентифицированы монокристаллом Рентгеновская кристаллография.[39][58][59] Считается, что стабильные карбены ведут себя аналогично органофосфины по свойствам их согласованности с металлами. Эти лиганды считаются хорошими σ-донорами благодаря карбеновому одинокая пара, но плохие π-акцепторы из-за внутренних лиганд возвратное пожертвование от азот атомы, прилегающие к карбеновому центру, и поэтому способны координироваться даже с металлами с относительно дефицитом электронов. Эндерс [60] и Герман[61][62] показали, что эти карбены являются подходящей заменой для фосфин лиганды в нескольких каталитические циклы. Хотя они обнаружили, что эти лиганды не активируют металлический катализатор в такой степени, как фосфиновые лиганды, они часто приводят к более надежным катализаторам. Несколько каталитических систем были изучены Германом и Эндерсом с использованием катализаторов, содержащих имидазольные и триазолкарбеновые лиганды, с умеренным успехом.[58][60][61][62] Grubbs [63] сообщил о замене фосфинового лиганда (PCy3) с имидазол-2-илиденом в метатезис олефинов катализатор RuCl2(PCy3)2CHPh и отметил повышенный метатезис с замыканием кольца, а также продемонстрировал «замечательную стабильность в воздухе и воде». Молекулы, содержащие два и три карбеновых фрагмента, были приготовлены в качестве потенциальных двузубый и трезубец карбеновые лиганды.[36][37]
Периодическая таблица (стойкий карбен) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ↓ Период | ||||||||||||||||||||
| 1 | 1 ЧАС | 2 Он | ||||||||||||||||||
| 2 | 3 Ли | 4 Быть | 5 B | 6 C | 7 N | 8 О | 9 F | 10 Ne | ||||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 п | 16 S | 17 Cl | 18 Ar | ||||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 В качестве | 34 Se | 35 Br | 36 Kr | ||
| 5 | 37 Руб. | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Пн | 43 Tc | 44 RU | 45 Rh | 46 Pd | 47 Ag | 48 CD | 49 В | 50 Sn | 51 Sb | 52 Te | 53 я | 54 Xe | ||
| 6 | 55 CS | 56 Ба | 72 Hf | 73 Та | 74 W | 75 Re | 76 Операционные системы | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Би | 84 По | 85 В | 86 Rn | |||
| 7 | 87 Пт | 88 Ра | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Nh | 114 Fl | 115 Mc | 116 Lv | 117 Ц | 118 Og | |||
| 57 Ла | 58 Ce | 59 Pr | 60 Nd | 61 Вечера | 62 См | 63 Европа | 64 Б-г | 65 Tb | 66 Dy | 67 Хо | 68 Э | 69 Тм | 70 Yb | 71 Лу | ||||||
| 89 Ac | 90 Чт | 91 Па | 92 U | 93 Np | 94 Пу | 95 Являюсь | 96 См | 97 Bk | 98 Cf | 99 Es | 100 FM | 101 Мкр | 102 Нет | 103 Lr | ||||||
- Легенда
- Карбеновый комплекс с известным элементом
- Карбеновый комплекс с элементом не известен
Карбены в металлоорганической химии и катализе
Карбены можно стабилизировать как металлоорганический разновидность. Эти карбеновые комплексы переходных металлов делятся на две категории:
- Фишер карбены, в которых карбены связаны с металлом и электроноакцепторная группа (обычно карбонил),
- Schrock карбены; в котором карбены связаны с металлом, а электронодонорная группа. Реакции, в которых участвуют такие карбены, сильно отличаются от реакций, в которых участвуют органические карбены.
Химия карбенов в триплетном состоянии
Карбены со стойким триплетным состоянием, вероятно, будут иметь очень такую же реакционную способность, как и другие нестойкие триплетные состояния. карбены.
Физические свойства

Те карбены, которые были выделены на сегодняшний день, обычно представляют собой бесцветные твердые вещества с низкими температурами плавления. Эти карбены имеют тенденцию к сублимации при низких температурах в высоком вакууме.
Одним из наиболее полезных физических свойств является диагностический химический сдвиг карбенового атома углерода в 13C-ЯМР спектр. Обычно этот пик находится в диапазоне от 200 до 300 частей на миллион, где несколько других пиков появляются в 13C-ЯМР спектр. Слева показан пример циклического диаминокарбена, пик карбеновой кислоты которого составляет 238 частей на миллион.
По согласованию с металлоцентрами 13Резонанс карбена С обычно смещается в сильное поле в зависимости от кислотности Льюиса сложного фрагмента. Основываясь на этом наблюдении, Huynh и другие. разработали новую методологию определения силы доноров лигандов с помощью 13C ЯМР анализ транс-карбеновые комплексы палладия (II). Использование 13C-меченный N-гетероциклический карбеновый лиганд также позволяет изучать смешанные карбен-фосфиновые комплексы, которые подвергаются транс-СНГ-изомеризация за счет транс эффект.[64]
Приложения
NHC широко используются в качестве вспомогательный лиганд в металлоорганический химия. Одним из практических приложений является рутений -основан Катализатор Граббса и Комплексы NHC-палладий для реакций кросс-сочетания.[65][66][67] Комплексы NHC-металл, в частности комплексы Ag (I) -NHC, были широко протестированы для их биологических применений.[68]
Методы подготовки
NHC часто сильно базовый (в pKa ценность конъюгированная кислота имидазол-2-илидена измеряли при прибл. 24)[48] и реагировать с кислород. Очевидно, что эти реакции выполняются с использованием безвоздушные методы, избегая соединений даже умеренных кислотность. Хотя соли имидазолия устойчивы к нуклеофильный кроме того, другие неароматические соли не являются (т.е. формамидиний соли).[69]
В этих случаях можно избежать сильных беспрепятственных нуклеофилов, независимо от того, генерируются ли они в место или присутствуют в виде примеси в других реагентах (например, LiOH в BuLi).
Для получения стабильных карбенов было разработано несколько подходов, которые описаны ниже.
Депротонирование
Депротонирование солей-предшественников карбенов с сильными основаниями оказался надежным путем почти ко всем стабильным карбенам:
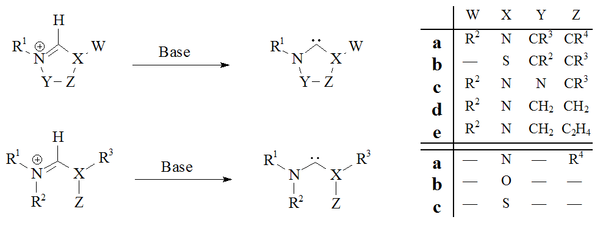
Имидазол-2-илидены и дигидроимидазол-2-илидены, например IMes, были приготовлены депротонированием соответствующих имидазолий и дигидроимидазолий соли. Ациклические карбены[29][30] и тетрагидропиримидинил[39] карбены на основе были получены депротонированием с использованием сильных гомогенных оснований.
С переменным успехом использовали несколько оснований и условий реакции. Степень успеха в основном зависела от характера предшественник депротонируется.Основным недостатком этого способа получения является проблема отделения свободного карбена от ионов металлов, используемых при их получении.
Металлогидридные основания
Можно подумать, что натрий или гидрид калия[26][32] будет идеальной основой для депротонирования этих солей-предшественников. Гидрид должен необратимо реагировать с потерей водород чтобы получить желаемый карбен, с неорганический побочные продукты и избыток гидрида удаляются фильтрацией. На практике эта реакция часто протекает слишком медленно и требует добавления ДМСО или же т-BuOH.[18][25] Эти реагенты образуют растворимые катализаторы, которые увеличивают скорость реакции этой гетерогенной системы за счет образования трет-бутоксида или димсил анион. Однако эти катализаторы оказались неэффективными для получения неимидазолиевых аддуктов, поскольку они имеют тенденцию действовать как нуклеофилы по отношению к солям-предшественникам и при этом разрушаются. Наличие гидроксид ионы в качестве примеси в гидриде металла могут также разрушать неароматические соли.
Депротонирование с помощью натрий или же калий гидрид в смеси жидкости аммиак / THF при –40 ° C не сообщалось[35] для карбенов на основе имидазола. Ардуенго и сотрудники[32] удалось получить дигидроимидазол-2-илиден с использованием NaH. Однако этот метод не применялся для получения диаминокарбенов. В некоторых случаях, трет-бутоксид калия может использоваться без добавления гидрида металла.[25]
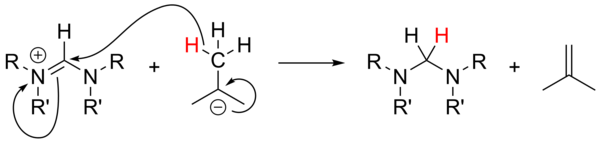
Алкиллитий
Использование алкиллитий как сильные основания[18] не был широко изучен и был ненадежным для депротонирования солей-предшественников. В случае неароматических солей n-BuLi и PhLi могут действовать как нуклеофилы, в то время как t-BuLi может иногда действовать как источник гидрида, восстанавливая соль с образованием изобутен:
Амидные основания
Амиды лития, такие как диизопропиламид (LDA) и (тетраметилпиперидид (LiTMP) )[29][30] обычно хорошо работают для депротонирования всех типов солей, при условии, что не слишком много LiOH присутствует в п-бутиллитий используется для изготовления амида лития. Титрование амида лития можно использовать для определения количества гидроксида в растворе. Депротонирование солей-предшественников металлом гексаметилдисилазиды[39] очень чисто работает при депротонировании всех типов солей, за исключением беспрепятственных солей формамидиния, где это основание может действовать как нуклеофил, давая аддукт триаминометана.
Безметалловый препарат карбена

Стремление к получению стабильных карбенов, свободных от катионов металлов, позволило провести дальнейшее изучение карбеновых разновидностей отдельно от этих металлов. Отделение карбена от комплекса карбен-металл может быть проблематичным из-за стабильности комплекса. Соответственно, предпочтительно, чтобы карбен в первую очередь не содержал этих металлов. В самом деле, некоторые ионы металлов, а не стабилизация карбена, участвовали в каталитической димеризации беспрепятственных примеров.
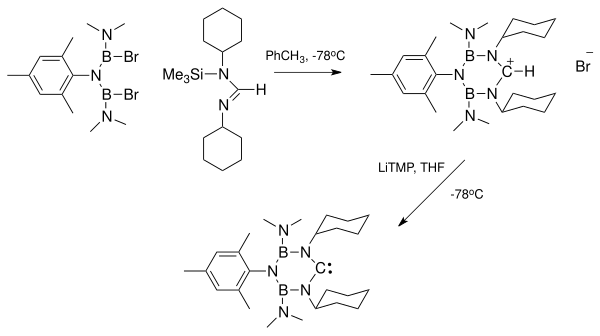
Справа показана рентгеновская структура, показывающая комплекс между диаминокарбеном и калием. HMDS. Этот комплекс образовался при избытке ХМДС использовался как прочная база для депротонирования формамидиний соль. Удаление ионов лития в результате депротонирования с помощью таких реагентов, как диизопропиламид лития (LDA), может быть особенно проблематичным. Побочные продукты соли калия и натрия имеют тенденцию осаждаться из раствора и могут быть удалены. Ионы лития могут быть химически удалены путем связывания с такими веществами, как криптанды или же краун-эфиры.
Карбены, не содержащие металлов, получали несколькими способами, как описано ниже:
Дехалькогенизация
Другой подход к приготовлению карбенов основан на десульфуризация из тиомочевины с калий в THF.[27][70] Фактором, способствующим успеху этой реакции, является то, что побочный продукт, сульфид калия, не растворяется в растворителе. Повышенные температуры свидетельствуют о том, что этот метод не подходит для получения нестабильных димеризующихся карбенов. Единственный пример деоксигенация из мочевина с флуорен производное карбена с образованием тетраметилдиаминокарбена и флуоренона также сообщалось:[71]
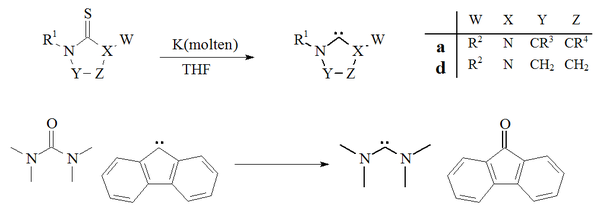
В десульфуризация тиомочевины с расплавом калий для получения имидазол-2-илиденов или диаминокарбенов широко не применялись. Метод был использован для получения карбенов дигидроимидазола.[27]
Вакуумный пиролиз
Вакуумный пиролиз с удалением нейтральных летучих побочных продуктов (CH3ОН, CHCl3), был использован для получения карбенов на основе дигидроимидазола и триазола:
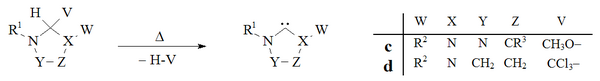
Исторически удаление хлороформа путем вакуумный пиролиз из d аддукты были использованы Ванзликом[8] в его ранних попытках получить дигидроимидазол-2-илидены, но этот метод не получил широкого распространения. Лаборатория Эндерса[38] использовал вакуумный пиролиз c аддукт с образованием триазолий-5-илидена c.
Бис (триметилсилил) ртуть
Бис (триметилсилил) ртуть (CH3)3Si-Hg-Si (CH3)3 реагирует с хлор-иминий и хлор-амидиний соли с образованием безметаллового карбена и элементарного Меркурий.[72] Например, (CH3)3Si-Hg-Si (CH3)3 + R2N = C (Cl) -NR2+ Cl− → R2N-C: -NR2 + Hg(l) + (CH3)3Si-Cl
Фотохимическое разложение
Стойкие карбены в триплетном состоянии были получены фотохимический разложение диазометанового продукта путем вытеснения азот газ на длине волны 300 нм в бензоле.
Очищение
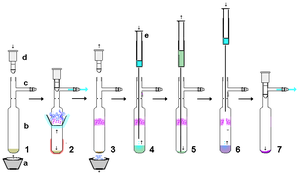
Стабильные карбены очень реактивны, поэтому при использовании безвоздушные методы. Однако при условии использования строго сухих, относительно некислотных и безвоздушных материалов стабильные карбены достаточно устойчивы к обращению. как таковой. В качестве примера, стабильный карбен, полученный из гидрида калия, может быть профильтрован через сухую подушку из целита для удаления избытка KH (и образующихся солей) из реакции. В относительно небольших масштабах суспензии, содержащей стабильный карбен в растворе, можно дать возможность осесть, а надосадочный раствор протолкнуть через высушенную мембрану. шприцевой фильтр. Стабильные карбены легко растворяются в неполярных растворителях, таких как гексан, и поэтому обычно перекристаллизация получение стабильных карбенов может быть затруднено из-за отсутствия подходящих некислотных полярных растворителей. Без воздуха сублимация как показано справа, может быть эффективным методом очистки, хотя температуры ниже 60 ° C в высоком вакууме предпочтительны, поскольку эти карбены относительно летучие и также могут начать разлагаться при этих более высоких температурах. Действительно, сублимация в некоторых случаях может давать монокристаллы, пригодные для рентгеноструктурного анализа. Однако сильное комплексообразование с ионами металлов, такими как литий в большинстве случаев предотвратит сублимацию.
Рекомендации
- ^ Hopkinson, M.N .; Richter, C .; Schedler, M .; Глориус, Ф. (2014). «Обзор N-гетероциклических карбенов». Природа. 510 (7506): 485–496. Bibcode:2014Натура.510..485H. Дои:10.1038 / природа13384. PMID 24965649. S2CID 672379.
- ^ Рональд Бреслоу (1957). «Механизм действия тиамина: участие цвиттериона тиазолия». Химия и промышленность. 26: 893.
- ^ Рональд Бреслоу (1958). «О механизме действия тиамина. IV.1 Данные исследований модельных систем». Журнал Американского химического общества. 80 (14): 3719–3726. Дои:10.1021 / ja01547a064.
- ^ Р. Бреслоу (1957). «Быстрый обмен дейтерия в солях тиазолия». Журнал Американского химического общества. 79 (7): 1762–1763. Дои:10.1021 / ja01564a064.
- ^ Berkessel A .; Elfert S .; Ятам В. Р .; Neudörfl J.-M .; Schlörer N.E .; Телес Дж. Х. (2012). "Умполунг N-гетероциклическими карбенами: образование и реакционная способность неуловимых 2,2-диаминоенолов (промежуточные соединения Бреслоу)". Энгью. Chem. Int. Эд. 51 (49): 12370–12374. Дои:10.1002 / anie.201205878. PMID 23081675.
- ^ Химики приближаются к неуловимому промежуточному звену в Бреслоу Кармен Драл
- ^ Ханс-Вернер Ванцлик и Э. Шикора (1960). "Ein neuer Zugang zur Carben-Chemie". Angewandte Chemie. 72 (14): 494. Дои:10.1002 / ange.19600721409.
- ^ а б Х. В. Ванзлик и Э. Шикора (1960). «Эйн нуклеофилы карбен». Chemische Berichte. 94 (9): 2389–2393. Дои:10.1002 / cber.19610940905.
- ^ а б Х. В. Ванзлик (1962). «Аспекты химии нуклеофильных карбенов». Энгью. Chem. Int. Эд. Англ. 1 (2): 75–80. Дои:10.1002 / anie.196200751.
- ^ Д. М. Лемаль; Р. А. Ловальд и К. И. Кавано (1964). «Тетрааминоэтилены. Вопрос о диссоциации». Варенье. Chem. Soc. 86 (12): 2518–2519. Дои:10.1021 / ja01066a044.
- ^ Х. Э. Винберг; Дж. Э. Карнахан; Д. Д. Коффман и М. Браун (1965). «Тетрааминоэтилены». Варенье. Chem. Soc. 87 (9): 2055–2056. Дои:10.1021 / ja01087a040.
- ^ Денк М. К .; Hatano K .; Ма М. (1999). "Нуклеофильные карбены и повторное исследование равновесия Ванзлика". Буквы Тетраэдра. 40 (11): 2057–2060. Дои:10.1016 / S0040-4039 (99) 00164-1.
- ^ Бём Фолькер П. В .; Германн Вольфганг А. (2000). «Равновесие Ванзлика». Angewandte Chemie. 39 (22): 4036–4038. Дои:10.1002 / 1521-3773 (20001117) 39:22 <4036 :: AID-ANIE4036> 3.0.CO; 2-L.
- ^ Х. В. Ванзлик и Х. Дж. Шонхерр (1970). "Chemie nucleophiler Carbene, XVIII1) 1.3.4.5-Тетрафенилимидазолийперхлорат". Liebigs Ann. Chem. 731: 176–179. Дои:10.1002 / jlac.19707310121.
- ^ Р. Глейтер и Р. Хоффманн (1968). «Стабилизация синглетного метилена». Варенье. Chem. Soc. 90 (20): 5457–5460. Дои:10.1021 / ja01022a023.
- ^ а б А. Игау; Х. Груцмахер; А. Басейредо; Дж. Бертран (1988). «Аналогичный α, α'-бис-карбеноид, трехсвязанный вид: синтез стабильного λ3-фосфино карбен-λ3-фосфацетилен ». Варенье. Chem. Soc. 110 (19): 6463–6466. Дои:10.1021 / ja00227a028.
- ^ а б c Г. Бертран; Р. Рид (1994). "λ3-Фосфинокарбены λ5-фосфацетилены ». Обзоры координационной химии. 137: 323–355. Дои:10.1016 / 0010-8545 (94) 03005-Б.
- ^ а б c А. Дж. Ардуенго, Р. Л. Харлоу и М. Клайн (1991). «Стабильный кристаллический карбен». Варенье. Chem. Soc. 113 (1): 361–363. Дои:10.1021 / ja00001a054.
- ^ Тапу, Даниэла; Диксон, Дэвид А .; Роу, Кристофер (12 августа 2009 г.). «Спектроскопия ЯМР 13С карбенов типа« Ардуенго и их производных ». Химические обзоры. 109 (8): 3385–3407. Дои:10.1021 / cr800521g. PMID 19281270.
- ^ Ардуенго, Энтони Дж .; Харлоу, Ричард Л .; Клайн, Майкл (январь 1991). «Стабильный кристаллический карбен». Журнал Американского химического общества. 113 (1): 361–363. Дои:10.1021 / ja00001a054.
- ^ а б А. Дж. Ардуенго; Ф. Дэвидсон; Х. В. Р. Диас; Дж. Р. Гёрлих; Д. Хаснис; У. Дж. Маршалл; Т. К. Пракаша (1997). Димеры "стабильный на воздухе карбен и смешанный карбен""". Варенье. Chem. Soc. 119 (52): 12742–12749. Дои:10.1021 / ja973241o.
- ^ Кристоф Бурон; Хайнц Горницка; Вадим Романенко; Гай Бертран (2000). «Стабильные версии переходных двухтактных карбенов: увеличение срока службы с наносекунд до недель». Наука. 288 (5467): 834–836. Bibcode:2000Sci ... 288..834B. Дои:10.1126 / science.288.5467.834. PMID 10796999.
- ^ Соле, Стефан; Горницка, Хайнц; Schoeller, Wolfgang W .; Бурису, Дидье; Бертран, Гай (2001). «(Амино) (арил) карбены: стабильные синглетные карбены с заместителем для наблюдения». Наука. 292 (5523): 1901–1903. Bibcode:2001Научный ... 292.1901С. Дои:10.1126 / science.292.5523.1901. PMID 11397943.
- ^ Лай Чунь-Лян; Го Вэнь-Синь; Ли Мин-Цунг; Ху Чин-Хан (2005). «Лигандные свойства N-гетероциклических карбенов и карбенов Бертрана: исследование функциональной плотности». Журнал металлоорганической химии. 690 (24–25): 5867–5875. Дои:10.1016 / j.jorganchem.2005.07.058.
- ^ а б c d А. Дж. Ардуенго; Х. В. Р. Диас; Р. Л. Харлоу и М. Клайн (1992). «Электронная стабилизация нуклеофильных карбенов». Варенье. Chem. Soc. 114 (14): 5530–5534. Дои:10.1021 / ja00040a007.
- ^ а б c Дж. Ардуенго; Дж. Р. Гёрлих и В. Дж. Маршалл (1995). «Стабильный диаминокарбен». Варенье. Chem. Soc. 117 (44): 11027–11028. Дои:10.1021 / ja00149a034.
- ^ а б c d е М. К. Денк; А. Тадани; К. Хатано и А. Дж. Лох (1997). «Стерическая стабилизация нуклеофильных карбенов». Энгью. Chem. Int. Эд. Англ. 36 (23): 2607–2609. Дои:10.1002 / anie.199726071.
- ^ а б c d Ольха, RW; Чакер, L; Паолини, ФП (2004). «Бис (диэтиламино) карбен и механизм димеризации простых диаминокарбенов». Chemical Communications (Кембридж, Англия) (19): 2172–3. Дои:10.1039 / b409112d. PMID 15467857.
- ^ а б c d Р. В. Алдер; П. Р. Аллен; М. Мюррей и А. Г. Орпен (1996). «Бис (диизопропиламино) карбен». Энгью. Chem. Int. Эд. Англ. 35 (10): 1121–1123. Дои:10.1002 / anie.199611211.
- ^ а б c d е Р. В. Олдер и М. Э. Блейк (1997). «Бис (N-пиперидил) карбен и его медленная димеризация до тетракис (N-пиперидил) этена». Chem. Commun. (16): 1513–1514. Дои:10.1039 / a703610h.
- ^ а б Р. У. Алдер; М. Э. Блейк и Дж. М. Олива (1999). «Диаминокарбены; Расчет барьеров для вращения относительно Ccарбене-N-связи, барьеры для димеризации, протонное сродство и 13Сдвиги ЯМР 13С ». J. Phys. Chem. А. 103 (50): 11200–11211. Bibcode:1999JPCA..10311200A. Дои:10.1021 / jp9934228.
- ^ а б c d е А. Дж. Ардуенго, Дж. Р. Гёрлих и В. Дж. Маршалл (1997). «Стабильный тиазол-2-илиден и его димер». Либигс Аннален. 1997 (2): 365–374. Дои:10.1002 / jlac.199719970213.
- ^ а б c Р. В. Алдер; К. П. Баттс и А. Г. Орпен (1998). «Стабильные аминоокси- и аминотиокарбены». Варенье. Chem. Soc. 120 (44): 11526–11527. Дои:10.1021 / ja9819312.
- ^ а б Лавалло, Винсент; Канак, Ив; Доннадье, Бруно; Schoeller, Wolfgang W .; Бертран, Гай (2006). «Циклопропенилидены: от межзвездного пространства к изолированному производному в лаборатории». Наука. 312 (5774): 722–724. Bibcode:2006Научный ... 312..722Л. Дои:10.1126 / science.1126675. ЧВК 2427275. PMID 16614171.
- ^ а б c В. А. Херрманн; К. Кочер; Л. Дж. Гуссен и Г. Р. Дж. Артус (1996). «Гетероциклические карбены: высокоэффективный синтез новых функционализированных N-гетероциклических карбенов в жидком аммиаке». Chem. Евро. Дж. 2 (12): 1627–1636. Дои:10.1002 / chem.19960021222.
- ^ а б В. А. Херрманн; М. Элисон; Дж. Фишер; К. Кочер и Г. Р. Дж. Артус (1996). «N-Гетероциклические карбены: образование в мягких условиях и образование комплексов переходных металлов 8–10 групп, имеющих отношение к катализу». Chem. Евро. J. 2 (7): 772–780. Дои:10.1002 / chem.19960020708.
- ^ а б Х. В. Р. Диас и В. К. Джин (1994). «Стабильный тридентатный карбеновый лиганд». Tetrahedron Lett. 35 (9): 1365–1366. Дои:10.1016 / S0040-4039 (00) 76219-8.
- ^ а б c d Д. Эндерс; К. Брейер; Г. Раабе; Дж. Рансинк; Дж. Х. Телес; Дж. П. Мелдер; К. Эбель и С. Броде (1995). «Получение, структура и реакционная способность 1,3,4-трифенил-4,5-дигидро-1H-1,2,4-триазол-5-илидена, нового стабильного карбена». Энгью. Chem. Int. Эд. Англ. 34 (9): 1021–1023. Дои:10.1002 / anie.199510211.
- ^ а б c d Р. В. Алдер; М. Э. Блейк; К. Бортолотти; С. Буффали; С. П. Баттс; Э. Лайнхэм; Дж. М. Олива; А. Г. Орпен и М. Дж. Куэйл (1999). «Комплексообразование стабильных карбенов со щелочными металлами». Chem. Commun. (3): 241–242. Дои:10.1039 / a808951e.
- ^ Р. Бреслоу (1957). «Быстрый обмен дейтерия в солях тиазолия». Варенье. Chem. Soc. 79 (7): 1762–1763. Дои:10.1021 / ja01564a064.
- ^ Х. Д. Хазцлер (1970). «Нуклеофильные 1,3-дитиолиевые карбены». Варенье. Chem. Soc. 92 (5): 1412–1413. Дои:10.1021 / ja00708a058.
- ^ Х. Д. Хартцлер (1972). «1,3-Дитиолиевые карбены из ацетиленов и сероуглерода». Варенье. Chem. Soc. 95 (13): 4379–4387. Дои:10.1021 / ja00794a039.
- ^ Г. Бертран; А. Игау; А. Басейредо и Г. Тринкье (1989). «[Бис (диизопропиламино) фосфино] триметилсилилкарбен: стабильный нуклеофильный карбен». Энгью. Chem. Int. Эд. Англ. 28 (5): 621–622. Дои:10.1002 / anie.198906211.
- ^ Präsang, C; Доннадье, Б; Бертран, Г. (2005). «Стабильные плоские шести-π-электронные шестичленные N-гетероциклические карбены с настраиваемыми электронными свойствами». Варенье. Chem. Soc. 127 (29): 10182–10183. Дои:10.1021 / ja052987g. ЧВК 2440681. PMID 16028925.
- ^ Томиока, Н; Ивамото, Э; Itakura, H; Хираи, К. (2001). «Создание и характеристика довольно стабильного триплетного карбена». Природа. 412 (6847): 626–8. Bibcode:2001Натура 412..626Т. Дои:10.1038/35088038. PMID 11493917. S2CID 4373216.
- ^ Майкл Фримантл (13 августа 2001). «Триплет карбен имеет долгую жизнь». Новости химии и машиностроения. 79 (33): 11. Дои:10.1021 / cen-v079n033.p011a.
- ^ Ито, Т; Наката, Y; Хираи, К. Томиока, Х (2006). «Триплет дифенилкарбенов, защищенный трифторметильной и бромной группами. Триплетный карбен, выживший в течение дня в растворе при комнатной температуре». Варенье. Chem. Soc. 128 (3): 957–967. Дои:10.1021 / ja056575j. PMID 16417387.
- ^ а б Р. В. Алдер; П. Р. Аллен и С. Дж. Уильямс (1995). «Стабильные карбены как сильные основания». J. Chem. Soc., Chem. Commun. (12): 1267. Дои:10.1039 / c39950001267.
- ^ Мэсси Ричард С (2012). «Реакции переноса протона триазол-3-илиденов: кинетические кислотности и значения pKaValue для двадцати триазолиевых солей в водном растворе» (PDF). Журнал Американского химического общества. 134 (50): 20421–20432. Дои:10.1021 / ja308420c. PMID 23173841.
- ^ Хиггинс, Элеонора М .; Шервуд, Дженнифер А .; Линдси, Анита Дж .; Армстронг, Джеймс; Мэсси, Ричард С .; Олдер, Роджер В .; О'Донохью, Аннмари К. (2011). "П Каш сопряженных кислот N-гетероциклических карбенов в воде ». Chem. Сообщество. 47 (5): 1559–1561. Дои:10.1039 / C0CC03367G. PMID 21116519. S2CID 205757477.
- ^ Т. А. Татон и П. Чен (1996). «Стабильный тетраазафульвален». Энгью. Chem. Int. Эд. Англ. 35 (9): 1011–1013. Дои:10.1002 / anie.199610111.
- ^ Олдер, Роджер В .; Блейк, Майкл Э .; Чакер, Лейла; Харви, Джереми Н .; Паолини, Франсуа; Шютц, Ян (2004). «Когда и как диаминокарбены димеризуются?». Angewandte Chemie International Edition. 43 (44): 5896–911. Дои:10.1002 / anie.200400654. PMID 15457494.
- ^ D. Enders, K. Breuer, J. Runsink и J. H. Teles (1996), Liebigs Ann. Chem., Стр.2019
- ^ а б Д. Эндерс, К. Брейер, Дж. Х. Телес и К. Эбель (1997), Журнал Fur Praktische Chemie-Chemiker-Zeitung том 339, стр. 397
- ^ Вольф, Дж; Böhlmann, W; Findeisen, M; Гельбрих, Т; Hofmann, HJ; Шульце, Б. (2007). «Синтез стабильных изотиазольных карбенов». Angewandte Chemie International Edition на английском языке. 46 (17): 3118–21. Дои:10.1002 / anie.200604305. PMID 17372997.
- ^ Дехоп, А; Lavallo, V; Доннадье, Б; Schoeller, WW; Бертран, Г. (2007). «Недавно сообщенные кристаллические карбены изотиазола: миф или реальность». Angewandte Chemie International Edition на английском языке. 46 (36): 6922–5, обсуждение 6926. Дои:10.1002 / anie.200702272. PMID 17661300.
- ^ Вольф Жанин; Бельманн Винфрид; Findeisen Matthias; Гельбрих Томас; Хофманн Ханс-Йорг; Шульце Борбель (2007). "Ответ на "Недавно опубликованные сведения о кристаллических карбенах изотиазола: миф или реальность"". Энгью. Chem. Int. Эд. 46 (36): 6926. Дои:10.1002 / anie.200702746.
- ^ а б Вольфганг А. Херрманн; Кристиан Кехер (1997). «N-Гетероциклические карбены». Энгью. Chem. Int. Эд. Англ. 36 (20): 2162–2187. Дои:10.1002 / anie.199721621.
- ^ Гернот Бош; Кристоф Хильф; Клаус Хармс; Майкл Марш; Джон К. В. Лоренц (1995). «Кристаллическая структура димерного (4-трет-бутилтиазолато) (глима) лития: карбеновые свойства формильного анионного эквивалента». Энгью. Chem. Int. Эд. Англ. 34 (4): 487–489. Дои:10.1002 / anie.199504871.
- ^ а б Д. Эндерс; Х. Гилен; Г. Раабе; Дж. Рансинк и Дж. Х. Телес (1996). «Синтез и стереохимия первых хиральных (имидазолинилиден) - и (триазолинилиден) комплексов палладия (II)». Chem. Бер. 129 (12): 1483–1488. Дои:10.1002 / cber.19961291213.
- ^ а б Вольфганг А. Херрманн; Мартина Элисон; Якоб Фишер; Кристиан Кехер; Георг Р. Дж. Артус (1995). «Металлические комплексы N-гетероциклических карбенов - новый структурный принцип для катализаторов в гомогенном катализе». Энгью. Chem. Int. Эд. Англ. 34 (21): 2371–2374. Дои:10.1002 / anie.199523711.
- ^ а б Вольфганг А. Херрманн; Лукас Дж. Гуссен; Кристиан Кехер; Георг Р. Дж. Артус (1996). «Хиральные гетероциклические карбены в асимметричном гомогенном катализе». Энгью. Chem. Int. Эд. Англ. 35 (23–24): 2805–2807. Дои:10.1002 / anie.199628051.
- ^ М. Шолль; Т. М. Трнка; Дж. П. Морган и Р. Х. Граббс (1999). «Повышенная активность метатезиса с замыканием цикла катализаторов метатезиса олефинов на основе рутения, координированных имидазолин-2-илиденовыми лигандами». Tetrahedron Lett. 40 (12): 2247–2250. Дои:10.1016 / S0040-4039 (99) 00217-8.
- ^ Хан Винь Хынь; и другие. (2009). «13С ЯМР-спектроскопическое определение силы донора лиганда с использованием N-гетероциклических карбеновых комплексов палладия (II)». Металлоорганические соединения. 28 (18): 5395–5404. Дои:10.1021 / om900667d.
- ^ С. П. Нолан [редактор] (2006). N-Гетероциклические карбены в синтезе, Wiley-VCH ISBN 3-527-31400-8
- ^ Ф. Глориус [редактор] (2007) N-Гетероциклические карбены в катализе переходными металлами, Springer ISBN 3-540-36929-5
- ^ Дис-Гонсалес, Сильвия; Марион, Николас; Нолан, Стивен П. (12 августа 2009 г.). «N-Гетероциклические карбены в катализе поздних переходных металлов». Химические обзоры. 109 (8): 3612–3676. Дои:10.1021 / cr900074m. ISSN 0009-2665. PMID 19588961. S2CID 206902952.
- ^ Garrison Jered C .; Янгс Уайли Дж. (2005). «Комплексы Ag (I) N-Гетероциклический карбен: синтез, структура и применение». Chem. Rev. 105 (11): 3978–4008. Дои:10.1021 / cr050004s. PMID 16277368. S2CID 43090499.
- ^ Роджер У. Олдер; Майкл Э. Блейк; Симоне Буфали; Крейг П. Баттс; А. Гай Орпен; Ян Шютц; Стюарт Дж. Уильямс (2001). «Получение солей тетраалкилформамидиния и родственных видов в качестве предшественников стабильных карбенов». Журнал химического общества, Perkin Transactions 1 (14): 1586–1593. Дои:10.1039 / b104110j.
- ^ Н. Кун и Т. Кратц (1993). «Синтез имидазол-2-илиденов восстановлением имидазола-2 (3ЧАС) -тионы ». Синтез. 1993 (6): 561–562. Дои:10.1055 / с-1993-25902.
- ^ Д. Ковач; М. С. Ли; Д. Олсон и Дж. Э. Джексон (1996). "Перенос атома кислорода из карбена в карбен". Варенье. Chem. Soc. 118 (34): 8144–8145. Дои:10.1021 / ja961324j.
- ^ Майкл Отто; Сальвадор Конехеро; Ив Канак; Вадим Дмитриевич Романенко; Валентин Рудзевич и Гай Бертран (2004). «Моно- и диаминокарбены из солей хлориминия и -амидиния: синтез безметаллового бис (диметиламино) карбена». Варенье. Chem. Soc. 126 (4): 1016–1017. Дои:10.1021 / ja0393325. PMID 14746458.
дальнейшее чтение
Отзывы о стойких карбенах:
- Hopkinson, M.N .; Richter, C .; Schedler, M .; Глориус, Ф. (2014). «Обзор N-гетероциклических карбенов». Природа. 510 (7506): 485–496. Bibcode:2014Натура.510..485H. Дои:10.1038 / природа13384. PMID 24965649. S2CID 672379.
- Химия карбенов: от мимолетных промежуточных продуктов к мощным реагентам (Глава 4, Хидео Томиока (триплетное состояние); Глава 5 (синглетное состояние), Роджер У. Олдер) - ред. Гай Бертран
- Реакционная промежуточная химия Роберт А. Мосс, Мэтью Платц, Мейтленд Джонс (Глава 8, Стабильные синглетные карбены, Гай Бертран)
- R. W. Alder, в «Диаминокарбены: изучение структуры и реакционной способности», под ред. Дж. Бертран, Нью-Йорк, 2002 г.
- М. Регитц (1996). «Стабильные карбены - иллюзия или реальность?». Энгью. Chem. Int. Эд. Англ. 30 (6): 674–676. Дои:10.1002 / anie.199106741.
Для обзора физико-химических свойств (электроника, стерика, ...) N-гетероциклических карбенов:
- Т. Дрёге; Ф. Глориус (2010). «Мера всех колец - N-гетероциклические карбены». Энгью. Chem. Int. Эд. Англ. 49 (39): 6940–6952. Дои:10.1002 / anie.201001865. PMID 20715233. [Энгью. Chem. 2010, 122, 7094-7107.]
