Реакция вставки - Insertion reaction
An реакция вставки это химическая реакция где одно химическое соединение (a молекула или молекулярный фрагмент) вставляется в существующий связь обычно второго химического соединения например:
- А + ДО Н.Э → B–А–C
Этот термин относится только к результату реакции и не предполагает механизма. Инсерционные реакции наблюдаются в органический, неорганический, и металлоорганический химия. В тех случаях, когда металл-лиганд связь в координационный комплекс вовлечены, эти реакции обычно являются металлоорганическими по своей природе и включают связь между переходный металл и углерод или же водород.[1] Обычно это зарезервировано для случая, когда координационный номер и степень окисления металла остаются без изменений.[2] Когда эти реакции обратимы, удаление небольшой молекулы из связи металл-лиганд называется экструзией или элиминированием.
(а)
(б)
Есть две распространенные геометрии вставки - 1,1 и 1,2 (на фото выше). Кроме того, вставляющая молекула может действовать как нуклеофил или как электрофил к металлическому комплексу.[2] Это поведение будет обсуждаться более подробно для CO, нуклеофильное поведение и ТАК2, электрофильное поведение.
Органическая химия
Реакции омологации словно Соответствие эфира Ковальски[3] предоставить простые примеры процесса внедрения в органическом синтезе. в Реакция Арндта-Эйстерта,[4][5] а метиленовая установка вставлен в карбоксил -углеродная связь карбоновая кислота чтобы образовать следующую кислоту в гомологическая серия. Органический синтез дает пример т-BOC защищен (S)-фенилаланин (2-амино-3-фенилпропановая кислота) последовательно реагирует с триэтиламин, этилхлорформиат, и диазометан производить α-диазокетон, который затем реагирует с трифторацетатом серебра / триэтиламином в водном растворе с образованием т-BOC защищенная форма (S) -3-амино-4-фенилбутановая кислота.[6]
Механически,[7] α-диазокетон подвергается Перестановка Вольфа[8][9] сформировать кетен в 1,2-перегруппировка. Следовательно, метиленовая группа α- по отношению к карбоксильной группе в продукте представляет собой метиленовую группу из диазометанового реагента. Было показано, что 1,2-перегруппировка сохраняет стереохимию хирального центра как продукта, образованного из т-BOC защищенный (S) -фенилаланин сохраняет (S) стереохимия с сообщенным энантиомерный избыток не менее 99%.[6]
Связанное преобразование - это Реакция Ниренштейна в котором диазометановая метиленовая группа вставлена в углерод-хлорную связь хлорангидрид с образованием α-хлорметилкетона.[10][11] Пример, опубликованный в 1924 г., иллюстрирует реакцию в замещенном бензоилхлорид система:[12]
Возможно, что удивительно, α-бромацетофенон является второстепенным продуктом, когда эта реакция проводится с бензоилбромид, а димерный диоксан являясь основным продуктом.[13] Органические азиды также приведен пример реакции внедрения в органический синтез, и, как и в приведенных выше примерах, превращения протекают с потерей газообразный азот. Когда тозилазид реагирует с норборнадиен, а расширение кольца происходит реакция, в которой атом азота вставляется в углерод-углеродную связь α- с головкой мостика:[14]
В Перестановка Бекмана[15][16] является еще одним примером реакции расширения кольца, в которой гетероатом вставлен в углерод-углеродную связь. Наиболее важным применением этой реакции является превращение циклогексанон в его оксим, который затем перегруппировывается в кислых условиях, чтобы обеспечить ε-капролактам,[17] сырье для производства Нейлон 6. Годовое производство капролактама превышает 2 миллиарда килограммов.[18]
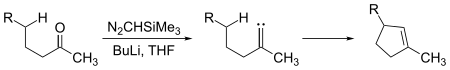
Карбены пройти оба межмолекулярный и внутримолекулярный реакции вставки. Циклопентен фрагменты могут быть получены из достаточно длинноцепочечных кетоны по реакции с триметилсилилдиазометан, (CH3)3Si – CHN2:
Здесь промежуточный карбен вставляется в связь углерод-водород, чтобы образовать связь углерод-углерод, необходимую для замыкания циклопентенового кольца. Вставки карбена в связи углерод-водород также могут происходить межмолекулярно:
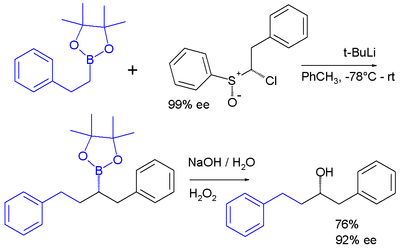
Карбеноиды находятся реактивные промежуточные продукты которые ведут себя аналогично карбенам.[19] Одним из примеров является реагент хлоралкиллитий карбеноид, приготовленный на месте из сульфоксид и т-BuLi который вставляется в связь углерод-бор пинакол бороновый эфир:[20]
Металлоорганическая химия
Многие реакции в металлоорганической химии включают введение одного лиганда (L) в металл-гидридную или металл-алкил / арильную связь. Обычно на L мигрирует гидридная, алкильная или арильная группа, которая часто представляет собой CO, алкен или алкин.
Карбонилирование
Внедрение моноксида углерода и алкенов в связи металл-углерод является широко используемой реакцией в основных промышленных приложениях.[21][22]

Такие реакции подчиняются обычным параметрам, которые влияют на другие реакции в координационной химии, но стерические эффекты особенно важны при определении стереохимии и региохимии реакций. Обратная реакция, удаление CO и алкенов, также имеет фундаментальное значение во многих каталитических циклах.
Широко используемые применения мигрирующего внедрения карбонильных групп: гидроформилирование и карбонилирование уксусной кислоты. Первый превращает алкены, водород и окись углерода в альдегиды. Производство уксусной кислоты карбонилированием осуществляется двумя аналогичными промышленными процессами. Более традиционным является родиевый Процесс с уксусной кислотой Monsanto, но этот процесс был заменен основанным на иридии Cativa процесс.[23][24] К 2002 году мировое годовое производство уксусной кислоты составило 6 миллионов тонн, из которых около 60% производится с помощью процесса Cativa.[23]
Процесс Cativa каталитический цикл, показанный выше, включает этапы вставки и удаления. Окислительная реакция присоединения йодистый метил с (1) включает формальную вставку иридиевого (I) центра в углерод-иодную связь, тогда как стадия (3) к (4) представляет собой пример мигрирующего внедрения окиси углерода в иридий-углеродную связь. Активные частицы катализатора регенерируются восстановительное устранение из ацетил иодид из (4), реакция удаления.[23]
Олефиновая вставка
Введение этилена и пропилена в алкилы титана является краеугольным камнем Катализ Циглера-Натта, коммерческий маршрут полиэтилена и полипропилена. В этой технологии в основном используются гетерогенные катализаторы, но широко распространено мнение, что принципы и наблюдения, касающиеся гомогенных систем, применимы и к твердотельным версиям. Связанные технологии включают Процесс производства высших олефинов Shell который производит моющее средство прекурсоры.[25] олефин можно согласовать с металлом перед введением. В зависимости от плотности лиганда металла может потребоваться диссоциация лиганда для обеспечения координационного сайта для олефина.[26]

Другие реакции внедрения в координационной химии
Многие электрофильные оксиды вставляются в металл-углеродные связи; к ним относятся диоксид серы, углекислый газ, и оксид азота. Эти реакции имеют ограниченное практическое значение, но представляют исторический интерес. С алкилами переходных металлов эти оксиды ведут себя как электрофилы и вставляют в связь между металлами и их относительно нуклеофильными алкильными лигандами. Как обсуждалось в статье о Металлические комплексы диоксида серы, вставка SO2 был рассмотрен особенно подробно.
Больше реакций внедрения в органической химии
Электроположительные металлы, такие как натрий, калий, магний, цинк и т. Д., Могут вставляться в алкилгалогениды, разрывая связь углерод-галогенид (галогенид может быть хлором, бромом, йодом) и образуя связь углерод-металл. Эта реакция происходит через SET механизм (механизм одноэлектронного переноса). Если магний реагирует с алкилгалогенидом, он образует Реактив Гриньяра, или если литий реагирует, литийорганический реагент сформирован. Таким образом, этот тип реакций внедрения имеет важные приложения в химический синтез.

Рекомендации
- ^ Дуглас, Макдэниел и Александр (1994). Концепции и модели неорганической химии 3-е изд.. John Wiley & Sons, Inc. ISBN 978-0-471-62978-8.CS1 maint: несколько имен: список авторов (связь)
- ^ а б J.J. Александр (1985). Хартли и Патай (ред.). Химия связи металл-углерод, т. 2. Джон Вили и сыновья.
- ^ Reddy, R.E .; Ковальски, К. Дж. (1993). «Этил-1-нафтилацетат: гомологация сложного эфира через инолат-анионы». Органический синтез. 71: 146.; Коллективный объем, 9, п. 426
- ^ Арндт, Ф.; Эйстерт, Б. (1935). "Ein Verfahren zur Überführung von Carbonsäuren in ihre höheren Homologen bzw. deren Derivate". Бер. Dtsch. Chem. Ges. (на немецком). 68 (1): 200–208. Дои:10.1002 / cber.19350680142.
- ^ Пока что.; МакКервей, М.А. (1994). «Органический синтез с α-диазокарбонильными соединениями». Chem. Ред. 94 (4): 1091–1160. Дои:10.1021 / cr00028a010.
- ^ а б Linder, M. R .; Steurer, S .; Подлеч, J. (2002). "(S)-3-(терт-Бутилоксикарбониламино) -4-фенилбутановая кислота ». Органический синтез. 79: 154.; Коллективный объем, 10, п. 194
- ^ Huggett, C .; Арнольд, Р. Т .; Тейлор, Т. I. (1942). «Механизм реакции Арндта-Эйстерта». Варенье. Chem. Soc. 64 (12): 3043. Дои:10.1021 / ja01264a505.
- ^ Meier, H .; Целлер, К.-П. (1975). «Перегруппировка Вольфа α-диазокарбонильных соединений». Энгью. Chem. Int. Эд. 14 (1): 32–43. Дои:10.1002 / anie.197500321.
- ^ Кирмс, В. (2002). «100 лет перестановки Вольфа». Евро. J. Org. Chem. 2002 (14): 2193–2256. Дои:10.1002 / 1099-0690 (200207) 2002: 14 <2193 :: AID-EJOC2193> 3.0.CO; 2-D.
- ^ Clibbens, D.A .; Ниренштейн, М. (1915). «Действие диазометана на некоторые ароматические ацилхлориды». J. Chem. Soc., Trans. 107: 1491–1494. Дои:10.1039 / CT9150701491.
- ^ Бахманн, В.Э.; Струве, В. С. (1942). «Реакция Арндта-Эйстерта». Орг. Реагировать. 1: 38.
- ^ Ниренштейн, М .; Wang, D.G .; Уорр, Дж. К. (1924). «Действие диазометана на некоторые ароматические ацилхлориды II. Синтез фисетола». Варенье. Chem. Soc. 46 (11): 2551–2555. Дои:10.1021 / ja01676a028.
- ^ Lewis, H.H .; Ниренштейн, М .; Рич, Э. М. (1925). «Действие диазометана на некоторые ароматические ацилхлориды III. Механизм реакции». Варенье. Chem. Soc. 47 (6): 1728–1732. Дои:10.1021 / ja01683a036.
- ^ Рид, Д. Д .; Бергмайер, С. К. (2007). «Легкий синтез полигидроксилированного 2-азабицикло [3.2.1] октана». J. Org. Chem. 72 (3): 1024–1026. Дои:10.1021 / jo0619231. PMID 17253828.
- ^ Бекманн, Э. (1886). "Zur Kenntniss der Isonitrosoverbindungen". Бер. Dtsch. Chem. Ges. (на немецком). 19: 988–993. Дои:10.1002 / cber.188601901222.
- ^ Гоули, Р. Э. (1988). «Реакции Бекмана: перегруппировка, добавление исключения, фрагментации и перегруппировка-циклизации». Орг. Реагировать. 35: 14–24. Дои:10.1002 / 0471264180.or035.01. ISBN 0471264180.
- ^ Eck, J.C .; Марвел, С. С. (1939). «ε-Бензоиламинокапроновая кислота». Органический синтез. 19: 20.; Коллективный объем, 2, 1943, с. 76
- ^ Ritz, J .; Fuchs, H .; Kieczka, H .; Моран, В. К. (2000). «Капролактам». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a05_031. ISBN 3527306730.
- ^ Макмерри, Дж. (1988). Органическая химия (2-е изд.). Брукс / Коул. ISBN 0-534-07968-7.
- ^ Блейкмор, П.; Бердж, М. С. (2007). «Итеративная стереоспецифическая гомологация боронатов пинакол с помощью энантиообогащенных хлоралкиллитиевых реагентов, контролируемая стереоспецифическими реагентами». Варенье. Chem. Soc. 129 (11): 3068–3069. Дои:10.1021 / ja068808s. PMID 17326640.
- ^ Эльшенбройх, К. «Металлоорганические соединения» (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Хартвиг, Дж. Ф. Химия органических переходных металлов, от связывания до катализа; Научные книги университета: Нью-Йорк, 2010. ISBN 1-891389-53-X
- ^ а б c Джонс, Дж. Х. (2000). «Процесс Cativa для производства уксусной кислоты» (PDF). Platinum Metals Rev. 44 (3): 94–105.
- ^ Sunley, G.J .; Уотсон, Д. Дж. (2000). «Высокопроизводительный катализ карбонилирования метанола с использованием иридия - процесс Cativa для производства уксусной кислоты». Катализ сегодня. 58 (4): 293–307. Дои:10.1016 / S0920-5861 (00) 00263-7.
- ^ Крэбтри, Р. Х. (2009). Металлоорганическая химия переходных металлов.. Джон Уайли и сыновья. п. 19–25. ISBN 978-0-470-25762-3.
- ^ Кисин, Ю. В. (2008). «Синтез, химический состав и структура компонентов переходных металлов и сокатализаторов в каталитических системах для полимеризации алкенов». Реакции полимеризации алкенов с катализаторами переходных металлов. Амстердам: Эльзевир. С. 207–290. ISBN 978-0-444-53215-2.