Реакция Ниренштейна - Nierenstein reaction
| Реакция Ниренштейна | |
|---|---|
| Названный в честь | Максимилиан Ниренштейн |
| Тип реакции | Реакция образования углерод-углеродной связи |
В Реакция Ниренштейна является органическая реакция описывая преобразование хлорангидрид в галокетон с диазометан.[1][2] Это реакция вставки в этом метиленовая группа из диазометана вводится в связь углерод-хлор хлорангидрида.

Механизм реакции
Реакция протекает через соль диазония промежуточное звено, образованное нуклеофильное ацильное замещение хлорида с диазометил-анионом. Затем хлорид замещает диазогруппу в SN2 реакция, с N2 как уходящая группа.
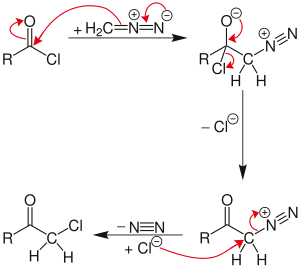
Если во время реакции присутствует избыток диазометана, он может действовать как основание, отщепляя водород из промежуточной соли диазония. В результате получается нейтральный диазокетон, который не реагирует с хлоридом. Вместо этого, побочный продукт, диазоний-метил из другой молекулы диазометана, может подвергаться атаке хлорида с образованием хлорметан. Неактивный диазокетон может быть повторно активирован и вступить в реакцию при лечении хлористый водород дать нормальный продукт Ниренштейна.

В некоторых случаях даже ограничение количества диазометана приводит к тому, что процесс реакции останавливается по пути нейтрального диазокетона, что требует добавления газообразного HCl для его восстановления.[3]
Объем
Одна оригинальная реакция Ниренштейна 1924 года:[4]

и реакция, начиная с бензоилбромид сойти с ума с формированием диоксан димер:[5]

Смотрите также
- Максимилиан Ниренштейн
- Перестановка Курция
- Перестановка Вольфа
- Реакция Арндта – Эйстерта: где хлорангидриды реагируют с диазометаном с образованием карбоновых кислот с удлиненной цепью посредством перегруппировки
использованная литература
- ^ Clibbens, D .; Ниренштейн, М. (1915). «Действие диазометана на некоторые ароматические хлорангидриды». J. Chem. Soc. 107: 1491. Дои:10.1039 / CT9150701491.
- ^ Бахман, В.Э.; Струве, В. С. (1942). «Реакция Арндта-Эйстерта». Орг. Реагировать. 1: 38. (Обзор)
- ^ McPhee, W. D; Клингсберг, Э. Органический синтез, Сб. Vol. 3, стр.119 (1955); Vol. 26, стр.13 (1946). (Статья )
- ^ М. Ниренштейн; Д. Г. Ван и Дж. К. Уорр (1924). «Действие диазометана на некоторые ароматические ацилхлориды II. Синтез фисетола». Варенье. Chem. Soc. 46 (11): 2551–2555. Дои:10.1021 / ja01676a028.
- ^ Х. Х. Льюис; М. Ниренштейн и Энид М. Рич (1925). «Действие диазометана на некоторые ароматические ацилхлориды III. Механизм реакции». Варенье. Chem. Soc. 47 (6): 1728–1732. Дои:10.1021 / ja01683a036.
