Миграционная вставка - Migratory insertion
А миграционная вставка это тип реакция в металлоорганическая химия где два лиганды на металлический комплекс объединить. Это подмножество реакций, которые очень похожи на реакции вставки, и оба отличаются механизм что приводит к получению стереохимия продуктов. Однако часто они используются как взаимозаменяемые, поскольку механизм иногда неизвестен. Следовательно, миграционные реакции вставки или, для краткости, реакции вставки определяются не механизмом, а общим региохимия в котором один химический объект внедряется в существующий связь обычно второго химического объекта, например:[1]
- А + ДО Н.Э → B–А–C
Обзор
В мигрирующей вставке лиганд, рассматриваемый как анион (X) лиганд в и лиганд, который рассматривается как нейтральный пара, генерирующая новый анионный лиганд. Взаимодействующие анион и нейтральный лиганды находятся рядом. Если предшественник комплекс координационно насыщенный мигрирующая вставка часто приводит к координационно ненасыщенный товар. Затем новый (нейтральный) лиганд может реагировать с металл приводя к дальнейшей вставке. Процесс может происходить много раз на одном металле, как в полимеризация олефинов.
Анионный лиганд может быть: H− (гидрид ), Р− (алкил), ацил, Ar− (арил ), или или− (алкоксид ). Способность этих групп к миграции называется их способность к миграции. Нейтральный лиганд может быть СО, алкен, алкин, а в некоторых случаях даже карбен.
К мигрирующей вставке относятся разные реакции. Один из механизмов включает атаку анионного лиганда на электрофильный часть нейтрального лиганда (анионный лиганд мигрирует к нейтральному лиганду). Другой механизм заключается в том, что нейтральный лиганд вставляется между металлом и анионным лигандом.
Вставка CO
Включение монооксид углерода в связь металл-углерод, чтобы сформировать ацил группа является основой карбонилирование реакции, что дает много коммерчески полезных продуктов.
Механизм
CO вставляется в металлическийалкил связь через миграционную вставку. Ключевая идея заключается в том, что как CO, так и алкильные группы являются лигандами одного и того же металла. Например, реакция 13CO с Mn (CO)5CH3 исключительно из Mn (CO)4(13CO) COCH3. Алкильная группа мигрирует внутримолекулярно к соседнему лиганду CO внутри сфера координации из Mn (I) центр. После миграции металл связывает свободный CO (см. Рисунок ниже).[2][3]
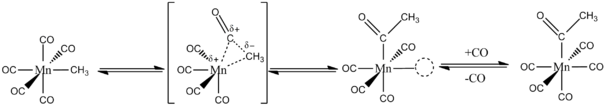 Путь реакции внедрения CO для октаэдрического комплекса
Путь реакции внедрения CO для октаэдрического комплекса
Введение CO не всегда связано с миграцией. Лечение CpFe (L) (CO) CH3 с 13CO образует смесь как продуктов миграции алкила, так и продуктов, образованных истинным введением связанных карбонилы в метил группа. Распространение продукта зависит от выбора растворитель.[4]
Алкильные производные квадратно-планарные комплексы особенно легко подвергаются введению CO. Реакции внедрения в плоские квадратные комплексы представляют особый интерес из-за их промышленного применения. Поскольку плоские квадратные комплексы часто координационно ненасыщенный, они чувствительны к образованию 5-координатных аддуктов, которые легко подвергаются миграционной вставке.[4] В большинстве случаев предпочтительным является путь миграции в плоскости, но, в отличие от нуклеофильный пути, он ингибируется избытком CO.[5]

Влияние на скорость реакции
- Стерические эффекты деформация - Увеличение стерической деформации хелат основная цепь в плоских квадратных комплексах сближает карбонильные и метильные группы, увеличивая реактивность реакций внедрения.[5]
- Состояние окисления - Окисление металла приводит к увеличению скорости реакции внедрения. Основным ограничивающим скорость этапом в механизме является миграция метильной группы на карбонильный лиганд, окисление металла за счет передачи большего частичного положительного заряда на ацетилуглерод и, таким образом, увеличение скорости реакции.[6]
- Кислоты Льюиса - Кислоты Льюиса также увеличивают скорость реакции по причинам, подобным окислению металлов, увеличивая положительный заряд углерода. Кислоты Льюиса связываются с кислородом CO и снимают заряд, увеличивая электрофильность углерода. Это может увеличить скорость реакции до 10 раз.8, и образовавшийся комплекс достаточно стабилен, чтобы реакция протекала даже без дополнительного CO для связывания с металлом.[6]
- Электроотрицательность из уходящая группа - Повышение электроотрицательности уходящей алкильной группы стабилизирует взаимодействие металл-углеродной связи и, таким образом, увеличивает энергия активации требуется для миграции, что снижает скорость реакции.[7]
- Транс-эффект - Известно, что лиганды в октаэдрическом или квадратно-плоском комплексе влияют на реакционную способность группы, к которой они принадлежат. транс. Это влияние лиганда часто называют транс-влияние, и оно различается по интенсивности между лигандами. Неполный список транс-влияния лигандов: от высших транс-эффект на самый низкий:[4] арил, алкил> NR3 > PR3 > AsR3 > CO> Cl. Лиганды с большей транс-влияние придает большую электрофильность активному центру. Экспериментально показано, что увеличение электрофильности группы СО значительно увеличивает скорость реакции, в то время как уменьшение электрофильности метильной группы несколько увеличивает скорость реакции. Это может быть продемонстрировано путем реакции квадратного плоского [(PN) M (CO) (CH3)] комплекс с CO, где PN - двузубый фосфор- или азотсвязанный лиганд. Эта реакция протекает с гораздо большим выходом, когда метильная группа транс-P и СО транс-N, в силу более высокой транс-влияние более электроотрицательного азота.[5]
Обратная реакция
Декарбонилирование из альдегиды, обратная введению CO, является хорошо известной реакцией:
- RCHO → RH + CO
Реакция не получила широкого распространения отчасти потому, что алканы являются менее полезными материалами, чем предшественники альдегидов. Кроме того, реакцию нечасто проводят каталитически, потому что экструдированный СО может медленно диссоциировать.[8] Экструзия CO из органического альдегида наиболее широко демонстрируется с использованием Катализатор Уилкинсона:[9]
- RhCl (PPh3)3 + RCHO → RhCl (CO) (PPh3)2 + RH + PPh3
Посмотри пожалуйста Реакция декарбонилирования Цуджи-Уилкинсона в качестве примера этой элементарной металлоорганической стадии синтеза
Введение других оксидов
Многие электрофильные оксиды вставляются в металл-углеродные связи; к ним относятся диоксид серы, углекислый газ, и оксид азота. Эти реакции имеют ограниченное практическое значение или не имеют его вообще, но представляют исторический интерес. С алкилами переходных металлов эти оксиды ведут себя как электрофилы и вставляют в связь между металлами и их относительно нуклеофильными алкильными лигандами. Как обсуждалось в статье о Металлические комплексы диоксида серы, вставка SO2 был рассмотрен особенно подробно. ТАК2 вставки, чтобы дать как О-сульфинаты и S-сульфинаты, в зависимости от металлического центра.[10] Для квадратных плоских алкильных комплексов предполагается предварительное равновесие, включающее образование аддукта.[11]
Вставка алкенов в связи металл-углерод
Включение алкены как металл-углерод. Введение этилена и пропилена в алкилы титана является краеугольным камнем Катализ Циглера – Натта, основной источник полиэтилена и полипропилена. Большая часть этой технологии включает гетерогенные катализаторы, но широко распространено мнение, что принципы и наблюдения в отношении гомогенных систем применимы к твердотельным версиям. Связанные технологии включают Процесс производства высших олефинов Shell который производит моющее средство прекурсоры.
 Этапы полимеризации алкена. Стадия i включает связывание мономера с металлом, а стадия ii включает стадию мигрирующей вставки. Эти этапы, которые чередуются от одной стороны металлического центра к другой, повторяются много раз для каждой полимерной цепи. Ящик представляет собой свободный (или крайне неустойчивый) координационный сайт.
Этапы полимеризации алкена. Стадия i включает связывание мономера с металлом, а стадия ii включает стадию мигрирующей вставки. Эти этапы, которые чередуются от одной стороны металлического центра к другой, повторяются много раз для каждой полимерной цепи. Ящик представляет собой свободный (или крайне неустойчивый) координационный сайт.
Механизм
Факторы, влияющие на скорость олефиновых вставок, включают образование циклического плоского четырехцентрового переходного состояния, включающего начальное образование связи между металлом и олефиновым углеродом. Из этого переходного состояния можно видеть, что частичный положительный заряд образуется на β-углероде, а частичный отрицательный заряд формируется на углероде, первоначально связанном с металлом. Эта поляризация объясняет наблюдаемое впоследствии образование связи между отрицательно заряженным углеродом / водородом и положительно заряженным β-углеродом, а также одновременное образование связи металл-α-углерод. Это переходное состояние также подчеркивает два фактора, которые наиболее сильно влияют на скорость реакций внедрения олефина: (i) перекрытие орбиталей алкильной группы, первоначально присоединенной к металлу, и (ii) прочность связи металл-алкил. Благодаря большему перекрытию орбиталей между частично положительным β-углеродом и частично отрицательным атомом водорода / атома углерода алкильной группы, образование новой связи C-C облегчается. По мере увеличения прочности связи металл-алкил разрыв связи между металлом и связью водород / алкилуглерод с образованием двух новых связей с α-углеродом и β-углеродом (соответственно) происходит медленнее, что снижает скорость реакции вставки.[12]
Встраивание алкенов по связям M – H
Встраивание алкенов в связи металл-водород - ключевой шаг в гидрирование и гидроформилирование реакции. Реакция включает объединение алкеновых и гидридных лигандов в координационной сфере катализатора. При гидрировании образующийся алкильный лиганд соединяется со вторым гидридом с образованием алкана. Аналогичные реакции применимы к гидрированию алкинов: алкенильный лиганд соединяется с гидридом для удаления алкена.

Механизм
С точки зрения механизма внедрение алкенов по связи M – H и по связям M – C описывается аналогично. Оба включают четырехчленные переходные состояния, при которых на металл помещается менее замещенный углерод.
Обратное включение олефина в связь металл-водород: устранение β-гидрида. В Принцип микроскопической обратимости требует, чтобы механизм отщепления β-гидрида следовал тому же пути, что и внедрение алкенов в связи гидрида металла. Первым требованием для удаления β-гидрида является присутствие водорода в положении β по отношению к металлу. β-отщепление требует свободного координационного положения на металле, которое будет вмещать отводимый водород.[13]
Промышленное применение
Карбонилирование
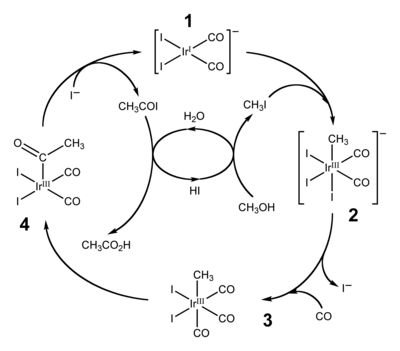
Два широко используемых применения мигрирующего внедрения карбонильных групп: гидроформилирование и производство уксусная кислота к карбонилирование из метанол. Первый превращает алкены, водород и окись углерода в альдегиды. Производство уксусной кислоты карбонилированием осуществляется двумя аналогичными промышленными процессами. Более традиционным является Процесс с уксусной кислотой Monsanto, который основан на родий-йодном катализаторе для преобразования метанола в уксусную кислоту. Этот процесс был заменен Cativa процесс в котором используется родственный иридиевый катализатор [Ir (CO)2я2]− (1).[14][15] К 2002 году мировое годовое производство уксусной кислоты составило 6 миллионов тонн, из которых около 60% производится с помощью процесса Cativa.[14]
Процесс Cativa каталитический цикл, показанный выше, включает этапы вставки и удаления. Окислительная реакция присоединения метилиодид с (1) включает формальную вставку иридиевого (I) центра в углерод-иодную связь, в то время как шаг (3) к (4) представляет собой пример мигрирующего внедрения окиси углерода в иридий-углеродную связь. Активные частицы катализатора регенерируются восстановительное устранение из ацетил иодид из (4), реакция удаления.[14]
Полимеризация алкенов
Промышленные применения алкеновых вставок включают катализируемые металлами пути получения полиэтилена и полипропилена. Обычно эти преобразования катализируется гетерогенно трихлоридом титана, которые активируются алкилами алюминия. Эта технология известна как Катализаторы Циглера – Натта.[16] В этих реакциях этилен координируется с металлическим титаном с последующим его введением. Эти этапы можно повторять несколько раз, что потенциально может привести к полимерам с высокой молекулярной массой.
Рекомендации
- ^ Эльшенбройх, К. (2006). Металлоорганические соединения. Вайнхайм: Wiley-VCH. ISBN 978-3-527-29390-2.
- ^ Хартвиг, Дж. Ф. (2010). Химия органических переходных металлов, от связывания до катализа. Нью-Йорк, Нью-Йорк: Университетские научные книги. ISBN 978-1-891389-53-5.
- ^ Ядав, М. С. (2005). Быстрый обзор по неорганической химии. Публикации Anmol. п. 244. ISBN 978-81-261-1898-4.
- ^ а б c Андерсон, Г. К .; Кросс, Р. Дж. (1984). «Карбонильные реакции внедрения плоских квадратных комплексов». Соотв. Chem. Res. 17 (2): 67–74. Дои:10.1021 / ar00098a005.
- ^ а б c Кавелл, К. Дж. (1996). «Недавние фундаментальные исследования миграционной вставки в связи металл-углерод». Coord. Chem. Ред. 155 (11): 209–243. Дои:10.1016 / S0010-8545 (96) 90182-4.
- ^ а б Александр, J.J. (1985). «Вставки в связи переходный металл-углерод». В Хартли; Патай (ред.). Химия связи металл – углерод. 2. Джон Вили и сыновья. Дои:10.1002 / 9780470771747.ch5.
- ^ Шустерман, А. Дж .; Тамир, I .; Просс, А. (1988). "Механизм реакций миграции металлорганических соединений. Подход смешения конфигураций (CM)". J. Organomet. Chem. 340 (2): 203–222. Дои:10.1016 / 0022-328X (88) 80076-7.
- ^ Фриструп, Питер; Крейс, Майкл; Палмелунд, Андерс; Норрби, Пер-Ола; Мэдсен, Роберт (2008). "Механизм катализированного родием декарбонилирования альдегидов: совместное экспериментальное и теоретическое исследование". Варенье. Chem. Soc. 130 (15): 5206–5215. Дои:10.1021 / ja710270j. PMID 18303836.
- ^ Оно, К .; Цудзи, Дж. (1968). «Органический синтез с помощью соединений благородных металлов. XXXV. Новые реакции декарбонилирования альдегидов и ацилгалогенидов с использованием комплексов родия». Варенье. Chem. Soc. 90 (1): 99–107. Дои:10.1021 / ja01003a018.
- ^ Дуглас; МакДэниел; Александр (1994). Концепции и модели неорганической химии (3-е изд.). John Wiley & Sons, Inc. ISBN 978-0-471-62978-8.
- ^ Puddephatt, R.A .; Стальтери, М.А. (1980). «Конкуренция между введением диоксида серы в связь метил- или фенил-переходного металла». Журнал металлоорганической химии. 193: C27 – C29. Дои:10.1016 / S0022-328X (00) 86091-X.
- ^ Burger, B.J .; Томпсон, М. Э .; Коттер, W. D .; Беркоу, Дж. Э. (1990). «Введение этилена и удаление β-водорода для перметилскандоценовых алкильных комплексов. Исследование стадий распространения и обрыва цепи в полимеризации этилена по Циглеру-Натта». Варенье. Chem. Soc. 112 (4): 1566–1577. Дои:10.1021 / ja00160a041.
- ^ Крэбтри, Р. Х. (2009). Металлоорганическая химия переходных металлов.. Джон Уайли и сыновья. п. 192. ISBN 978-0-470-25762-3.
- ^ а б c Джонс, Дж. Х. (2000). «Процесс Cativa для производства уксусной кислоты». Платин. Встретились. Ред. 44 (3): 94–105.[постоянная мертвая ссылка ]
- ^ Sunley, G.J .; Уотсон, Д. Дж. (2000). «Высокопроизводительный катализ карбонилирования метанола с использованием иридия - процесс Cativa для производства уксусной кислоты». Катализ сегодня. 58 (4): 293–307. Дои:10.1016 / S0920-5861 (00) 00263-7.
- ^ Кисин, Ю. В. (2008). «Синтез, химический состав и структура компонентов переходных металлов и сокатализаторов в каталитических системах для полимеризации алкенов». Реакции полимеризации алкенов с катализаторами переходных металлов. Амстердам: Эльзевир. С. 207–290. ISBN 978-0-444-53215-2.