Электроциклическая реакция - Electrocyclic reaction
В органическая химия, электроциклическая реакция это тип перициклический перестановка где чистый результат - один пи бонд превращается в один сигма-облигация или наоборот.[1] Эти реакции обычно классифицируются по следующим критериям:
- Реакции могут быть либо фотохимический или термический.
- Реакции могут быть как открывающими, так и замыкающими (электроциклизация).
- В зависимости от типа реакции (фотохимическая или термическая) и количества пи-электронов реакция может происходить либо через хихикающий или дисротативный механизм.
- Тип вращения определяет, будет ли цис или транс изомер продукта будет образован.
Классические примеры
В Назарова реакция циклизации представляет собой названную электроциклическую реакцию превращения дивинилкетонов в циклопентеноны.
Классический пример - тепловая реакция раскрытия кольца 3,4-диметилциклобутена. В цис-изомер исключительно дает цис, транс-гекса-2,4-диен тогда как транс-изомер дает транс, транс-диен:[2]

Такой ход реакции можно объяснить простым анализом через погранично-орбитальный метод: сигма-связь в реагенте откроется таким образом, что образовавшаяся р-орбитали будет иметь ту же симметрию, что и HOMO продукта (a гексадиен ). Единственный способ добиться этого - через соперничающий раскрытие кольца, что приводит к противоположным знакам для терминальных долей.

Стереоспецифичность электроциклических реакций
При проведении электроциклической реакции часто желательно предсказать цис / транс геометрия продукта реакции. Первым шагом в этом процессе является определение того, проходит ли реакция через вращение или развращение. В таблице ниже приведены правила селективности термических и фотохимических электроциклических реакций.
| Система | Термически индуцированный (основное состояние) | Фотохимически индуцированный (возбужденное состояние) |
|---|---|---|
| Четное количество спряжения | Сочувственный | Дисротативный |
| Нечетное количество спряжения | Дисротативный | Сочувственный |
Для примера, приведенного ниже, тепловой реакция (транс, цис, транс) -окта-2,4,6-триена будет происходить через дисротационный механизм. После определения типа вращения можно определить, будет ли продукт цис или транс, исследуя исходную молекулу. В приведенном ниже примере дисротация приводит к тому, что оба метила направлены вверх, в результате чего продукт СНГ-диметилциклогексадиен.
В дополнение торкоселективность в электроциклической реакции относится к направлению вращения. Например, одновременная реакция может вращаться в двух направлениях с образованием энантиомерных продуктов. Торкоселективная реакция ограничивает одно из этих направлений вращения (частично или полностью) для получения продукта в энантиомерный избыток.
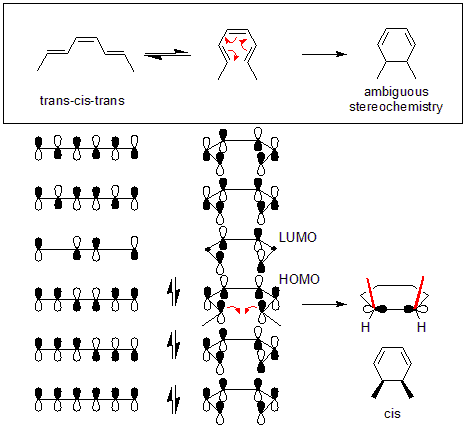
Механизм тепловых реакций
Правила Вудворда-Хоффмана

Затем для этих двух процессов могут быть построены корреляционные диаграммы, которые связывают молекулярные орбитали реагента с орбиталями продукта, имеющего ту же симметрию.[3]

Эти корреляционные диаграммы показывают, что только вращательное раскрытие кольца 3,4-диметилциклобутена является симметричным, в то время как симметрия разрешена только вращающимся раскрытием кольца 5,6-диметилциклогекса-1,3-диена. Это связано с тем, что только в этих случаях в переходном состоянии произойдет максимальное перекрытие орбит. Кроме того, формованный продукт будет находиться в основном состоянии, а не в возбужденном состоянии.
Пограничная теория молекулярных орбиталей
Согласно теории пограничных молекулярных орбиталей, сигма-связь в кольце откроется таким образом, что результирующие p-орбитали будут иметь ту же симметрию, что и ВЗМО продукта.[4]
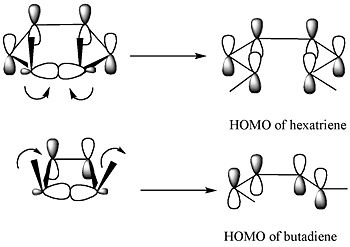
Для 5,6-диметилциклогекса-1,3-диена только дисротационный режим может привести к p-орбиталям, имеющим такую же симметрию, что и HOMO гексатриена. Для 3,4-диметилциклобутена, с другой стороны, только конротаторная мода приведет к p-орбиталям, имеющим такую же симметрию, что и HOMO бутадиена.
Механизм фотохимических реакций
Если бы раскрытие цикла 3,4-диметилциклобутена осуществляли в фотохимических условиях, результирующая электроциклизация происходила бы через дисротационный режим, а не через вращательный режим, как можно увидеть на диаграмме корреляции для реакции раскрытия кольца в разрешенном возбужденном состоянии.
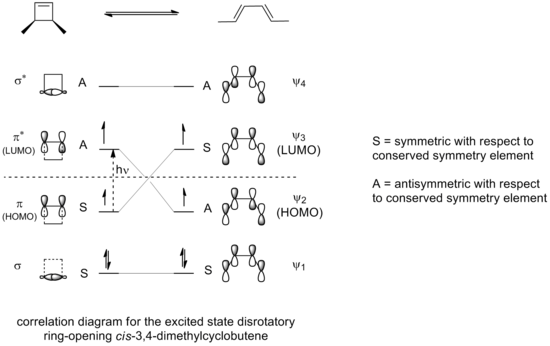
Только дисротационный режим, в котором симметрия относительно плоскости отражения сохраняется на протяжении всей реакции, приведет к максимальному перекрытию орбиталей в переходном состоянии. Также, опять же, это привело бы к образованию продукта, который находится в возбужденном состоянии, стабильность которого сопоставима с возбужденным состоянием реагирующего соединения.
Электроциклические реакции в биологических системах
В природе часто происходят электроциклические реакции.[5] Одной из наиболее распространенных таких электроциклизаций является биосинтез Витамин Д3.

Первый этап включает фотохимически индуцированное открывание конротаторного кольца 7-дегидрохолестерина с образованием пре-витамина D3. [1,7] -гидридный сдвиг затем образует витамин D3.
Другой пример - предлагаемый биосинтез аранотина, встречающегося в природе оксепина, и родственных ему соединений.

Ферментативное эпоксидирование дикетопиперазина, производного от фенилаланина, приводит к образованию оксида арена, который подвергается реакции электроциклизации с раскрытием цикла с 6π-дисротацией с образованием нециклизованного оксепина. После второго эпоксидирования кольца соседний нуклеофильный азот атакует электрофильный углерод, образуя пятичленное кольцо. Полученная кольцевая система представляет собой обычную кольцевую систему, обнаруженную в аранотине и родственных ему соединениях.
Бензоноркарадиен-дитерпеноид (A) был преобразован в бензоциклогептатриен-дитерпеноид изосальвипуберлин (B) путем кипячения раствора хлористого метилена. Это превращение можно представить как дисротаторную электроциклическую реакцию, за которой следуют два супрафациальных 1,5-сигматропных водородных сдвига, как показано ниже.[6]

Электроциклические реакции в органическом синтезе
Часто изучаемая электроциклическая реакция - это одновременное термическое раскрытие кольца бензоциклобутен. Продукт реакции представляет собой очень нестабильный орто-хинодиметан, но эта молекула может быть захвачена в эндо добавление с сильным диенофил Такие как малеиновый ангидрид к Дильс-Альдер аддукт. В химический выход для раскрытия кольца бензоциклобутана, изображенного на схема 2 оказывается, что зависит от природы заместитель Р.[7] С реакцией растворитель Такие как толуол и температуре реакции 110 ° C выход увеличивается от метил от изобутилметила до триметилсилилметила. Увеличение скорость реакции для триметилсилил соединение можно объяснить кремниевое сверхсопряжение поскольку связь βC-Si ослабляет связь циклобутана C-C, отдавая электроны.

А биомиметик электроциклический каскадная реакция был обнаружен в связи с выделением и синтезом некоторых эндиандриновых кислот:[8][9]

Асимметричный электроциклические реакции - новая область современного органического синтеза. Наиболее часто изучаемыми реакциями в этой области являются синтез β-лактама 4π Штаудингера.[10] и 4π Назаров реакция; асимметричный катализ обеих реакций контролировался с помощью хиральный вспомогательный, и реакция Назарова была исполнена каталитически используя хиральный Кислоты Льюиса, Кислоты Бренстеда и хиральные амины.[11]
Рекомендации
- ^ Золотая книга ИЮПАК
- ^ Получение и изомеризация - и -3,4-диметилциклобутена. Буквы Тетраэдра, Volume 6, Issue 17, 1965, Pages 1207-1212 Рудольф Эрнст К. Винтер Дои:10.1016 / S0040-4039 (01) 83997-6
- ^ Сохранение орбитальной симметрии. Соотв. Chem. Res., Volume 1, Issue 1, 1968, Pages 17–22 Роальд Хоффманн и Роберт Б. Вудворд Дои:10.1021 / ar50001a003
- ^ Флеминг, Ян. Пограничные орбитали и органические химические реакции. 1976 (John Wiley & Sons, Ltd.) ISBN 0-471-01820-1
- ^ Биосинтетические и биомиметические электроциклизации. Chem. Ред., Volume 105, Issue 12, 2005, Pages 4757-4778 Кристофер М. Бодри, Иеремия П. Малерич и Дирк Траунер Дои:10.1021 / cr0406110
- ^ Дж. Т. Арнасон, Рэйчел Мата, Джон Т. Ромео. Фитохимия лекарственных растений (2-е издание) .1995 (Springer) ISBN 0-306-45181-6, ISBN 978-0-306-45181-2
- ^ Ускоренное электроциклическое раскрытие бензоциклобутенов под действием атома кремния Юдзи Мацуя, Норико Осава и Хидео Немото Варенье. Chem. Soc.; 2006; 128 (2), стр. 412–413; (Коммуникация) Дои:10.1021 / ja055505 +
- ^ Каскад эндиандриновой кислоты. Электроциклизации в органическом синтезе. 4. Биомиметический подход к эндиандриновым кислотам A-G. Полный синтез и термические исследования К. К. Николау, Н. А. Петасис, Р. Э. Зипкин Варенье. Chem. Soc., 1982, 104 (20), стр. 5560–5562 Дои:10.1021 / ja00384a080
- ^ Вдохновения, открытия и перспективы в полном синтезе К. К. Николау J. Org. Chem., 2009 Статья как можно скорее Дои:10.1021 / jo802351b
- ^ https://www.organic-chemistry.org/ namedreactions/staudinger-synthesis.shtm
- ^ Асимметричные электроциклические реакции, С. Томпсон, А. Г. Койн, П. К. Книп и М. Д. Смит, Chem. Soc. Ред., 2011, 40, стр. 4217-4231 Дои:10.1039 / C1CS15022G
