Перекись водорода - мочевина - Hydrogen peroxide - urea
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Другие имена Пероксид мочевины, перкарбамид, UHP | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.275 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| CЧАС6N2О3 | |||
| Молярная масса | 94.070 г · моль−1 | ||
| Внешность | Белое твердое вещество | ||
| Плотность | 1,50 г / см3 | ||
| Температура плавления | От 75 до 91,5 ° C (от 167,0 до 196,7 ° F; от 348,1 до 364,6 K) (разлагается) | ||
| Фармакология | |||
| D02AE01 (ВОЗ) | |||
| Опасности | |||
| Паспорт безопасности | Внешний паспорт безопасности материалов | ||
Классификация ЕС (DSD) (устарело) | |||
| точка возгорания | 60 ° С (140 ° F, 333 К) | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Перекись водорода - мочевина (также называемый Гиперол, Artizone, перекись водорода мочевины, и UHP) представляет собой твердое тело, состоящее из равных количеств пероксид водорода и мочевина. Это соединение белого цвета кристаллическое твердое вещество который растворяется в воде с образованием свободной перекиси водорода. Перекись водорода - мочевина содержит твердую и безводную перекись водорода, которая при использовании в качестве окислителя обеспечивает более высокую стабильность и лучшую управляемость, чем жидкая перекись водорода. Часто называют перекись карбамида в стоматологическом кабинете он используется как источник перекиси водорода для отбеливания, дезинфекции и окисления.
Производство
Для приготовления комплекса мочевину растворяют в 30% перекиси водорода (мольное соотношение 2: 3) при температуре ниже 60 ° C. при охлаждении этого раствора перекись водорода - мочевина выпадает в осадок в виде небольших тромбоцитов.[1]
Определение содержания пероксида водорода титрованием раствором перманганата калия дает значение 35,4%, что соответствует 97,8% от теоретического максимального значения. Остающаяся примесь состоит из мочевины.
Сродни кристаллизационная вода, пероксид водорода совместно кристаллизуется с мочевиной с стехиометрия из 1: 1. Компаунд просто производится (в масштабе нескольких сотен тонн в год) путем растворения мочевина чрезмерно концентрированный пероксид водорода решение, за которым следует кристаллизация.[2] Аналогичен лабораторный синтез.[3]
Структура и свойства
Твердотельная структура этого аддукта была определена нейтронография.[4]
Пероксид водорода-мочевина представляет собой легко растворимое в воде кристаллическое твердое вещество без запаха, которое доступно в виде белого порошка, бесцветных игл или тромбоцитов.[1] При растворении в различных растворителях комплекс 1: 1 диссоциирует обратно на мочевину и перекись водорода. Так просто как пероксид водорода, (ошибочно) так называемые аддукт является окислитель но высвобождение при комнатной температуре в присутствии катализаторов происходит контролируемым образом, поэтому соединение подходит в качестве безопасного заменителя нестабильного водного раствора пероксида водорода. Из-за тенденции к термическому разложению, которое ускоряется при температуре выше 82 ° C,[5] его нельзя нагревать выше 60 ° C, особенно в чистом виде.
Растворимость коммерческих образцов колеблется от 0,05 г / мл.[6] до более 0,6 г / мл.[7]
Приложения
Дезинфицирующее и отбеливающее средство
Перекись водорода - мочевина в основном используется в качестве дезинфицирующего и отбеливающего средства в косметике и фармацевтике.[2] В качестве лекарственного средства это соединение используется в некоторых препаратах для лечения отбеливание зубов.[2][8][9] Он также используется для снятия незначительного воспаления десен, поверхностей слизистой оболочки полости рта и губ, включая стоматит и раздражение зубов,[10] и для эмульгирования и диспергирования ушная сера.[нужна цитата ]
Пероксид карбамида также подходит в качестве дезинфицирующего средства, например для уничтожения микробов на поверхности контактных линз или в качестве антисептика для жидкости для полоскания рта, ушные капли или для поверхностных ран и язвы.
Реагент в органическом синтезе
В лаборатории он используется как более простая в использовании замена пероксид водорода.[3][11][12] Доказано, что он является стабильным, простым в обращении и эффективным окислителем, которым легко управлять путем подходящего выбора условий реакции. Он доставляет продукты окисления экологически безопасным способом и часто с высокими выходами, особенно в присутствии органических катализаторов, таких как СНГ-бутендиовый ангидрид[13] или неорганические катализаторы, такие как вольфрамат натрия.[14]

Он избирательно превращает тиолы в дисульфиды,[13] вторичные спирты в кетоны,[14] сульфиды в сульфоксиды и сульфоны,[15] нитрилы в амиды,[15][16] N-гетероциклы в оксиды аминов.[15][17]

Гидроксибензальдегид превращаются в дигидроксибензолы (Реакция Дакина )[15][18][нужен лучший источник ] и дает в подходящих условиях соответствующие бензойные кислоты.[18]
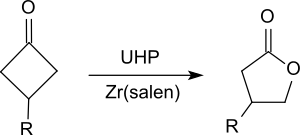
Он окисляет кетоны до сложных эфиров, в частности циклических кетонов, таких как замещенные циклогексаноны.[19] или циклобутаноны[20] дать лактоны (Окисление Байера-Виллигера ).
Эпоксидирование различных алкенов в присутствии бензонитрила дает оксираны с выходами от 79 до 96%.[21]
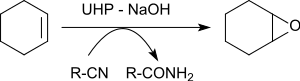
Атом кислорода, перенесенный на алкен, происходит от пероксоимидной кислоты, образующейся промежуточно из бензонитрила. Полученная имидовая кислота таутомеризуется в бензамид.
Безопасность
Соединение действует как сильный окислитель и может вызвать раздражение кожи и серьезные повреждения глаз.[22]
Смотрите также
Рекомендации
- ^ а б С.-С. Лу, Э.У. Хьюз, П.А. Giguère (1941), "Кристаллическая структура соединения присоединения мочевины к перекиси водорода CO (NH2)2 ЧАС2О2", Варенье. Chem. Soc., 63 (6), стр. 1507–1513, Дои:10.1021 / ja01851a007CS1 maint: несколько имен: список авторов (связь)
- ^ а б c Харальд Якоб, Стефан Лейнингер, Томас Леманн, Сильвия Якоби, Свен Гутворт. «Пероксосоединения неорганические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a19_177.pub2.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Ю, Лэй; Мэн, Бо; Хуан, Сиань (2008). «Комплекс мочевины-пероксида водорода: селективный окислитель в синтезе 2-фенилселенил-1,3-бутадиенов». Синтетические коммуникации. 38 (18): 3142. Дои:10.1080/00397910802109224. S2CID 98323467.
- ^ Fritchie, Jr., C.J .; Макмаллан, Р. К. (1981). "Нейтронографическое исследование комплекса мочевина: пероксид водорода 1: 1 при 81 K". Acta Crystallographica Раздел B. 37 (5): 1086. Дои:10.1107 / S0567740881005116.
- ^ Х. Хини, Ф. Кардона, А. Готи, А.Л. Фредерик (2013). «Перекись водорода-Мочевина». Энциклопедия реагентов для органического синтеза. Энциклопедия реагентов для органического синтеза E-EROS. Дои:10.1002 / 047084289X.rh047.pub3. ISBN 978-0471936237.CS1 maint: несколько имен: список авторов (связь)
- ^ Спецификация Sigma-Aldrich
- ^ Паспорт химиката
- ^ Мохлис, Г. Р .; Matis, B.A .; Cochran, M. A .; Эккерт, Г. Дж. (2000). «Клиническая оценка отбеливающих агентов на основе перекиси карбамида и перекиси водорода при дневном использовании». Журнал Американской стоматологической ассоциации. 131 (9): 1269–77. Дои:10.14219 / jada.archive.2000.0380. PMID 10986827. Архивировано из оригинал 23 февраля 2013 г.
- ^ Отбеливание зубов В архиве 2008-03-17 на Wayback Machine от UMD Нью-Джерси интернет сайт
- ^ Центр интегративной медицины: перекись карбамида от Медицинский центр Университета Мэриленда интернет сайт В архиве 18 октября 2007 г. Wayback Machine
- ^ Varma, Rajender S .; Найкер, Каннан П. (1999). «Комплекс мочевины-перекиси водорода: протоколы твердого окисления для гидроксилированных альдегидов и кетонов (реакция Дакина), нитрилов, сульфидов и гетероциклов азота». Органические буквы. 1 (2): 189. Дои:10.1021 / ol990522n.
- ^ Гарри Хини, Франческа Кардона, Андреа Готи, Энциклопедия реагентов для органического синтеза «Перекись водорода – мочевина», 2008 г. Дои:10.1002 / 047084289X.rh047.pub2
- ^ а б Б. Карами, М. Монтазерозохори, М. Х. Хабиби (2005 г.), «Окисление тиолов до соответствующих дисульфидов мочевиной и перекисью водорода (UHP) с участием малеинового ангидрида в качестве медиатора» (PDF), Молекулы (на немецком), 10 (10), стр. 1358–1363, Дои:10.3390/10101385, ЧВК 6147623, PMID 18007530CS1 maint: несколько имен: список авторов (связь)
- ^ а б М. Лукасевич; Д. Богдал; Я. Пеличовски. «Окисление спиртов в микроволновой печи с использованием перекиси водорода мочевины». 8-я Международная электронная конференция по синтетической органической химии. ECSOC-8. Получено 2016-05-10.
- ^ а б c d Р.С. Варма, К. Найкер, «Комплекс мочевины и перекиси водорода: твердотельные окислительные протоколы для гидроксилированных альдегидов и кетонов (реакция Дакина), нитрилов, сульфидов и гетероциклов азота», Орг. Lett. (на немецком), 1 (2), стр. 189–191, Дои:10.1021 / ol990522n
- ^ США 0
- ^ Д. Ронг, В.А. Филлипс, Р. Рубио, М.А.Кастро, Р.Т. Рулевая рубка, «Безопасный, удобный и эффективный метод получения гетероциклических N-оксидов с использованием мочевины и пероксида водорода», Tetrahedron Lett. (на немецком), 49 (48), стр. 6933–6935, Дои:10.1016 / j.tetlet.2008.09.124CS1 maint: несколько имен: список авторов (связь)
- ^ а б Х. Хини, А.Дж. Newbold (2001), "Окисление ароматических альдегидов монопероксифталатом магния и пероксидом мочевины-водорода", Tetrahedron Lett. (на немецком), 42 (37), стр. 6607–6609, Дои:10.1016 / S0040-4039 (01) 01332-6
- ^ МОЙ. Риос, Э. Салазар, Х. Ф. Оливо (2007), «Окисление Байера-Виллигера замещенных циклогексанонов посредством пергидролиза, опосредованного липазой, с использованием пероксида мочевины и водорода в этилацетате», Green Chem. (на немецком), 9 (5), стр. 459–462, Дои:10.1039 / B618175ACS1 maint: несколько имен: список авторов (связь)
- ^ А. Ватанабе, Т. Учида, К. Ито, Т. Кацуки (2002), «Высокоэнантиоселективное окисление Байера-Виллигера с использованием комплекса Zr (салена) в качестве катализатора», Tetrahedron Lett. (на немецком), 43 (25), стр. 4481–4485, Дои:10.1016 / S0040-4039 (02) 00831-6CS1 maint: несколько имен: список авторов (связь)
- ^ Л. Джи, Ю.-Н. Ван, Ч. Цянь, X.-Z. Чен (2013), "Нитрильное эпоксидирование алкена с помощью мочевины-пероксида водорода (UHP)", Synth. Commun. (на немецком), 43 (16), стр. 2256–2264, Дои:10.1080/00397911.2012.699578, S2CID 93770740CS1 maint: несколько имен: список авторов (связь)
- ^
внешняя ссылка
- «Аддукт пероксида водорода и мочевины, UHP». Портал органической химии.
- «Монография по пероксиду карбамида». Drugs.com.