Интервенционное обезболивание - Interventional pain management - Wikipedia
Интервенционное обезболивание или же интервенционное обезболивающее это медицинская специальность, которая лечит боль с помощью инвазивных вмешательств, таких как инъекции в фасеточные суставы, нервные блоки (прерывание потока болевых сигналов по определенным путям нервной системы), нейроаугментация (в том числе стимуляция спинного мозга и стимуляция периферических нервов ), вертебропластика, кифопластика, нуклеопластика, эндоскопический дискэктомия и имплантируемые системы доставки лекарств.[1][2]
История
Первые попытки интервенционного обезболивания восходят к истокам региональная анальгезия и нервные блоки, и постепенно превратился в отдельную специальность. Туффер описал первую терапевтическую блокаду нервов для снятия боли в 1899 году. Фон Газа разработал диагностическую блокаду в лечении боли, используя новокаин для определения болевых путей. В число современных авторов входят Боника, Винни, Радж, Рац, Богдук и другие.[3] Термин «интервенционное обезболивание» впервые был использован специалистом по обезболиванию. Стивен Д. Уолдман в 1996 г. для определения формирующейся специальности.[1][4] Специализация интервенционного обезболивания получила специальное обозначение в США. Национальный единый биллинговый комитет разрешить практикующим специалистам выставлять счета на федеральные программы здравоохранения, включая Medicare и Медикейд.[5] Врачи, практикующие интервенционное лечение боли, представлены множеством организаций, занимающихся лечением боли, включая Общество практического лечения боли и Американское общество интервенционных терапевтов.[2][6]
Радиация
Лучевая терапия используется, когда медикаментозное лечение не позволяет контролировать боль растущей опухоли, например, при метастазах в кости (чаще всего), проникновении в мягкие ткани или сдавлении чувствительных нервов. Часто низких доз достаточно для обезболивания, которое, как считается, происходит из-за снижения давления или, возможно, вмешательства в выработку опухолью болеутоляющих химикатов.[7] Радиофармацевтические препараты которые нацелены на специфические опухоли, использовались для лечения боли при метастатических заболеваниях. Облегчение может наступить в течение недели после лечения и длиться от двух до четырех месяцев.[8]
Невролитический блок

А нейролитический блок преднамеренное повреждение нерва химическими веществами (в этом случае процедура называется "невролиз ") или физических агентов, таких как замораживание или нагревание ("нейротомия ").[9] Эти вмешательства вызывают дегенерацию нервных волокон и временное нарушение передачи болевых сигналов. В этих процедурах тонкий защитный слой вокруг нервного волокна, базальная пластинка, сохраняется так, что по мере отрастания поврежденного волокна оно перемещается по своей трубке базальной пластинки и соединяется с правильным свободным концом, и функция может быть восстановлена. Хирургическое перерезание нерва перерезает эти трубки базальной пластинки, и без них, чтобы направить отрастающие волокна к их потерянным связям, было бы болезненно. неврома или же деафферентационная боль может развиться. Вот почему нейролитик предпочтительнее хирургического блока.[10]
Рассечение или разрушение нервной ткани

Хирургическое разрезание или разрушение периферийный или же центральный нервная ткань сейчас редко используется для лечения боли.[8] Процедуры включают неврэктомию, хордотомию, повреждение зоны входа заднего корня и цингулотомию.
Нейрэктомия включает перерезание нерва и (редко) используется у пациентов с короткой продолжительностью жизни, которые не подходят для медикаментозной терапии из-за неэффективности или непереносимости. В дорсальный корешок или же ганглий дорзального корня (которые несут в основном сенсорные сигналы) могут быть целенаправленными (так называемые ризотомия ); с ганглием дорсального корешка, возможно, более эффективной мишенью, поскольку некоторые сенсорные волокна входят в спинной мозг из ганглия задних корешков через вентральный (мотор) корень, и они не будут прерваны нейрэктомией дорзального корешка. Поскольку нервы часто несут как сенсорные, так и моторные волокна, двигательная недостаточность является возможным побочным эффектом нейрэктомии. Обычным результатом этой процедуры является «деафферентационная боль», когда через 6–9 месяцев после операции боль возвращается с большей интенсивностью.[11]
Кордотомия включает в себя разрезание спиноталамические тракты, которые проходят вверх по переднему / боковому (переднебоковому) квадранту спинного мозга, передавая в мозг сигналы тепла и боли.[11]
Опухоль Панкоста Боль эффективно лечится поражением зоны входа в спинной корешок (DREZ) - повреждением области спинного мозга, где сигналы периферической боли передаются волокнам спинного мозга. Это серьезная операция, сопряженная с риском серьезных неврологических побочных эффектов.[11]
Цингулотомия включает в себя перерезание волокон, которые передают сигналы непосредственно от поясная извилина к энторинальная кора в мозгу. Уменьшает неприятные ощущения от боли (не влияя на ее интенсивность), но может иметь познавательный побочные эффекты.[11]
Интратекальная инфузия
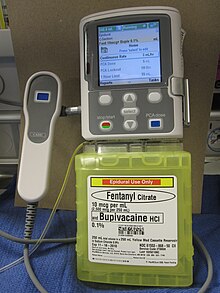
Доставка опиоидов, таких как морфий, гидроморфон, фентанил, суфентанил или же меперидин непосредственно в субарахноидальную полость (пространство между спинным мозгом внутренняя водонепроницаемая оболочка и его внешние защитные оболочки) обеспечивает усиленную анальгезию с уменьшенными системными побочными эффектами и снижает уровень боли в трудноизлечимых случаях. Анксиолитик клонидин, или неопиоидный анальгетик зиконотид, и местные анестетики, такие как бупивакаин, ропивакаин или же тетракаин может также вводиться вместе с опиоидом.[8][11]
Эпидуральная инфузия
Самая внешняя защитная оболочка, окружающая спинной мозг, называется твёрдая мозговая оболочка. Между этим и окружающим позвонки это эпидуральное пространство, наполненный соединительной тканью, жиром и кровеносными сосудами и пересекаемый спинной нерв корни. А катетер может быть вставлен в это пространство на срок от трех до шести месяцев для введения анестетиков или анальгетиков. Линию, по которой переносится лекарство, можно продеть под кожу, чтобы она выходила впереди пациента, этот процесс называется туннелированием. Это рекомендуется при длительном использовании, чтобы снизить вероятность попадания инфекции в эпидуральное пространство в месте выхода.[8]
Стимуляция спинного мозга
Электростимуляция спинные колонны спинного мозга может производить обезболивание. Сначала имплантируются отведения, руководствуясь отчетом пациента и рентгеноскопия, и генератор носят снаружи в течение нескольких дней для оценки эффективности. Если боль уменьшилась более чем наполовину, терапия считается подходящей. Небольшой карман прорезается в ткани под кожей верхней части ягодиц, грудной клетки или живота, и провода продеваются под кожей от места стимуляции к карману, где они прикрепляются к плотно прилегающему генератору.[11] Кажется, с невропатический и ишемический боль, чем ноцицептивная боль, и не часто используется при лечении боли при раке.[12]
Глубокая стимуляция мозга
Постоянная электрическая стимуляция структур глубоко внутри мозга - периакведуктальный серый и перивентрикулярный серый при ноцицептивной боли и внутренняя капсула, вентрально заднебоковое ядро и вентральное заднемедиальное ядро при нейропатической боли - дала впечатляющие результаты у некоторых пациентов, но результаты различаются, и важен правильный выбор пациентов. Одно исследование[13] из семнадцати пациентов с трудноизлечимой болью при раке обнаружили, что тринадцать были практически безболезненными и только четверым потребовались опиоидные анальгетики при выписке из больницы после вмешательства. Большинство из них действительно прибегали к опиоидам, обычно в последние несколько недель жизни.[12]
Гипофизэктомия
Гипофизэктомия это разрушение гипофиз, и успешно использовался при метастатической боли при раке груди и простаты.[11]
Рекомендации
- ^ а б Винни А.П. Предисловие. В: Интервенционное лечение боли SD Waldman и AP Winnie (ред.) WB Saunders 1996.
- ^ а б Веб-сайт Американского общества терапевтов по лечению боли (ASIPP.org)
- ^ Manchikanti, L .; Boswell, M. V .; Raj, P.P .; Рац, Г. Б. (2003). «Эволюция интервенционного обезболивания». Врач боли. 6 (4): 485–494. PMID 16871301.
- ^ Атлас интервенционного лечения боли 3-е изд. S.D. Waldman (редактор) Elsevier Philadelphia 2010.
- ^ Веб-сайт Национального комитета по претензиям в отношении униформы (nucc.org)
- ^ Сайт Общества по управлению практикой боли (sppm.org)
- ^ Хоскин П.Дж. Лучевая терапия. В: Sykes N, Bennett MI и Yuan C-S. Клиническое лечение боли: боль при раке. 2-е изд. Лондон: Ходдер Арнольд; 2008 г. ISBN 978-0-340-94007-5. п. 251–55.
- ^ а б c d Atallah JN. Управление болью при раке. В: Вадивелу Н., Урман Р.Д., Хайнс Р.Л. Основы обезболивания. Нью-Йорк: Спрингер; 2011 г. DOI: 10.1007 / 978-0-387-87579-8. ISBN 978-0-387-87578-1. п. 597–628.
- ^ Скотт Фишман; Джейн Баллантайн; Джеймс П. Ратмелл (январь 2010 г.). Управление болью Боники. Липпинкотт Уильямс и Уилкинс. п. 1458. ISBN 978-0-7817-6827-6. Получено 15 августа 2013.
- ^ Уильямс Дж. Э. Нервные блоки: химические и физические нейролитические агенты. В: Sykes N, Bennett MI и Yuan C-S. Клиническое лечение боли: боль при раке. 2-е изд. Лондон: Ходдер Арнольд; 2008 г. ISBN 978-0-340-94007-5. п. 225–35.
- ^ а б c d е ж грамм Косгроув, Массачусетс, Таунс, Д.К., Фанчулло, Г.Дж., Кайе, А.Д. Интервенционное обезболивание. В: Вадивелу Н., Урман Р.Д., Хайнс Р.Л. Основы обезболивания. Нью-Йорк: Спрингер; 2011 г. DOI: 10.1007 / 978-0-387-87579-8. ISBN 978-0-387-87578-1. п. 237–299.
- ^ а б Джонсон М.И., Оксберри С.Г. и Робб К. Обезболивание, вызванное стимуляцией. В: Sykes N, Bennett MI и Yuan C-S. Клиническое лечение боли: боль при раке. 2-е изд. Лондон: Ходдер Арнольд; 2008 г. ISBN 978-0-340-94007-5. п. 235–250.
- ^ Янг Р.Ф. и Брехнер Т. Электрическая стимуляция мозга для облегчения неизлечимой боли, вызванной раком. Рак. 1986;57:1266–72. Дои:10.1002 / 1097-0142 (19860315) 57: 6 <1266 :: aid-cncr2820570634> 3.0.co; 2-кв.. PMID 3484665.
