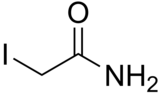
Йодацетамид - Iodoacetamide
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 2-йодацетамид | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.005.119 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| C2ЧАС4яNО | |
| Молярная масса | 184.964 г · моль−1 |
| Внешность | белые кристаллы (желтый цвет указывает на присутствие йода) |
| Температура плавления | 94 ° С (201 ° F, 367 К) |
| Опасности | |
| Паспорт безопасности | Паспорт безопасности материалов 1, Паспорт безопасности материалов 2 |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
2-йодацетамид является алкилирующий агент используется для пептид картографические цели. Его действия аналогичны действиям йодацетат. Обычно он используется для ковалентного связывания с тиол группа цистеин поэтому белок не может образовывать дисульфидные связи.[1][2] Также используется в убиквитин исследования в качестве ингибитора ферменты деубиквитиназы (DUB), поскольку он алкилирует остатки цистеина в активном центре DUB.
Ингибитор пептидазы
Йодацетамид является необратимым ингибитором всех цистеинпептидаз, причем механизм ингибирования происходит за счет алкилирования каталитического остатка цистеина (см. Схему). По сравнению с его кислотным производным, йодацетатом, йодацетамид реагирует значительно быстрее. Это наблюдение противоречит стандартной химической реакционной способности, однако наличие благоприятного взаимодействия между положительным ионом имидазолия каталитического гистидина и отрицательно заряженной карбоксильной группой йодацетата является причиной повышенной относительной активности йодацетамида.[3]

Масс-спектрометрия белков
Он обычно используется при пробоподготовке для секвенирования de novo (пептид) с масс-спектрометрия белков, но недавние критики предлагают избегать его использования. [4]
Рекомендации
- ^ Смайт CV (1936). «Реакции йодацетата и йодацетамида с различными сульфгидрильными группами, с уреазой и дрожжевыми препаратами». J. Biol. Chem. 114 (3): 601–12.
- ^ Энсон М.Л. (1940). «Реакции йода и йодацетамида с нативным яичным альбумином». J. Gen. Physiol. 23 (3): 321–31. Дои:10.1085 / jgp.23.3.321. ЧВК 2237930. PMID 19873158.
- ^ Полгар, Л. (1979). «Влияние изотопа дейтерия на ацилирование папаина. Доказательства отсутствия общего основного катализа и для ферментативной группы. Взаимодействие». Евро. J. Biochem. 98 (2): 369–374. Дои:10.1111 / j.1432-1033.1979.tb13196.x. PMID 488108.
- ^ Мюллер (2017). «Систематическая оценка восстановления белков и алкилирования выявляет массивные неспецифические побочные эффекты йодсодержащих реагентов». Молекулярная и клеточная протеомика. 16 (7): 1173–1187. Дои:10.1074 / mcp.M116.064048. ЧВК 5500753. PMID 28539326.

