Масс-спектрометрия белков - Protein mass spectrometry

Масс-спектрометрия белков относится к применению масс-спектрометрии к изучению белки. Масс-спектрометрия - важный метод точного определения массы и характеристики белков, и для его многочисленных применений были разработаны различные методы и приборы. Его приложения включают идентификацию белков и их посттрансляционные модификации, выяснение белковых комплексов, их субъединиц и функциональных взаимодействий, а также глобальное измерение белков в протеомика. Его также можно использовать для локализации белков в различных органеллах и определения взаимодействия между различными белками, а также с липидами мембран.[1][2]
Два основных метода, используемых для ионизации белка в масс-спектрометрии: ионизация электрораспылением (ESI) и матричная лазерная десорбция / ионизация (МАЛДИ). Эти методы ионизации используются вместе с масс-анализаторами, такими как тандемная масс-спектрометрия. Как правило, белок анализируется либо в "низходящий «подход, при котором белки анализируются в неповрежденном виде, или»вверх дном «подход, при котором белок сначала расщепляется на фрагменты. Иногда может использоваться промежуточный подход« середины вниз », в котором анализируются более крупные пептидные фрагменты.
История
Применение масс-спектрометрии для изучения белков стало популярным в 1980-х годах после разработки МАЛДИ и ESI. Эти методы ионизации сыграли важную роль в характеристике белков. (MALDI) Матричная лазерная десорбционная ионизация была изобретена в конце 80-х Франц Хилленкамп и Майкл Карас.[3] Хилленкамп, Карас и их коллеги-исследователи смогли ионизировать аминокислоту. аланин путем смешивания с аминокислотой триптофан и облучали импульсным лазером 266 нм.[3] Несмотря на важность, прорыв произошел только в 1987 году. В 1987 году Коичи Танака использовали метод «ультратонкий металл плюс жидкая матрица» и ионизированные биомолекулы размером 34 472 Да протеина карбоксипептидазы-A.[4]
В 1968 г. Малькольм Доул сообщили о первом применении ионизации электроспреем с масс-спектрометрией. Примерно в то же время популяризовался МАЛДИ, Джон Беннетт Фенн был назван за развитие ионизации электрораспылением.[5][6] Коичи Танака получил награду 2002 г. Нобелевская премия по химии вместе с Джоном Фенном и Курт Вютрих «За разработку методов идентификации и структурного анализа биологических макромолекул».[7] Эти методы ионизации значительно облегчили изучение белков с помощью масс-спектрометрии. Следовательно, масс-спектрометрия белков теперь играет ведущую роль в характеристике белков.
Методы и подходы
Методы
Масс-спектрометрия белков требует, чтобы белки в растворе или твердом состоянии были превращены в ионизированную форму в газовой фазе, прежде чем они будут введены и ускорены в электрическом или магнитном поле для анализа. Два основных метода ионизации белков: ионизация электрораспылением (ESI) и матричная лазерная десорбция / ионизация (МАЛДИ). В электроспрее ионы создаются из белков в растворе, и это позволяет хрупким молекулам ионизироваться в целости и сохранности, иногда сохраняя нековалентные взаимодействия. В MALDI белки встроены в матрицу, обычно в твердой форме, а ионы создаются импульсами лазерного света. Электрораспыление производит больше многозарядных ионов, чем MALDI, что позволяет измерять белки с высокой массой и улучшать фрагментацию для идентификации, в то время как MALDI работает быстро и с меньшей вероятностью подвержен влиянию загрязнителей, буферов и добавок.[8]
Анализ массы цельного белка в основном проводится с использованием либо время полета (TOF) MS, или Ионный циклотронный резонанс с преобразованием Фурье (FT-ICR). Эти два типа инструментов здесь предпочтительны из-за их широкого диапазона масс, а в случае FT-ICR, его высокой точности измерения массы. Ионизация белка электрораспылением часто приводит к образованию нескольких заряженных частиц 800 < м / з <2000, и результирующий спектр можно деконволютировать для определения средней массы белка с точностью до 50 ppm или лучше, используя TOF или ионная ловушка инструменты.
Массовый анализ протеолитических пептидов - популярный метод характеристики белков, поскольку для характеристики можно использовать более дешевые конструкции инструментов. Кроме того, подготовка образцов упрощается, когда целые белки перевариваются на более мелкие пептидные фрагменты. Наиболее широко используемым инструментом для массового анализа пептидов являются инструменты MALDI-TOF, поскольку они позволяют получать отпечатки пальцев пептидной массы (PMF) в высоком темпе (1 PMF можно проанализировать примерно за 10 секунд). Многоступенчатый квадрупольный времяпролетный и квадрупольная ионная ловушка также найти применение в этом приложении.

Тандемная масс-спектрометрия (МС / МС) используется для измерения спектров фрагментации и идентификации белков с высокой скоростью и точностью. Диссоциация, вызванная столкновением, используется в основных приложениях для создания набора фрагментов из определенного пептидного иона. Процесс фрагментации в первую очередь приводит к образованию продуктов расщепления, которые разрываются по пептидным связям. Из-за этой простоты фрагментации можно использовать наблюдаемые массы фрагментов для сопоставления с базой данных предсказанных масс для одной из многих заданных пептидных последовательностей. Тандемная МС ионов цельного белка была недавно исследована с использованием диссоциация электронного захвата и продемонстрировал обширную информацию о последовательности в принципе, но это не является обычной практикой.
Подходы
В соответствии с характеристиками и диапазоном масс доступных масс-спектрометров для характеристики белков используются два подхода. В первом случае интактные белки ионизируются любым из двух описанных выше методов, а затем вводятся в масс-анализатор. Этот подход называется "низходящий «стратегия анализа белков, поскольку она включает в себя начало всей массы, а затем ее разделение. Однако подход« сверху вниз »в основном ограничивается низкопроизводительными исследованиями отдельных белков из-за проблем, связанных с обработкой целых белков, их неоднородностью и сложностью. их анализов.[8]
Во втором подходе, именуемом "вверх дном "РС, белки ферментативно расщепляются на более мелкие пептиды используя протеаза Такие как трипсин. Впоследствии эти пептиды вводятся в масс-спектрометр и идентифицируются дактилоскопия пептидной массы или же тандемная масс-спектрометрия. Следовательно, этот подход использует идентификацию на уровне пептидов, чтобы сделать вывод о существовании белков, собранных вместе с de novo повторное обнаружение.[9] Более мелкие и более однородные фрагменты легче анализировать, чем интактные белки, и их также можно определить с высокой точностью, поэтому этот подход «снизу вверх» является предпочтительным методом исследований в протеомике. Еще один подход, который начинает применяться, - это промежуточный подход «середины вниз», при котором анализируются протеолитические пептиды, размер которых превышает размер типичных триптических пептидов.[8]
Фракционирование белков и пептидов
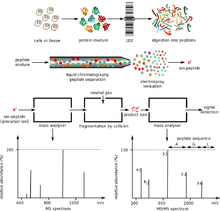
Представляющие интерес белки обычно являются частью сложной смеси множества белков и молекул, сосуществующих в биологической среде. Это создает две важные проблемы. Во-первых, два метода ионизации, используемые для больших молекул, работают хорошо только тогда, когда смесь содержит примерно равные количества материала, тогда как в биологических образцах разные белки, как правило, присутствуют в сильно различающихся количествах. Если такую смесь ионизировать с помощью электроспрей или же МАЛДИ, более многочисленные виды имеют тенденцию «топить» или подавлять сигналы от менее массовых. Во-вторых, масс-спектр сложной смеси очень сложно интерпретировать из-за огромного количества компонентов смеси. Это усугубляется тем фактом, что ферментативное расщепление белка приводит к образованию большого количества пептидных продуктов.
В свете этих проблем для разделения белков широко используются методы одно- и двумерного гель-электрофореза и высокоэффективной жидкостной хроматографии. Первый метод фракционирует целые белки через двумерный гель-электрофорез. Первое измерение 2D-геля - это изоэлектрическая фокусировка (IEF). В этом измерении белок разделен его изоэлектрической точкой (pI), а вторым измерением является электрофорез в SDS-полиакриламидном геле (SDS-PAGE). Этот размер разделяет белок в соответствии с его молекулярной массой.[10] По завершении этого этапа происходит расщепление в геле. В некоторых ситуациях может потребоваться сочетание обоих этих методов. Пятна геля, обнаруженные на 2D-геле, обычно связаны с одним белком. Если требуется идентичность белка, обычно метод переваривание в геле Применяется там, где интересующее белковое пятно иссекается и протеолитически переваривается. Массы пептидов, полученные в результате переваривания, можно определить масс-спектрометрией с использованием дактилоскопия пептидной массы. Если эта информация не позволяет однозначно идентифицировать белок, его пептиды могут быть подвергнуты тандемная масс-спектрометрия за de novo последовательность действий. Небольшие изменения массы и заряда можно обнаружить с помощью 2D-PAGE. Недостатками этого метода являются его небольшой динамический диапазон по сравнению с другими методами, некоторые белки по-прежнему трудно разделить из-за их кислотности, основности, гидрофобности и размера (слишком большого или слишком малого).[11]
Второй способ, высокоэффективная жидкостная хроматография используется для фракционирования пептидов после ферментативного переваривания. Характеристика белковых смесей с помощью ВЭЖХ / МС также называется протеомикой дробовика и MuDPIT (технология многомерной идентификации белков). Пептидную смесь, полученную в результате переваривания белковой смеси, фракционируют с помощью одной или двух стадий жидкостной хроматографии. Элюент со стадии хроматографии может быть либо непосредственно введен в масс-спектрометр посредством ионизации электрораспылением, либо нанесен на серию небольших пятен для последующего масс-анализа с использованием MALDI.
Приложения
Идентификация белков
Есть два основных способа использования МС для идентификации белков. Снятие пептидных масс использует массы протеолитических пептидов в качестве входных данных для поиска в базе данных предсказанных масс, которые могут возникнуть в результате переваривания списка известных белков. Если последовательность белка в справочном списке дает значительное количество предсказанных масс, которые соответствуют экспериментальным значениям, есть некоторые свидетельства того, что этот белок присутствовал в исходном образце. Таким образом, этапы очистки ограничивают производительность метода массового снятия отпечатков пептидов. Фингерпринт пептидных масс может быть получен с помощью МС / МС.[9]
МС также является предпочтительным методом для идентификации посттрансляционные модификации в белках, поскольку это более выгодно, чем другие подходы, такие как методы на основе антител.[1]
De novo (пептид) секвенирование
De novo секвенирование пептидов для масс-спектрометрии обычно проводят без предварительного знания аминокислотной последовательности. Это процесс присвоения аминокислот из пептид фрагмент массы из белок. De novo секвенирование оказалось успешным для подтверждения и расширения результатов поиска в базе данных.
В качестве de novo секвенирование основано на массе, и некоторые аминокислоты имеют идентичные массы (например, лейцин и изолейцин ) точное ручное определение последовательности может быть затруднено. Следовательно, может потребоваться использование приложения поиска гомологии последовательностей для работы в тандеме между поиском в базе данных и de novo последовательность для устранения этого внутреннего ограничения.
Преимущество поиска в базе данных состоит в том, что они быстро определяют последовательности, если они уже задокументированы в базе данных. Другие неотъемлемые ограничения поиска в базе данных включают модификации / мутации последовательностей (некоторые поиски в базе данных не учитывают адекватным образом изменения в «задокументированной» последовательности, поэтому может быть упущена ценная информация), неизвестность (если последовательность не задокументирована, она не будет найдена. ), ложных срабатываний, неполных и поврежденных данных.[12]
Аннотированный пептидная спектральная библиотека также можно использовать в качестве эталона для идентификации белков / пептидов. Он предлагает уникальную силу сокращенного пространства поиска и повышенной специфичности. Ограничения включают в себя то, что спектры, не включенные в библиотеку, не будут идентифицированы, спектры, собранные с разных типов масс-спектрометров, могут иметь довольно разные характеристики, а эталонные спектры в библиотеке могут содержать шумовые пики, которые могут привести к ложноположительной идентификации.[13] Был описан ряд различных алгоритмических подходов для идентификации пептидов и белков из тандемная масс-спектрометрия (МС / МС), пептид de novo секвенирование и поиск на основе тегов последовательности.[14]
Количественное определение белка

Множественные методы позволяют проводить количественное определение белков с помощью масс-спектрометрии (количественная протеомика ),[15] а недавние достижения позволили количественно оценить тысячи белков в отдельных клетках.[16][17] Обычно стабильные (например, нерадиоактивные) тяжелее изотопы из углерод (13C) или азот (15N) включены в один образец, в то время как другой помечен соответствующими легкими изотопами (например, 12C и 14N).[18] Два образца смешивают перед анализом. Пептиды, полученные из разных образцов, можно различить по разнице в массе. Отношение интенсивностей их пиков соответствует относительному содержанию пептидов (и белков). Наиболее популярные методы маркировки изотопов: СИЛАК (мечение стабильных изотопов аминокислотами в культуре клеток), катализируемое трипсином 18O маркировка, ICAT (изотопно-кодированная аффинная маркировка), iTRAQ (изобарические метки для относительного и абсолютного количественного определения).[19] «Полуколичественная» масс-спектрометрия может выполняться без маркировки образцов.[20] Обычно это делается с помощью анализа MALDI (в линейном режиме). Интенсивность пика или площадь пика отдельных молекул (обычно белков) здесь коррелирует с количеством белка в образце. Однако индивидуальный сигнал зависит от первичной структуры белка, сложности образца и настроек прибора. В других типах количественной масс-спектрометрии «без метки» используются спектральные подсчеты (или количества пептидов) расщепленных белков в качестве средства для определения относительных количеств белка.[12]
Определение структуры белка
Характеристики, указывающие на 3-х мерная структура белков можно исследовать с помощью масс-спектрометрии различными способами.[21] Используя химическое сшивание для соединения частей белка, которые расположены близко в пространстве, но далеко друг от друга по порядку, можно получить информацию об общей структуре. Следуя обмен амидными протонами с дейтерий из растворителя можно исследовать доступность растворителя для различных частей белка.[22] Водород-дейтериевый обмен масс-спектрометрия используется для изучения белков и их конформаций более 20 лет. Этот тип структурного анализа белков может быть подходящим для белков, которые сложно использовать другими структурными методами.[23] Еще одно интересное направление исследований структуры белков - ковалентное мечение, индуцированное лазером. В этом методе открытые для растворителя участки белка модифицируются гидроксильными радикалами. Его комбинация с быстрым перемешиванием использовалась в исследованиях сворачивания белков.[24]
Протеогеномика
В том, что сейчас обычно называют протеогеномика, пептиды, идентифицированные с масс-спектрометрии используются для улучшения аннотаций генов (например, стартовых сайтов генов) и аннотаций белков. Параллельный анализ генома и протеома облегчает обнаружение посттрансляционных модификаций и протеолитических событий,[25] особенно при сравнении нескольких видов.[26]
Рекомендации
- ^ а б Юрген Кокс и Маттиас Манн (июль 2011 г.). «Количественная протеомика высокого разрешения для системной биологии, управляемой данными». Ежегодный обзор биохимии. 80: 273–299. Дои:10.1146 / annurev-biochem-061308-093216. PMID 21548781.CS1 maint: использует параметр авторов (ссылка на сайт) - через Annual Reviews (требуется подписка)
- ^ Нельсон П. Баррера и Кэрол В. Робинсон (июль 2011 г.). «Достижения в масс-спектрометрии мембранных белков: от индивидуальных белков до интактных комплексов». Ежегодный обзор биохимии. 80: 247–71. Дои:10.1146 / annurev-biochem-062309-093307. HDL:10533/135572. PMID 21548785.CS1 maint: использует параметр авторов (ссылка на сайт) - через Annual Reviews (требуется подписка)
- ^ а б Карась, М .; Бахманн, Д .; Хилленкамп, Ф. (1985). «Влияние длины волны в ультрафиолетовой лазерной десорбционной масс-спектрометрии органических молекул с высоким уровнем излучения». Аналитическая химия. 57 (14): 2935–9. Дои:10.1021 / ac00291a042.
- ^ Карась, М .; Бахманн, Д .; Bahr, U .; Хилленкамп, Ф. (1987). «Матричная ультрафиолетовая лазерная десорбция нелетучих соединений». Международный журнал масс-спектрометрии и ионных процессов. 78: 53–68. Bibcode:1987IJMSI..78 ... 53K. Дои:10.1016/0168-1176(87)87041-6.
- ^ Доул М., Мак Л.Л., Хайнс Р.Л., Мобли Р.К., Фергюсон Л.Д., Алиса МБ (1968). «Молекулярные пучки макроионов». Журнал химической физики. 49 (5): 2240–2249. Bibcode:1968ЖЧФ..49.2240Д. Дои:10.1063/1.1670391.
- ^ Бирендра Н. Праманик; А.К. Гангули; Майкл Л. Гросс (28 февраля 2002 г.). Прикладная масс-спектрометрия с электрораспылением: серия практической спектроскопии. CRC Press. С. 4–. ISBN 978-0-8247-4419-9.
- ^ "Пресс-релиз: Нобелевская премия по химии 2002 г.". Нобелевский фонд. 2002-10-09. Получено 2011-04-02.
- ^ а б c Чайт, Брайан Т. (2011). «Масс-спектрометрия в постгеномную эпоху». Анну Рев Биохим. 80: 239–46. Дои:10.1146 / аннурьев-биохим-110810-095744. PMID 21675917. - через Annual Reviews (требуется подписка)
- ^ а б Траугер, А. Суня; W. Webb; Г. Сюздак (2002). «Пептидно-белковый анализ с масс-спектрометрией». Спектроскопия. 16 (1): 15–28. Дои:10.1155/2002/320152.
- ^ В. Уэллс, Г. Ван и С. Дж. Бэк (2006). «Сравнительное исследование трех протеомных количественных методов, DIGE, cICAT и iTRAQ, с использованием 2D Gel- или LC-MALDI TOF / TOF». Журнал протеомных исследований. 5 (3): 651–658. CiteSeerX 10.1.1.156.5802. Дои:10.1021 / pr050405o. PMID 16512681.
- ^ Иссак, Дж. Халим и Т. Д. Винстра (2008). «Двумерный электрофорез в полиакриламидном геле (2D-PAGE): достижения и перспективы». Биотехнологии. 46 (5): 697–700. Дои:10.2144/000112823. PMID 18474047.
- ^ а б Брет, Купер, Дж. Фен и У. Гарретт (2010). «Относительное количественное определение белка без меток: статистика ошибок спектрального подсчета из девяти реплицируемых образцов MudPIT». Спектроскопия. 21 (9): 1534–1546. Дои:10.1016 / j.jasms.2010.05.001. PMID 20541435.
- ^ Августин, Скальберт, Л. Бреннан и О. Файн (2009). «Метаболомика на основе масс-спектрометрии: ограничения и рекомендации для будущего прогресса с особым упором на исследования в области питания». NCBI. 5 (4): 435–458. Дои:10.1007 / s11306-009-0168-0. ЧВК 2794347. PMID 20046865.
- ^ П. Эрнандес, М. Мюллер и Р. Д. Аппель (2006). «Автоматическая идентификация белков с помощью тандемной масс-спектрометрии: проблемы и стратегии». Обзоры масс-спектрометрии. 25 (2): 235–254. Bibcode:2006MSRv ... 25..235H. Дои:10.1002 / mas.20068. PMID 16284939.
- ^ Cravatt, Бенджамин Ф .; Саймон, Габриэль М .; Йетс III, Джон Р. (декабрь 2007 г.). «Биологическое влияние протеомики на основе масс-спектрометрии». Природа. 450 (7172): 991–1000. Дои:10.1038 / природа06525. ISSN 1476-4687. PMID 18075578. S2CID 205211923.
- ^ Славов, Николай (01.02.2021). «Анализ одноклеточного белка методом масс-спектрометрии». Современное мнение в области химической биологии. 60: 1–9. Дои:10.1016 / j.cbpa.2020.04.018. ISSN 1367-5931. PMID 32599342.
- ^ Славов, Николай (31.01.2020). «Открытие протеома в отдельных клетках». Наука. 367 (6477): 512–513. Дои:10.1126 / science.aaz6695. ISSN 0036-8075. ЧВК 7029782. PMID 32001644.
- ^ Снайдерс А.П., де Вос М.Г., Райт ПК (2005). «Новый подход к количественному определению и секвенированию пептидов на основе метаболического мечения 15N и 13C». J. Proteome Res. 4 (2): 578–85. Дои:10.1021 / pr0497733. PMID 15822937.
- ^ М. Мияги и К. С. Рао (2007). «Протеолитический 18Стратегии O-мечения для количественной протеомики ». Обзоры масс-спектрометрии. 26 (1): 121–136. Bibcode:2007MSRv ... 26..121M. Дои:10.1002 / mas.20116. PMID 17086517.
- ^ Хаккани А.С., Келли Дж. Ф., Станимирович ДБ (2008). «Количественное профилирование белков с помощью масс-спектрометрии с использованием протеомики без меток». Протоколы геномики. Методы молекулярной биологии. 439. С. 241–56. Дои:10.1007/978-1-59745-188-8_17. ISBN 978-1-58829-871-3. PMID 18370108.
- ^ З. Чжан; Д. Л. Смит (1994). «Исследование нековалентных структурных особенностей белков методом масс-спектрометрии». Обзоры масс-спектрометрии. 13 (5–6): 411–429. Bibcode:1994MSRv ... 13..411S. Дои:10.1002 / mas.1280130503.
- ^ Т. Э. Уэльс и Дж. Р. Энген (2006). «Водородообменная масс-спектрометрия для анализа динамики белков». Обзоры масс-спектрометрии. 25 (1): 158–170. Bibcode:2006MSRv ... 25..158Вт. Дои:10.1002 / mas.20064. PMID 16208684.
- ^ R.E. Якоб и Дж. Р. Энген (2012). "Масс-спектрометрия с водородным обменом: мы вышли из зыбучих песков?". Обзоры масс-спектрометрии. 23 (6): 1003–1010. Bibcode:2012JASMS..23.1003I. Дои:10.1007 / s13361-012-0377-z. ЧВК 3389995. PMID 22476891.
- ^ Б. Б. Стокс и Л. Конерманн (2009). «Структурная характеристика короткоживущих промежуточных продуктов разворачивания белков с помощью лазерно-индуцированного окислительного мечения и масс-спектрометрии». Анальный. Chem. 81 (1): 20–27. Дои:10.1021 / ac801888h. PMID 19055350.
- ^ Gupta N .; Tanner S .; Jaitly N .; Adkins J.N .; Lipton M .; Эдвардс Р .; Romine M .; Остерман А .; Bafna V .; Smith R.D .; и другие. (2007). «Полный протеомный анализ посттрансляционных модификаций: применение масс-спектрометрии для протеогеномной аннотации». Genome Res. 17 (9): 1362–1377. Дои:10.1101 / гр.6427907. ЧВК 1950905. PMID 17690205.
- ^ Gupta N .; Benhamida J .; Bhargava V .; Goodman D .; Каин Э .; Kerman I .; Nguyen N .; Ollikainen N .; Родригес Дж .; Ван Дж .; и другие. (2008). «Сравнительная протеогеномика: сочетание масс-спектрометрии и сравнительной геномики для анализа нескольких геномов». Genome Res. 18 (7): 1133–1142. Дои:10.1101 / гр.074344.107. ЧВК 2493402. PMID 18426904.
