Лакмус - Litmus


Лакмус это вода смесь разных красители извлеченный из лишайники. Часто адсорбируется на фильтровальная бумага производить одну из старейших форм индикатор pH, используется для тестирования материалов для кислотность.
История
Лакмус был впервые использован примерно в 1300 г. испанский врач Арнальдус де Вилла Нова.[1] Начиная с 16 века, синий краситель добывался из некоторых лишайников, особенно из Нидерланды.
Природные источники
Лакмус можно найти у разных видов лишайников. Красители добываются из таких видов, как Roccella tinctoria (Южноамериканец), Roccella fuciformis (Ангола и Мадагаскар), Roccella pygmaea (Алжир), Roccella фикопсис, Lecanora tartarea (Норвегия, Швеция), Вариолярия dealbata, Охролехия парелла, Parmotrema tinctorum, и Пармелия. В настоящее время основными источниками являются Roccella montagnei (Мозамбик) и Dendrographa leucophoea (Калифорния).[1]
Использует
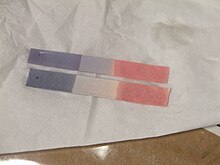
В основном лакмусовая бумажка используется для проверки правильности решения. кислый или же базовый. Голубая лакмусовая бумага становится красной в кислых условиях, а красная лакмусовая бумага становится синей в основных или щелочной условиях, при этом изменение цвета происходит в течение pH диапазон 4,5–8,3 при 25 ° C (77 ° F). Нейтральный лакмусовая бумага фиолетовая.[1] Лакмус также можно приготовить как водный решение который функционирует аналогично. В кислых условиях раствор имеет красный цвет, а в щелочных - синий.
Влажную лакмусовую бумагу также можно использовать для проверки водорастворимых газов, влияющих на кислотность или же основность; газ растворяется в воды и полученный раствор окрашивает лакмусовую бумагу. Например, аммиак Щелочной газ превращается в красную лакмусовую бумажку в синий цвет.
| Лакмус (индикатор pH ) | ||
| ниже pH 4,5 | выше pH 8,3 | |
| 4.5 | ⇌ | 8.3 |
Химические реакции, отличные от кислотно-основных, также могут вызывать изменение цвета лакмусовой бумаги. Например, хлор Газ превращается в синюю лакмусовую бумажку в белый цвет - лакмусовая бумага отбеленный,[2] из-за наличия гипохлорит ионы. Эта реакция необратима, поэтому лакмусовая бумажка в данной ситуации не выступает индикатором.
Химия
Лакмусовая смесь имеет Количество CAS 1393-92-6 и содержит от 10 до 15 различных красителей. Все химические компоненты лакмуса, вероятно, будут такими же, как и компоненты родственной смеси, известной как орсеин, но в разных пропорциях. В отличие от орсеина, основная составляющая лакмуса имеет среднюю молекулярную массу 3300.[3] Кислотно-основные индикаторы на лакмусовой бумаге обязаны своими свойствами 7-гидроксифеноксазон хромофор.[4] Немного фракции лакмусовой бумаги были даны конкретные имена, в том числе эритролитмин (или эритролеин), азолитмин, спаниолитмин, лейкоорсин и лейказолитмин. Азолитмин проявляет почти такой же эффект, как лакмусовая бумажка.[5]
Рекомендации
- ^ а б c Манфред Нойперт: Lackmus в Römpp Lexikon Chemie (немецкий), 31 января 2013 г.
- ^ О'Лири, Донал (2000). «Хлор». Химические элементы. Архивировано из оригинал 21 декабря 2008 г.
- ^ Beecken, H .; ЭМ. Готтшалк; У. против Гижицки; Х. Кремер; Д. Маассен; H-G. Мэттис; Х. Муссо; C. Rathjen; Ул. Здорски (2003). «Орсеин и лакмус». Биотехника и гистохимия. 78 (6): 289–302. Дои:10.1080/10520290410001671362.
- ^ Х. Муссо, К. Ратьен (1959). «Орсеиновые красители. X. Поглощение света и хромофор лакмуса». Chem. Бер. 92 (3): 751–3. Дои:10.1002 / cber.19590920331.
- ^ E.T. Вольф: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S.450-453, veröffentlicht 1846, Верлаг Э. Антон (Германия)

