Миниген - Minigene
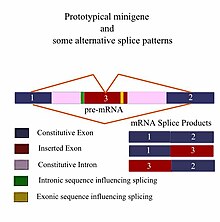
А миниген это минимальный фрагмент гена, который включает экзон и контрольные области, необходимые для экспрессии гена таким же образом, как и дикого типа фрагмент гена. Это миниген в самом простом смысле. Можно сконструировать более сложные минигены, содержащие несколько экзонов и интрон (ы). Минигены представляют собой ценный инструмент для исследователей, оценивающих сращивание шаблоны как in vivo и in vitro биохимически оцененные эксперименты.[1][2] В частности, минигены используются в качестве репортера сплайсинга. векторов (также называется захват экзонов векторы) и действуют как зонд, чтобы определить, какие факторы важны для результатов сплайсинга. Их можно сконструировать так, чтобы проверить, как цис-регуляторные элементы (Эффекты РНК) и трансрегуляторные элементы (связанный белки /факторы сращивания ) влияют на экспрессию генов.[3]
История
Минигены впервые были описаны как соматическая сборка сегментов ДНК и состояла из областей ДНК, которые, как известно, кодируют белок, и фланкирующих областей, необходимых для экспрессии белка. Этот термин впервые был использован в статье 1977 года для описания клонирования двух минигенов, которые были разработаны для экспрессии пептида.[4]
Сплайсинг РНК был открыт в конце 1970-х годов в результате изучения аденовирусов, которые вторгаются в млекопитающих и размножаются внутри них. Исследователи идентифицировали молекулы РНК, которые содержали последовательности из несмежных частей генома вируса. Это открытие привело к выводу о существовании регуляторных механизмов, влияющих на зрелую РНК и гены, которые она экспрессирует.[5] Использование минигенов в качестве вектора сообщения о сплайсинге для изучения эффектов регуляции сплайсинга РНК естественным образом последовало и остается основным применением минигенов на сегодняшний день.
Типы
Чтобы обеспечить хорошую модель минигена, фрагмент гена должен иметь все необходимые элементы, чтобы гарантировать то же самое. альтернативная сварка (AS) шаблоны как дикого типа ген, то есть длина фрагмента должна включать все последовательности, расположенные выше и ниже по течению, которые могут влиять на его сплайсинг.[1][2] Поэтому большинство мини-проектов начинаются с тщательного in silico анализ требований эксперимента перед проведением «мокрой» лабораторной работы.[6] С появлением Биоинформатика и широкое использование компьютеров, сейчас существует несколько хороших программ для идентификации цис-действующих контролирующих областей, которые влияют на результаты сплайсинга гена.[7][8] а расширенные программы могут даже учитывать результаты сращивания различных типов тканей.[9] Различия в минигенах обычно отражаются в конечном размере фрагмента, который, в свою очередь, отражает сложность самого минигена. Количество чужеродных элементов ДНК (экзонов и интронов), вставленных в конститутивные экзоны и интроны данного фрагмента, зависит от типа эксперимента и требуемой информации. Типичный эксперимент может включать дикого типа минигены, которые, как ожидается, будут нормально экспрессировать гены в сравнении с генно-инженерными аллельные вариации которые заменяют ген дикого типа и были клонированы в те же фланкирующие последовательности, что и исходный фрагмент. Эти типы экспериментов помогают определить влияние различных мутаций на пре-мРНК сращивание.[3]
строительство
После выбора подходящего геномного фрагмента (этап 1) экзоны и интроны фрагмента могут быть вставлены и амплифицированы вместе с фланкирующими конститутивными экзонами и интронами исходного гена посредством ПЦР. Праймеры для ПЦР можно выбрать так, чтобы они оставались "липкие концы «на 3 'смысловой и антисмысловой цепях (этап 2). Эти« липкие концы »могут быть легко включены в вектор TOPO путем лигирования в коммерчески доступный источник, к которому уже прикреплена лигаза на момент включения[10] (Шаг 3). Последующие векторы TOPO можно трансфицировать в клетки E.coli (этап 4). После инкубации общая РНК может быть извлечена из бактериальных колоний и проанализирована с использованием ОТ-ПЦР для количественной оценки отношений включения / исключения экзонов (шаг 5). Миниген можно трансфицировать в разные типы клеток с помощью различных факторов сплайсинга для тестирования транс-действующих элементов (этап 6). Экспрессированные гены или белки, которые они кодируют, могут быть проанализированы для оценки компонентов сплайсинга и их эффектов с помощью различных методов, включая гибридизация или эксклюзионная хроматография.[1][2]

Использует
Сплайсинг РНК по оценкам, ошибки встречаются в одной трети генетических заболеваний.[нужна цитата ] Понимать патогенез и идентифицировать потенциальные цели терапевтического вмешательства при этих заболеваниях, очень важно объяснить вовлеченные элементы сплайсинга.[11] Определение полного набора компонентов, участвующих в сплайсинге, представляет собой множество проблем из-за обилия альтернативного сплайсинга, который встречается в большинстве генов человека, и специфичности, с которой выполняется сплайсинг. in vivo.[2] Сплайсинг четко проводится от типа клетки к типу клетки и на разных стадиях клеточного развития. Поэтому очень важно, чтобы любой in vitro или биоинформатические предположения о регуляции сплайсинга подтверждены in vivo.[12] Минигены используются для выяснения СНГ-регулирующие элементы, транс-регуляторные элементы и другие регуляторы сплайсинга преждевременной РНК in vivo.[2] Минигены применялись для изучения разнообразных генетических заболеваний из-за вышеупомянутого обилия альтернативно сплайсированных генов, а также специфичности и вариаций, наблюдаемых в регуляции сплайсинга.[1][2][12] Ниже приведены примеры использования минигена при различных заболеваниях. Хотя это не исчерпывающий список, он дает лучшее понимание того, как используются минигены.
Эндокринные заболевания
Ошибки сплайсинга РНК могут иметь решающее влияние на функционирование белков, включая гормоны, секретируемые эндокринная система. Эти эффекты на гормоны были определены как причина многих эндокринных нарушений, включая патологические состояния, связанные с щитовидной железой, рахит, гиперинсулинемическая гипогликемия и врожденная гиперплазия надпочечников.[13] Одним из конкретных примеров ошибки сплайсинга, вызывающей эндокринное заболевание, которое было изучено с использованием минигенов, является тип дефицит гормона роста называется изолированным дефицитом гормона роста (IGHD), заболеванием, которое приводит к задержке роста. IGHD типа II - это аутосомно-доминантная форма, вызванная мутацией в промежуточной последовательности (IVS), прилегающей к экзону 3 гена, кодирующего гормон роста 1, гена GH-1. Эта мутированная форма IVS3 вызывает пропуск экзона 3 в продукте мРНК. МРНК (-E3) кодирует усеченную форму hGH, которая затем подавляет нормальную секрецию hGH. Минигены использовались для определения того, что точечная мутация внутри интронного энхансера сплайсинга (ISE), встроенного в IVS3, виноват в пропуске E3. Более того, было определено, что на функцию ISE влияет близлежащий сменный элемент переменного тока, показывая, что данная ошибка сварки вызвана трансмиссионным фактором.[14]
Нейродегенеративные заболевания
Накопление тау-белок связан с нейродегенеративные заболевания в том числе Болезнь Альцгеймера и Болезнь Паркинсона болезни, а также другие таупатии.[15] Изоформы тау-белка создаются путем альтернативного сплайсинга экзонов 2, 3 и 10. Регуляция сплайсинга тау специфична для стадии развития, физиологии и местоположения. Ошибки в сплайсинге тау могут возникать как в экзонах, так и в интронах и, в зависимости от ошибки, приводить к изменениям в структуре белка или потере функции.[16] Агрегация этих аномальных белков тау напрямую коррелирует с патогенезом и прогрессированием заболевания. Минигены использовались несколькими исследователями, чтобы помочь понять регуляторные компоненты, ответственные за сплайсинг мРНК гена TAU.[15][16][17]
Рак
Рак - сложное разнородное заболевание, которое может быть наследственным или возникать в результате воздействия окружающей среды.[18] Минигены используются, чтобы помочь онкологам понять роли пре-мРНК сплайсинг играет при разных типах рака. Особый интерес представляют специфические для рака генетические мутации, которые нарушают нормальные процессы сплайсинга, включая те, которые влияют на сплайсосома компоненты и РНК-связывающие белки такие как гетерогенные ядерные рибонуклео-частицы (hnRNP), белки, богатые серином / аргинином (SR) и малые рибонуклеопротеины (snRNP).[19][20] Белки, кодируемые аберрантно сплайсированными пре-мРНК, функционально различны и вносят вклад в характерные аномалии, проявляемые раковыми клетками, включая их способность пролиферировать, вторгаться и подвергаться ангиогенезу и метастазированию.[20] Минигены помогают исследователям идентифицировать генетические мутации при раке, которые приводят к ошибкам сплайсинга, и определять последующие эффекты, которые эти ошибки сплайсинга оказывают на экспрессию генов.[21] Используя знания, полученные в ходе исследований с использованием минигенов, онкологи предложили тесты, предназначенные для обнаружения продуктов аномальной экспрессии генов в диагностических целях.[22] Кроме того, перспектива использования минигенов в качестве иммунотерапия рака исследуется.[23][24]
Смотрите также
использованная литература
- ^ а б c d Штосс, О; Стоилов, П; Hartmann, AM; Найлер, О; Штамм, С. (декабрь 1999 г.). «Подход in vivo minigene для анализа тканеспецифического сплайсинга». Исследование мозга. Протоколы исследования мозга. 4 (3): 383–94. Дои:10.1016 / с 1385-299x (99) 00043-4. PMID 10592349.
- ^ а б c d е ж Купер, Томас А. (декабрь 2005 г.). «Использование минигенных систем для рассечения альтернативных элементов сращивания». Методы. 37 (4): 331–340. Дои:10.1016 / j.ymeth.2005.07.015. PMID 16314262.
- ^ а б Desviat, LR; Перес, B; Угарте, М (2012). «Минигены для подтверждения мутаций пропуска экзонов». Пропуск экзона. Методы Мол. Биол. 867. С. 37–47. Дои:10.1007/978-1-61779-767-5_3. ISBN 978-1-61779-766-8. PMID 22454053.
- ^ Пуонян, MS; МакКомас, WW; Нуссбаум, А.Л. (1977). «Химический синтез двух дезоксирибододекануклеотидов для присоединения концов рестрикции к искусственному минигену». Ген. 1 (5–6): 357–72. Дои:10.1016/0378-1119(77)90040-3. PMID 590743.
- ^ Клэнси, S (2008). «Сплайсинг РНК: интроны, экзоны и сплайсосомы». Природное образование. 1 (31).
- ^ Бердж, Кристофер. "Burge Lab Software". Получено 7 мая 2014.
- ^ Дивина, Петр; Квитковичова, Андреа; Буратти, Эмануэле; Воречовский, Игорь (14 января 2009 г.). «Ab initio предсказание индуцированной мутацией активации криптического сайта сплайсинга и пропуска экзона». Европейский журнал генетики человека. 17 (6): 759–765. Дои:10.1038 / ejhg.2008.257. ЧВК 2947103. PMID 19142208.
- ^ Grodecká, Люси; Локерова, Павла; Равчукова, Барбора; Буратти, Эмануэле; Baralle, Francisco E .; Душек, Ладислав; Фрайбергер, Томаш; Спилианакис, Харалампос Бабис (21 февраля 2014 г.). «Мутации первого нуклеотида в экзоне при сплайсинге: оценка инструментов прогнозирования in Silico». PLOS ONE. 9 (2): e89570. Bibcode:2014PLoSO ... 989570G. Дои:10.1371 / journal.pone.0089570. ЧВК 3931810. PMID 24586880.
- ^ Бараш, Йосеф; Вакеро-Гарсия, Хорхе; Гонсалес-Валлинас, Хуан; Сюн, Хуэй; Гао, Вэйцзюнь; Ли, Лео Дж .; Фрей, Брендан Дж. (2013). «AVISPA: веб-инструмент для прогнозирования и анализа альтернативной сварки». Геномная биология. 14 (10): R114. Дои:10.1186 / gb-2013-14-10-r114. ЧВК 4014802. PMID 24156756.
- ^ «Этапы создания вектора TOPO». Науки о жизни. Получено 7 мая 2014.
- ^ Лим, Киан; Хуат; Феррарис, Лучиана; Filloux, Madeleine E .; Рафаэль, Бенджамин Дж .; Фэйрбразер, Уильям Г. (2011). «Использование позиционного распределения для идентификации элементов сплайсинга и прогнозирования дефектов процессинга пре-мРНК в генах человека». Труды Национальной академии наук. 108 (27): 11093–6. Bibcode:2011PNAS..10811093H. Дои:10.1073 / pnas.1101135108. ЧВК 3131313. PMID 21685335.
- ^ а б Штамм, Стефан. "Stamms-lab.net". Архивировано из оригинал 9 декабря 2013 г.. Получено 26 марта 2014.
- ^ Розария де Миранда, Элизабет (2009). «Влияние вариантов сплайсинга на нормальную физиологию и патологические состояния щитовидной железы». Arq Bras Endocrinol Metabol. 53 (6): 709–714. Дои:10.1590 / S0004-27302009000600003. PMID 19893912.
- ^ Муллис, ЧП (2010). «Генетика изолированного дефицита гормона роста». J Clin Res Pediatr Endocrinol. 2 (2): 52–62. Дои:10.4274 / jcrpe.v2i2.52. ЧВК 3014602. PMID 21274339.
- ^ а б Кар, Амар; Фусими, Кадзуо; Чжоу, Сяохун; Рэй, Паял; Ши, Чен; Чен, Сяопин; Лю, Чжижэнь; Чен, Она; Ву, Джейн Ю. (2011). «РНК-геликаза p68 (DDX5) регулирует сплайсинг тау-экзона 10 путем модуляции структуры стержень-петля в 5'-сайте сплайсинга». Мол. Cell. Биол. 31 (9): 1812–1821. Дои:10.1128 / MCB.01149-10. ЧВК 3133221. PMID 21343338.
- ^ а б Родригес-Мартин, Тереза; Карен Энтони; Мариано А. Гарсиа-Бланко; С. Гэри Мэнсфилд; Брайан Х. Андертон; Жан-Марк Галло (2009). «Коррекция неправильного сплайсинга тау-белка, вызванного мутациями FTDP-17 MAPT, посредством транс-сплайсинга РНК, опосредованного сплайсосомами». Хум Мол Генет. 18 (17): 3266–3273. Дои:10,1093 / hmg / ddp264. ЧВК 2722988. PMID 19498037.
- ^ Анфосси, М; Vuono, R; Maletta, R; Вирди, К; Мирабелли, М; Colao, R; Пуччо, G; Бернарди, L; Франжипан, F; Галло, М; Герацитано, S; Tomaino, C; Curcio, SA; Заннино, Г; Lamenza, F; Duyckaerts, C; Spillantini, MG; Лосо, Массачусетс; Бруни, AC (2011). «Сложная гетерозиготность 2 новых мутаций MAPT при лобно-височной деменции». Нейробиол старения. 32 (4): 757.e1–757.e11. Дои:10.1016 / j.neurobiolaging.2010.12.013. PMID 21295377.
- ^ Rajan, P .; Эллиотт, диджей; Робсон, CN; Leung, HY (август 2009 г.). «Альтернативный сплайсинг и биологическая гетерогенность при раке простаты». Нат Рев Урол. 6 (8): 454–460. Дои:10.1038 / nrurol.2009.125. PMID 19657379.
- ^ Адлер, АС; Макклеланд, ML; Да, S; Яйлаоглу, М; Хуссейн, S; Cosino, E; Хиноны, G; Модрусан, З; Сешагири, S; Торрес, Э; Чопра, VS; Хейли, B; Zhang, Z; Blackwood, EM; Сингх, М.; Junttila, M; Стефан, JP; Лю, Дж; Пау, G; Фирон, ER; Цзян, З; Файрестейн, Р. (май 2014 г.). «Интегративный анализ рака толстой кишки определяет важную функцию PRPF6 в росте опухоли». Genes Dev. 28 (10): 1068–84. Дои:10.1101 / gad.237206.113. ЧВК 4035536. PMID 24788092.
- ^ а б Го, Ронг; Юн Ли; Цзиньинь Нин; Дэн Сун; Ляньцзюнь Линь; Синьминь Лю (2013). «HnRNP A1 / A2 и SF2 / ASF регулируют альтернативный сплайсинг регулирующего фактора 3 интерферона и влияют на иммуномодулирующие функции немелкоклеточных клеток рака легких человека». PLOS ONE. 8 (4): e62729. Bibcode:2013PLoSO ... 862729G. Дои:10.1371 / journal.pone.0062729. ЧВК 3639176. PMID 23658645.
- ^ Аседо, Альберто; Дэвид Дж. Санс; Мерседес Дуран; Мар Инфанте; Люсия Перес-Каборнеро; Кристина Майнер; Эладио Веласко (2012). «Комплексный сплайсинговый функциональный анализ вариантов ДНК гена BRCA2 гибридными минигенами». Исследование рака груди. 14 (3): R87. Дои:10.1186 / bcr3202. ЧВК 3446350. PMID 22632462.
- ^ Di Giacomo, D .; Gaildrat, P; Абули, А; Abdat, J; Frébourg, T; Този, М; Мартинс, А (2013). «Функциональный анализ большого набора вариантов экзона 7 BRCA2 подчеркивает прогностическую ценность оценок гексамеров при обнаружении изменений регуляторных элементов сплайсинга экзонов». Гм. Мутат. 34 (11): 1547–57. Дои:10.1002 / humu.22428. PMID 23983145.
- ^ Daniotti, Jose L .; Альдо А. Вилкаес; Ванина Торрес Демикелис; Фернандо М. Руджеро; Макарена Родригес-Уокер (2013). «Гликозилирование гликолипидов при раке: основа для разработки новых терапевтических подходов». Фронт Онкол. 3: 306. Дои:10.3389 / fonc.2013.00306. ЧВК 3867695. PMID 24392350.
- ^ Aurisicchio, L; Фридман, А; Багчи, А; Скарселли, Э; Ла Моника, N; Ciliberto, G (январь 2014 г.). «Новый каркас минигена для терапевтических противораковых вакцин». Онкоиммунология. 3 (1): e27529. Дои:10.4161 / onci.27529. ЧВК 4002591. PMID 24790791.
дальнейшее чтение
- «Альтернативный сплайсинг пре-мРНК: теория и протоколы», Стефан Штамм, Крис Смит и Рейнхард Люрманн. ISBN 978-3527326068
- «Молекулярная диагностика. Второе издание», под ред. Джордж П. Патринос и Вильхельм Ансорге ISBN 0123745373
- "ДНК-вакцины" под редакцией Хильдегун Эртль ISBN 1461349257
- "Альтернативный сплайсинг и болезнь (прогресс в молекулярной и субклеточной биологии)" Филиппа Жантера ISBN 3540344489
внешние ссылки
- Веб-страница Стефана Штамма в Университете Кентукки. Хороший обзор исследований минигена.
- Лаборатория Кристофера Берджа в Массачусетском технологическом институте. интернет сайт. Хороший сайт для теоретического анализа стыковки.
- Браузер генома UCSC. Большая база данных для получения информации о генах.
