Доклиническая ОФЭКТ - Preclinical SPECT

Доклиническая или однофотонная эмиссионная компьютерная томография мелких животных (ОФЭКТ ) на основе радионуклидов молекулярная визуализация модальность для мелких лабораторных животных[1] (например, мыши и крысы). Хотя ОФЭКТ - это хорошо зарекомендовавший себя метод визуализации, который уже несколько десятилетий используется в клинических целях, ограниченное разрешение клинической ОФЭКТ (~ 10 мм) стимулировало разработку специализированных систем ОФЭКТ для мелких животных с субмиллиметровым разрешением. В отличие от клиник, доклиническая ОФЭКТ превосходит доклиническое совпадение ДОМАШНИЙ ПИТОМЕЦ по разрешающей способности (наилучшее пространственное разрешение ОФЭКТ - 0,25 мм,[2] ПЭТ ≈ 1 мм[3][4] ) и, в то же время, позволяет выполнять быструю динамическую визуализацию животных (временные рамки менее 15 с.[5]).
Для получения изображений SPECT требуется введение небольших количеств γ-излучающих радиоактивно меченных молекул (обычно называемых "трассеры ") в животное до получения изображения. Эти индикаторы биохимически сконструированы таким образом, что они накапливаются в целевых частях тела. Излучение, испускаемое молекулами индикатора (одиночные γ-фотоны ) может быть обнаружен гамма-детекторы и, после реконструкции изображения, приводит к трехмерному изображению распределения индикаторов внутри животного. Некоторые ключевые радиоактивные изотопы, используемые в доклинической ОФЭКТ: 99 мTc, 123я, 125я, 131я, 111В, 67Ga и 201Tl.
Доклиническая ОФЭКТ играет важную роль во многих областях: трансляционные исследования[6] где SPECT может использоваться для неинвазивной визуализации радиоактивно меченных молекул, включая антитела, пептиды и наночастицы. Среди основных областей его применения - онкология, неврология, психиатрия, кардиология, ортопедия, фармакология и внутренние болезни.
Базовый принцип визуализации доклинической ОФЭКТ
Из-за небольшого размера отображаемых животных (мышь примерно в 3000 раз меньше человека по весу и объему), очень важно иметь высокое пространственное разрешение и эффективность обнаружения для доклинического сканера.
Пространственное разрешение
Сначала посмотрим на пространственное разрешение, если мы хотим увидеть такой же уровень деталей относительно, например, размер органов у мыши, как мы можем видеть у человека, пространственное разрешение клинической ОФЭКТ необходимо улучшить в 3000≈15 или выше раз. Такое препятствие заставило ученых искать новый подход к визуализации для доклинической ОФЭКТ, который был обнаружен при использовании принципа визуализации точечных отверстий.[7]

А коллиматор с отверстиями состоит из куска плотного материала, содержащего только одно отверстие, которое обычно имеет форму двойного конуса. Первые попытки получить ОФЭКТ-изображения грызунов с высоким разрешением были основаны на использовании коллиматоров-обскур, прикрепленных к конвекционным гамма-камерам.[8][9] Таким образом, поместив объект (например, грызуна) близко к отверстию точечного отверстия, можно достичь высокого увеличение проекции на поверхность детектора и эффективно компенсируют ограниченное собственное разрешение детектора.
Комбинированные эффекты конечного размера апертуры и ограниченного внутреннего разрешения описываются следующим образом:
dе - эффективный диаметр отверстия, Rя - собственное разрешение детектора, M - коэффициент увеличения проекции.
Разрешение системы SPECT, основанной на принципе визуализации точечных отверстий, можно улучшить одним из трех способов:
- за счет уменьшения эффективного диаметра точечного отверстия
- за счет увеличения коэффициента увеличения
- за счет использования детекторов с более высоким внутренним разрешением
Точный размер, форма и материал отверстия важны для получения хороших характеристик изображения и являются предметом исследований по оптимизации конструкции коллиматора, например, с помощью использование Моделирование Монте-Карло.Современные доклинические сканеры SPECT, основанные на визуализации точечных отверстий, могут достигать пространственного разрешения до 0,25 мм или объемного разрешения 0,015 мкл для in vivo визуализация мыши.
Эффективность обнаружения
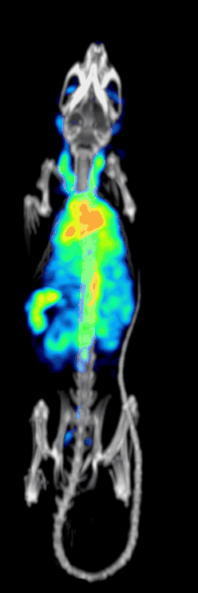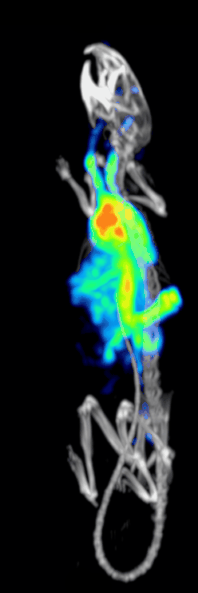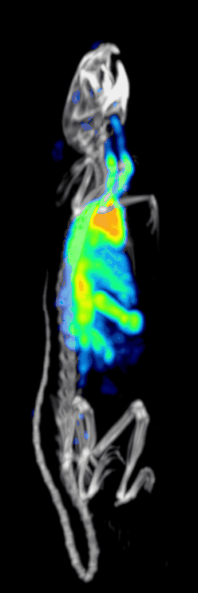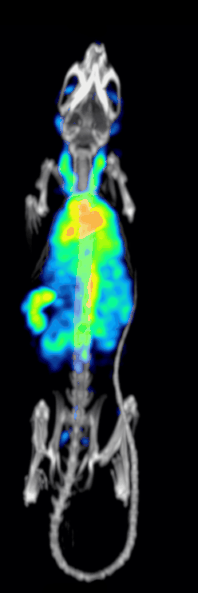
Эффективность обнаружения или чувствительность доклинической системы точечной ОФЭКТ определяется:[10][11]
S - эффективность (чувствительность) обнаружения, dе-эффективный диаметр точечного отверстия с проплавлением, N - общее количество отверстий, rc - радиус коллиматора (например, расстояние от объекта до отверстия).
Чувствительность можно улучшить:
- увеличение диаметра точечного отверстия
Возможные недостатки: ухудшение пространственного разрешения.
- уменьшение расстояния между объектом и отверстием (например, размещение животного как можно ближе к отверстию для отверстия)
- использование нескольких отверстий, позволяющих одновременно снимать проекции под разными углами
Возможные недостатки: Когда несколько проекций точечных отверстий проецируются на одну поверхность детектора, они могут либо перекрывать друг друга (мультиплексирование выступов), либо быть полностью разделенными (неперекрывающиеся выступы). Хотя коллиматоры с точечным отверстием с мультиплексированием проекций позволяют достичь более высокой чувствительности (за счет использования большего количества отверстий) по сравнению с неперекрывающимися конструкциями, они также страдают от множественных артефактов на восстановленных изображениях SPECT.[12][13][14][15] Артефакты вызваны неоднозначностью происхождения γ-фотонов, обнаруженных в областях перекрытия.
- уменьшение размера "поле зрения "
Размещение животного близко к отверстию-точечному отверстию происходит за счет уменьшения размера области, которая может быть отображена в данный момент времени («поле зрения») по сравнению с визуализацией при меньшем увеличении. Однако в сочетании с перемещением животного (так называемый «метод сканирования-фокусировки») [16]) можно получить изображение большей интересующей области с хорошим разрешением и чувствительностью.
Типичная эффективность обнаружения доклинического сканера SPECT находится в диапазоне 0,1-0,2% (1000-2000 имп / с / МБк), что более чем в десять раз превышает среднюю чувствительность клинических сканеров.[17] В то же время специальные высокочувствительные коллиматоры могут обеспечить эффективность обнаружения> 1% и поддерживать разрешение изображения менее миллиметра.[18]
Системный дизайн
Были предложены конструкции системы множественной точечной ОФЭКТ, включая вращающуюся гамма-камеру, стационарный детектор, но вращающийся коллиматор или полностью стационарную камеру.[19][20] в котором большое количество точечных отверстий окружает животное и одновременно получают проекции под достаточным количеством углов для восстановления томографического изображения. Стационарные системы имеют ряд преимуществ перед нестационарными:
- нет необходимости в повторной калибровке геометрии системы
Почему: из-за стабильного положения детектора (ов) и коллиматора
- в отличие от нестационарных систем, стационарные системы очень хорошо подходят для динамической визуализации SPECT.
Почему: потому что вся необходимая угловая информация собирается одновременно через несколько отверстий.
Современные стационарные доклинические системы ОФЭКТ могут выполнять динамическую ОФЭКТ-визуализацию с временными рамками до 15 с во всем теле. [5] и временные рамки до 1 секунды во время "сосредоточения" (например, сосредоточение внимания на сердце) [16] получение изображений.

Мультимодальная визуализация

Медицинская визуализация включает в себя множество различных методов визуализации, которые можно условно разделить на анатомическую и функциональную. Анатомические формы (например, CT, МРТ ) в основном раскрывают структуру тканей и органов, а функциональные параметры (ОФЭКТ, ПЭТ и оптическое изображение ) в основном визуализируют физиологию и функцию ткани. Поскольку ни один из существующих методов визуализации не может предоставить информацию обо всех аспектах структуры и функции, очевидный подход состоит в том, чтобы либо изменить один метод визуализации для задачи (например, специальные последовательности визуализации в МРТ), либо попытаться изобразить объект, используя несколько способов визуализации. . Следуя мультимодальному подходу, в последние годы комбинация системы ОФЭКТ / КТ стала стандартной комбинацией методов молекулярной визуализации как в доклинической, так и в клинической областях, где структурная информация КТ дополняет функциональную информацию из ОФЭКТ. Тем не менее, интеграция ОФЭКТ с другими методами визуализации (например, ОФЭКТ / МРТ, ОФЭКТ / ПЭТ / КТ[6][21]) не редкость.
Реконструкция
Измерение SPECT состоит из двухмерных проекций распределения радиоактивных источников, полученных с помощью коллиматора (ов) и гамма-детектора (ов). Целью алгоритма реконструкции изображения является точное восстановление неизвестного трехмерного распределения радиоактивности.[22]
Алгоритм максимизации ожидания максимального правдоподобия[23][24] (MLEM ) является важным «золотым стандартом» в итеративной реконструкции изображений SPECT, но это также дорогостоящий метод с вычислительной точки зрения. Популярное решение этого препятствия основано на использовании так называемых методов блочно-итерационной реконструкции. В блочно-итерационных методах каждая итерация алгоритма подразделяется на множество последующих под-итераций, каждая из которых использует различное подмножество данных проекции. Примером широко используемой блочно-итеративной версии MLEM является алгоритм максимизации ожидания упорядоченных подмножеств.[25] (OSEM). Ускорение восстановления полной итерации OSEM за одну итерацию MLEM приблизительно равно количеству подмножеств.
Количественная оценка
Доклиническая ОФЭКТ - это метод количественной визуализации. Поглощение индикаторов SPECT в интересующих органах (областях) можно рассчитать по реконструированным изображениям. Небольшие размеры лабораторных животных уменьшают ослабление фотонов в теле животного (по сравнению с объектами размером с человека). Тем не менее, в зависимости от энергии γ-фотонов и размера животного, которое используется для визуализации, может потребоваться поправка на ослабление и рассеяние фотонов для обеспечения хорошей точности количественной оценки. Подробное обсуждение эффектов, влияющих на количественную оценку изображений SPECT, можно найти в Hwang et al.[26]
Трассеры ОФЭКТ
Индикаторы SPECT излучают одиночные γ-фотоны с энергией испускаемого фотона, зависящей от изотопа, который использовался для радиоактивной маркировки индикатора. Таким образом, в случаях, когда разные индикаторы радиоактивно помечены изотопами разной энергии, ОФЭКТ дает возможность исследовать несколько молекулярных путей одновременно (мультиизотопная визуализация). Два примера распространенных комбинаций мультиизотопных индикаторов, используемых для получения изображений SPECT: 123Я-NaI /99 мTc-пертехнетат (функция щитовидной железы[27]) или же 99 мTc-MAG3 /111В-DTPA (оценка почечная фильтрация ).
Время, за которое трассировщик можно следить in vivo сильно зависит от периода полураспада изотопа, используемого для радиоактивной метки соединения. Широкий спектр относительно долгоживущих изотопов (по сравнению с изотопами, обычно используемыми в ПЭТ), которые можно использовать для получения изображений SPECT, дает уникальную возможность визуализировать медленные кинетические процессы (от нескольких дней до недель).
Другой важной характеристикой ОФЭКТ является простота процедуры маркировки радиоактивным индикатором, которую можно выполнять с помощью широкого спектра имеющихся в продаже наборов для маркировки.
Сравнение доклинической ОФЭКТ и ПЭТ
Доклиническая ОФЭКТ и ПЭТ - это два очень похожих метода молекулярной визуализации, используемые для неинвазивной визуализации биораспределения маркеров радиоактивных меток, которые вводятся животному. Основное различие между ОФЭКТ и ПЭТ заключается в природе радиоактивного распада их индикаторов. Индикатор SPECT излучает одиночные γ-фотоны с энергией фотонов, которая зависит от изотопа, который использовался для радиоактивной метки. В ПЭТ индикатор испускает позитроны, которые после аннигиляции с электронами в объекте, производят пару аннигиляционных фотонов с энергией 511 кэВ, испускаемых в противоположных направлениях. Случайное обнаружение этих аннигиляционных фотонов используется для формирования изображения в ПЭТ. В результате были разработаны разные принципы обнаружения для индикаторов ОФЭКТ и ПЭТ, что привело к раздельным сканерам ОФЭКТ и ПЭТ.
Сравнение доклинической ОФЭКТ и ПЭТ представлено в таблице ниже.
| Характеристики | ОФЭКТ | ДОМАШНИЙ ПИТОМЕЦ |
|---|---|---|
| Радиационный распад | одиночные γ-фотоны | β+ разлагаться |
| Основной принцип обнаружения | Коллимация, одиночные γ-фотоны | Обнаружение совпадений, аннигиляционные фотоны |
| Энергия γ-фотонов | Разные для разных изотопов | 511 кэВ |
| Самый популярный изотоп | 99 мTc: период полувыведения 6,03 часа, γ-энергия 141 кэВ | 18F: период полураспада 108 минут, γ-энергия 511 кэВ |
| Мультиизотопная визуализация | Да, для изотопов с разной энергией γ-фотонов | Нет, все изотопы излучают фотоны с энергией 511 кэВ |
| Визуализация медленных динамических процессов | Да, для изотопа с более длительным периодом полураспада (например. 99 мTc - 6,03 часа, 123я - 13 часов, 111В - 2,8 суток, 125я - 60,14 суток) | Ограничено распадом изотопа (период полураспада 18F - 108 минут, 11C - 24 минуты, 124я - 4,18 суток) |
| Визуализация быстрых динамических процессов | > 15 секунд кадров (визуализация всего тела)[5] Кадры> 1 с (сфокусированное изображение) [18] | Да, кадры из секунд в минуты |
| Разрешение, лучшее | 0,25 мм (0,015 мкл)[2] | 0,75 мм (0,422 мкл)[28] |
| Эффективность обнаружения | 0.1-1.3% | 1- 10% |
| Маркировка радиоактивным индикатором (стоимость) | Снизу вверх | Высоко |
Современная доклиническая ОФЭКТ
Производители доклинических систем ОФЭКТ включают MILabs, Сименс, Bruker и Mediso.[29][30] Доступны системы, сочетающие ОФЭКТ с множеством других модальности включая МИСТЕР, ДОМАШНИЙ ПИТОМЕЦ и CT.[31][32] Они могут достигать пространственного разрешения до 0,25 мм (объемное разрешение 0,015 мкл) и до 1 секунды динамической неинвазивной ОФЭКТ-визуализации грызунов.[33]
Приложения в переводческих исследованиях
ОФЭКТ можно использовать для диагностической или терапевтической визуализации. Когда радиоактивный индикатор помечен первичными гамма-излучающими изотопами (например, 99 мTc, 123Я, 111В, 125I) полученные изображения предоставляют функциональную информацию о биораспределении соединения, которая может использоваться для различных диагностических целей. Примеры диагностических приложений: визуализация метаболизма и перфузии, кардиология, ортопедия.
Когда индикатор ОФЭКТ помечен комбинацией гамма- и α- или β-излучающего изотопа (например, 213Би или же 131I) возможно сочетание рака радиоизотопная терапия с α- или же β-частицы с неинвазивной визуализацией ответа на терапию, достигаемого с помощью ОФЭКТ.
Рекомендации
- ^ Meikle SR, et al. ОФЭКТ мелких животных и ее место в матрице технологий молекулярной визуализации. Phys Med Biol. 2005; 50 (22): R45-61.
- ^ а б Иващенко и др. Молекулярная визуализация мышей с четвертьмиллиметровым разрешением с помощью U-SPECT +. Mol Imaging. 2014 г.
- ^ Walker MD, et al. Оценка производительности доклинического ПЭТ-сканера с точечной коллимацией по сравнению с ПЭТ-сканером для мелких животных на основе совпадений. J Nucl Med. 2014; 55 (8): 1368-1374.
- ^ Tai Y и др. Оценка производительности microPET Focus: сканер microPET третьего поколения, предназначенный для визуализации животных. J Nucl Med. 2005; 46 (3): 455-463.
- ^ а б c Vaissier PEB, et al. Быстрая спиральная ОФЭКТ со стационарными γ-камерами и фокусирующими отверстиями. J Nucl Med. 2012; 53 (8): 1292-9.
- ^ а б Бернсен MR, et al. Роль доклинической ОФЭКТ в онкологических и неврологических исследованиях в сочетании с КТ или МРТ. Eur J Nucl Med Mol Imaging. 2014; 41 (1): 36-49.
- ^ Бикман Ф. Дж. И др. Пинхол: путь к трехмерной радионуклидной визуализации сверхвысокого разрешения. Eur J Nucl Med Mol Imaging. 2007; 34 (2): 151-61.
- ^ Вебер Д.А. и др. Пинхол-ОФЭКТ: подход к in vivo получение изображений SPECT с высоким разрешением у мелких лабораторных животных. J Nucl Med. 1994; 35: 342-8.
- ^ Jaszczak RJ, et al. Пинхол-коллимация для ОФЭКТ со сверхвысоким разрешением и малым полем обзора. Phys Med Biol. 1994; 39: 425-37.
- ^ а б Rentmeester MCM и др. Оптимизация геометрии SPECT с несколькими отверстиями с использованием аналитической модели. Phys Med Biol. 2007; 52: 2567-2581.
- ^ Metzler SD, et al. Эффективный диаметр разрешения и чувствительности при коллимации точечных отверстий: экспериментальная проверка. Phys Med Biol. 2005; 50: 5005-5017.
- ^ Rowe RK, et al. Стационарный полусферический сканер SPECT для трехмерной визуализации мозга. J Nucl Med, 1993; 34: 474-80.
- ^ Meike SR, et al. Прототип детектора с кодированной апертурой для ОФЭКТ мелких животных. IEEE Trans Nucl Sci. 2002; 49: 2167-71.
- ^ Van Audenhaege K и др. Оценка полноты данных и качества изображения при мультиплексировании многоточечной ОФЭКТ. IEEE Trans Med Imag. 2015; 34: 474-86.
- ^ Vunckx K и др. Влияние перекрывающихся проекций на качество реконструктивного изображения в многоточечной ОФЭКТ. IEEE Trans Med Imag.2008; 27: 972-83.
- ^ а б Брандерхорст В. и др. Нацеленная мультифокальная ОФЭКТ. Eur J Nucl Med Mol Imaging. 2001; 38 (3): 552-61.
- ^ Madsen MT. Последние достижения в визуализации SPECT. J Nucl Med. 2007; 48 (4): 661-673.
- ^ а б Иващенко и др. ОФЭКТ сверхвысокой чувствительности суб-мм мыши. J Nucl Med. 2015; 56 (3): 470-5.
- ^ Furenlid LR, et al. FastSPECTII: динамический сканер SPECT второго поколения с высоким разрешением. IEEE Trans Nucl Sci. 2004; 51 (3): 631-635.
- ^ Ван дер Хаве Ф и др. U-SPECT-II: устройство сверхвысокого разрешения для молекулярной визуализации мелких животных. J Nucl Med. 2009; 50 (4): 599-605.
- ^ Cherry SR. Мультимодальные системы визуализации in vivo: вдвое больше или вдвое сложнее. Annu Rev Biomed Eng. 2006; 8: 35-62.
- ^ Ци Дж и др. Методы итерационной реконструкции в эмиссионной компьютерной томографии. Phys Med Biol. 2006; 51 (15): R541-78.
- ^ Ланге К. и др. Алгоритмы ЭМ реконструкции для эмиссионной и трансмиссионной томографии. J Comput Assist Tomogr. 1984; 8: 306-316.
- ^ Шепп Л.А. и др. Реконструкция методом максимального правдоподобия для эмиссионной томографии. IEEE Trans Med Imag. 1982; 1 (2): 113-22.
- ^ Hudson HM и др. Ускоренная реконструкция изображений с использованием упорядоченных подмножеств проекционных данных. IEEE Trans Med Imag. 1994; 13 (4): 601-609.
- ^ Hwang AB, et al. Оценка источников ошибок, влияющих на количественную точность изображений ОФЭКТ у мелких животных. Phys Med Biol. 2008. 53: 2233-2252.
- ^ Руководство Общества ядерной медицины по сцинтиграфии щитовидной железы. V3.0 Сцинтиграфия щитовидной железы. 10 сентября 2006 г. http://snmmi.files.cms-plus.com/docs/Thyroid_Scintigraphy_V3.pdf
- ^ Goorden MC и др. VECTor: система доклинической визуализации для одновременной субмиллиметровой ОФЭКТ и ПЭТ. J Nucl Med. 2013; 54 (2): 306-12.
- ^ Кунья, Лидия; Хорват, Ильдико; Феррейра, Сара; Лемос, Джоана; Коста, Педро; Виейра, Домингуш; Veres, Dániel S .; Сигети, Кристиан; Суммавьель, Тереза; Мате, Домокос; Метелло, Луис Ф. (22 октября 2013 г.). «Доклиническая визуализация: важный союзник современных биологических наук» (PDF). Молекулярная диагностика и терапия. 18 (2): 153–173. Дои:10.1007 / s40291-013-0062-3. PMID 24146172.
- ^ Кал-Гонсалес, Хакобо; Рауш, Иво; Шиям Сундар, Лалит К .; Лассен, Мартин Л .; Музик, Отто; Мозер, Эвальд; Папп, Ласло; Бейер, Томас (18 мая 2018 г.). «Гибридная визуализация: приборы и обработка данных». Границы физики. 6. Дои:10.3389 / fphy.2018.00047.
- ^ Хаттон, Брайан Ф; Окчипинти, Микеле; Кюне, Андре; Мате, Домокос; Ковач, Ноэми; Вайцис, Хельмар; Эрландссон, Кьелл; Сальвадо, Дебора; Карминати, Марко; Монтаньяни, Джованни Л; Коротко, Сьюзен К.; Оттобрини, Луиза; ван Муллеком, Питер; Пьемонте, Клаудио; Букки, Тамас; Нитрай, Золтан; Папп, Золтан; Надь, Кальман; Ниндорф, Торальф; де Франческо, Ирен; Фиорини, Карло (январь 2018 г.). «Разработка клинической синхронной ОФЭКТ / МРТ». Британский журнал радиологии. 91 (1081): 20160690. Дои:10.1259 / bjr.20160690. ЧВК 5966197.
- ^ Шобер, Отмар; Кисслинг, Фабиан; Дебус, Юрген (2020). Молекулярная визуализация в онкологии. Springer Nature. п. 127. ISBN 978-3-030-42618-7.
- ^ Азазрм, Ахмад Реза; Гарапапаг, Эсмаил; Исламист, ДжалилПираеш; Махмудян, Бабак (2015). «Достижения в коллиматорах с обскурами и множественными обскурами для получения изображений с помощью компьютерной томографии с однофотонной эмиссией». Всемирный журнал ядерной медицины. 14 (1): 3. Дои:10.4103/1450-1147.150505. ЧВК 4337004.


