Protide - Protide
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
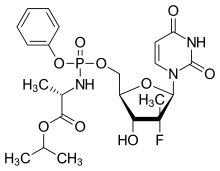
В ProTide технология - это пролекарство подход, используемый в молекулярная биология и дизайн препарата. Он предназначен для доставки аналоги нуклеотидов (в виде монофосфата) в клетку (ProTide: PROdrug + nucleoTIDE). Его изобрел профессор Крис МакГиган (Школа фармацевтики и фармацевтических наук, Кардиффский университет ) в начале 1990-х гг. Они составляют важную часть противовирусных препаратов. софосбувир, тенофовир алафенамид и Ремдесивир.

История

Первый прорыв в исследованиях ProTide был сделан в 1992 году, когда группа Макгигана отметила эффективность арилокси фосфаты и фосфорамидаты.[1] В частности, диарилфосфаты получали из зидовудин (AZT) с использованием простой химии фосфорохлоридата. Впервые анти-ВИЧ активность этих фосфатных производных AZT в некоторых случаях превышала активность исходного нуклеозида. Более того, пока АЗТ был практически неактивным (EC50 100 мкМ) в клеточной линии JM замещенный диарилфосфат был в 10 раз активнее (EC50 10 мкМ). В то время считалось, что JM нечувствителен к AZT из-за плохого фосфорилирования. Позже выяснилось, что откачивающий AZT насос был источником этой плохой чувствительности к AZT. Однако вывод остается в силе, что диарилфосфат был более способен сохранять активность в клеточной линии JM, и что это может означать (небольшую) степень внутриклеточной доставки фосфата. Электроноакцепторная способность п-нитрогрупп и предполагаемое повышение способности арильной уходящей группы были предложены в качестве основной движущей силы этого SAR.

Впоследствии была получена серия арилоксифосфорамидатов AZT с различными пара-арильными заместителями и несколькими аминокислотами.[2] Соединения изучались только на линии клеток JM, устойчивой к AZT, для определения потенциального (подразумеваемого) высвобождения AZT-монофосфата, и фосфорамидат аланина оказался поразительно эффективным. В ВИЧ-1 инфицированных JM во всех культурах, AZT был ингибирующим при 100 мкМ, тогда как фенилметоксиаланинилфосфорамидат был активен при 0,8 мкМ. Это было воспринято как первое свидетельство успешного нуклеотид Доставка. Также было отмечено, что в других сериях явно отдавалось предпочтение аланин над лейцин (10 раз) и глицин (> 100 раз). Более того, хотя было отмечено, что электроноакцепторное арильное замещение очень эффективно в диарильных системах, здесь оно было вредным. Замещение пара-фтор имело незначительный побочный эффект, но незначительно, тогда как замещение пара-нитро приводило к 100-кратной потере активности. В последующих исследованиях диапазон арильных заместителей был расширен, и соединения изучались в истинных TK + (тимидинкиназа компетентные) и TK- (дефицитные по тимидинкиназе) клеточные линии. Ни один из фосфорамидатов не сохранил высокую (2–4 нМ) активность AZT в компетентных клеточных линиях TK (CEM и MT-4) против ВИЧ-1 или ВИЧ-2.[3] Однако, хотя AZT потерял всю свою активность в TK-дефицитной клеточной линии CEM / TK-, большая часть фосфорамидатов сохранила противовирусную активность, таким образом, будучи примерно в 10–35 раз более активными, чем AZT в этом анализе. И снова аланин стал важным компонентом, глицин аналог неактивен в ВИЧ-инфицированных культурах CEM / TK-all. В этом анализе лейцин и фенилаланин были так же эффективны, как и аланин, хотя в анализах CEM / TK + они были менее эффективны. Таким образом, исходный фенилметоксиаланилфосфорамидат стал важным ведущим соединением.

Ставудин (d4T) был ранним применением подхода ProTide.[4] Это был рациональный выбор, основанный на известной кинетике фосфорилирования d4T. Таким образом, в то время как второе фосфорилирование (AZT-монофосфат в AZT-дифосфат), но не первое фосфорилирование (AZT в AZT-монофосфат), рассматривается как ограничение скорости активации AZT в трифосфат, считается, что первая стадия (d4T в d4T-монофосфат) в общем, будет медленным шагом для d4T. Таким образом, внутриклеточная (моно) доставка нуклеотидов должна иметь максимальное влияние на d4T и подобные нуклеозиды. В первом случае были получены (галоген) алкилоксифосфорамидаты d4T, и было обнаружено, что они сохраняют активность в d4T-устойчивых клетках JM. Активность зависела от галогеналкильной группы; исходная пропильная система малоактивна. Последующие исследования на культурах ВИЧ-инфицированных CEM / TK-клеток показали, что арилоксифосфорамидаты d4T являются высокоэффективными и, в частности, сохраняют свою полную активность в CEM / TK-клетках. В этом исследовании бензиловый эфир оказался немного более активным, чем исходное метильное соединение, почти в 10 раз более активным, чем d4T в анализах CEM / TK + и, таким образом, примерно в 300-500 раз более активным, чем d4T, в анализах CEM / TK-.
Текущие приложения
Пролекарства Protide полезны для доставки фосфонат содержащие препараты для типов клеток с высокой экспрессией CTSA и CES1, таких как иммунные клетки. Тенофовир алафенамид успешный пример этой итерации. ProTides также полезны для аналогов нуклеозидов, которые не фосфорилируются эффективно эндогенными нуклеозидкиназами. Для нуклеозида GS-334750, родительского софусбовир, фосфорилирование нуклеозидкиназами практически отсутствует, и единственный способ доставки активного нуклеотида - через ProTide. Основным ограничением ProTides является то, что они требуют экспрессии эстераз, таких как CTSA и CES1, которая очень высока в некоторых типах клеток, таких как гепатоциты, и играет важную роль в лечении Гепатит С Софосбувира.
Затем последовали обширные исследования этих многообещающих производных d4T, и технология ProTide была успешно применена к широкому спектру аналогов нуклеозидов.[5][6] В частности, подход ProTide использовался для нескольких клинически оцененных анти-ВГС нуклеозид аналоги, в том числе 2013 г. FDA утвержденный состав софосбувир, и состав, одобренный FDA 2016 г., Тенофовир алафенамид. Ремдесивир, единственный противовирусный FDA -утверждено лечить COVID-19 также использует ProTide пролекарство технологии. Потому что GS-441524 нуклеозид может фосфорилироваться и активироваться, некоторые исследователи утверждали, что протиды являются ненужным осложнением в конструкции Ремдесивира и что родительский нуклеозид был бы более дешевым и эффективным. COVID-19 препарат, средство, медикамент.[7][8]
ProTides использовались для доставки ключевых фосфорилированных метаболитов при врожденных нарушениях метаболизма, таких как фосфопантотенат для PANK2 дефицит, но они не помогли в клинике [9]
использованная литература
- ^ Макгиган, К; Pathirana, RN; Махмуд, N; Дивайн, КГ; Хэй, AJ (апрель 1992 г.). «Арилфосфатные производные AZT сохраняют активность против ВИЧ1 в клеточных линиях, устойчивых к действию AZT». Антивирусные исследования. 17 (4): 311–21. Дои:10.1016/0166-3542(92)90026-2. PMID 1642482.
- ^ Макгиган, Кристофер; Патирана, Ранджит Н .; Махмуд, Нахид; Хэй, Алан Дж. (Июль 1992 г.). «Арилфосфатные производные AZT ингибируют репликацию ВИЧ в клетках, где нуклеозид малоактивен». Письма по биоорганической и медицинской химии. 2 (7): 701–704. Дои:10.1016 / S0960-894X (00) 80395-9.
- ^ Макгиган, Кристофер; Патирана, Ранджит Н .; Бальзарини, Ян; Де Клерк, Эрик (апрель 1993 г.). «Внутриклеточная доставка биоактивных нуклеотидов AZT с помощью арилфосфатных производных AZT». Журнал медицинской химии. 36 (8): 1048–1052. Дои:10.1021 / jm00060a013.
- ^ Макгиган, Кристофер; Sheeka, Hendrika M .; Махмуд, Нахид; Хэй, Алан (июнь 1993 г.). «Фосфатные производные d4T как ингибиторы ВИЧ». Письма по биоорганической и медицинской химии. 3 (6): 1203–1206. Дои:10.1016 / S0960-894X (00) 80315-7.
- ^ Cahard, D .; McGuigan, C .; Бальзарини, Дж. (2004). «Триестеры арилокси фосфорамидата в качестве протидов». Мини-обзоры по медицинской химии. 4 (4). Дои:10.2174/1389557043403936.
- ^ Макгиган, Кристофер; Харрис, Сара А .; Daluge, Susan M .; Gudmundsson, Kristjan S .; McLean, Ed W .; Burnette, Thimysta C .; Марр, Гарри; Хейзен, Ричард; Кондрей, Линн Д .; Джонсон, Лэнс; Де Клерк, Эрик; Бальзарини, янв (май 2005 г.). «Применение технологии фосфорамидат-пронуклеотида к абакавиру приводит к значительному усилению противовирусной активности». Журнал медицинской химии. 48 (10): 3504–3515. Дои:10.1021 / jm0491400. PMID 15887959.
- ^ https://www.statnews.com/2020/05/14/gilead-should-ditch-remdesivir-and-focus-on-its-simpler-safer-ancestor/
- ^ https://pubs.acs.org/doi/10.1021/acsmedchemlett.0c00316
- ^ https://www.biospace.com/article/retrophin-stock-tanks-after-phase-iii-drug-flunks-study/#:~:text=Shares%20of%20Retrophin%20have%20plunged,not%20stack% 20up% 20против% 20плацебо. & Text = PKAN% 20is% 20a% 20rare% 2C% 20 генетическая мутация% 20in% 20the% 20PANK2% 20gene.
