Проинсулин - Proinsulin
| инсулин | |||||||
|---|---|---|---|---|---|---|---|
 Инсулин претерпевает обширную посттрансляционную модификацию по пути производства. Производство и секреция в значительной степени независимы; подготовленный инсулин хранится в ожидании секреции. И С-пептид, и зрелый инсулин являются биологически активными. Компоненты клеток и белки на этом изображении не в масштабе. | |||||||
| Идентификаторы | |||||||
| Символ | INS | ||||||
| Ген NCBI | 3630 | ||||||
| HGNC | 6081 | ||||||
| OMIM | 176730 | ||||||
| RefSeq | NM_000207 | ||||||
| UniProt | P01308 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 11 p15.5 | ||||||
| |||||||
Проинсулин это прогормон предшественник инсулин сделано в бета-клетки из островки Лангерганса, специализированные регионы поджелудочная железа. У человека проинсулин кодируется INS ген.[1][2] Островки Лангерганса секретируют только от 1% до 3% неповрежденного проинсулина.[3] Однако, поскольку у проинсулина более длительный период полураспада, чем у инсулина, он может составлять от 5 до 30% инсулиноподобных структур, циркулирующих в крови.[3] Концентрация проинсулина выше после еды и ниже, когда человек постится.[3] Кроме того, хотя проинсулин и инсулин имеют структурные различия, проинсулин действительно демонстрирует некоторое сродство к рецептор инсулина. Из-за относительного сходства в структуре проинсулин может производить от 5% до 10% метаболической активности, аналогично индуцируемой инсулином.[3]
Проинсулин - это последняя одноцепочечная структура белка, секретируемая клетками перед расщеплением на зрелый инсулин.[4] Проинсулин был открыт профессором Дональд Ф. Штайнер Чикагского университета в 1967 году.[5]
Структура
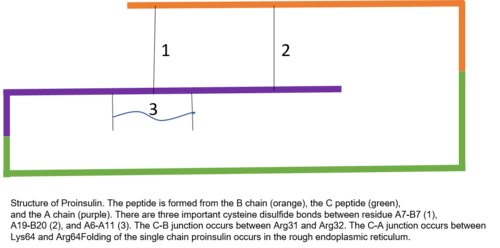
Проинсулин состоит из 81 остатки (у коров, 86 у человека[6]) и образован тремя отдельными цепями.[7] Цепь A, цепь B и область, соединяющая их, называются С пептид.[7] Правильная структура проинсулина имеет решающее значение для правильного сворачивания зрелого инсулина, поскольку размещение C-пептида настраивает молекулу для создания правильно расположенного дисульфидные связи между цепями A и B.[7][8] Для того, чтобы зрелый инсулин имел правильную структуру, необходимы три дисульфидные связи. Две из этих дисульфидных связей находятся между цепями A и B, а одна является связью внутри цепи A.[7] Дисульфидные связи возникают между седьмыми остатками цепи А и В, 19 остатком цепи А и 20 остатком цепи В, а также 6-м и 11-м остатками цепи А.[9]
Пептид C находится между цепями A и B проинсулина.[7] Связь между цепью A и пептидом C намного более стабильна, чем соединение между пептидом C и цепью B, с альфа-спиральными особенностями, проявляющимися рядом с соединением цепи C пептид-A.[10] Соединение цепи C-пептид-A происходит между остатками 64 и 65 проинсулина. Это лизин и аргинин молекулы соответственно.[10] Связь С-пептид-В-цепь находится между двумя остатками аргинина в положениях 31 и 32 проинсулина.[10]
Существует консервация большей части структуры проинсулина среди видов млекопитающих, при этом большая часть изменений остатков, наблюдаемых от одного вида к другому, присутствует в С-пептиде.[8][11] Тем не менее, остатки С-пептида, которые являются консервативными для разных видов, взаимодействуют с аналогичным образом консервативными остатками в цепях A и B.[8] Таким образом, предполагается, что эти консервативные остатки важны для функциональности зрелого инсулина.[8]
Синтез и посттрансляционная модификация
Проинсулин синтезируется на мембранно-ассоциированных рибосомах, обнаруженных на шероховатой эндоплазматической сети, где он сложен и его дисульфидные связи окисляются. Затем он транспортируется в аппарат Гольджи где он упакован в секреторные везикулы и где он обрабатывается серией протеаз с образованием зрелых инсулин. В зрелом инсулине на 35 аминокислот меньше; 4 удаляются совсем, а оставшиеся 31 образуют С-пептид. С-пептид извлекается из центра последовательности проинсулина; два других конца (цепь B и цепь A) остаются связанными дисульфидными связями.
В пост-переводная модификация Превращение проинсулина в зрелый инсулин происходит только в бета-клетках островков Лангерганса.[12] Когда проинсулин транспортируется через аппарат Гольджи, С-пептид расщепляется.[9] Это расщепление происходит с помощью двух эндопротеаз.[13] Тип I эндопротеазы, ПК1 и PC3, нарушают связь цепи C-пептид-B.[13] РС2, эндопротеаза типа II, расщепляет связь цепи С-пептид-А.[13] Полученная молекула, теперь зрелый инсулин, хранится в виде гексамера в секреторные пузырьки и стабилизируется ионы, пока не секретируется.[9]
Иммуногенность
Когда инсулин был первоначально очищен от бык или же свинья поджелудочной железы, весь проинсулин удален не полностью.[14][15] Когда некоторые люди использовали эти инсулины, проинсулин мог вызвать реакцию организма с появлением сыпи, сопротивлением инсулину или даже образованием вмятин или бугорков на коже в месте введения инсулина. Это можно описать как ятрогенный травма из-за незначительных различий между проинсулином разных видов. С конца 1970-х годов, когда высокоочищенный свинья Был введен инсулин, и уровень чистоты инсулина достиг 99%, это перестало быть существенной клинической проблемой.[16] Следует также отметить, что в отношении их влияния на фармакокинетику инсулина умеренные концентрации определенных антител к инсулину могут фактически иметь положительное преимущество для всех диабетиков без эндогенной секреции инсулина (например, людей с диабет 1 типа ), потому что инсулин-связывающие антитела эффективно увеличивают скорость клиренса и пространство распределения инсулина и, следовательно, помогают продлить его фармакологический и биологический период полураспада.[17][требуется разъяснение ]
Медицинское значение
Исторически сложилось так, что в центре внимания многих метаболических заболеваний, связанных с инсулином, был зрелый инсулин. Однако в последние годы важность изучения структуры и функции проинсулина в отношении этих заболеваний становится все более очевидной.
Сахарный диабет
Повышенный уровень проинсулина в сердечно-сосудистая система относительно зрелых концентраций инсулина может указывать на надвигающееся резистентность к инсулину и развитие диабет 2 типа.[18] Дополнительные проблемы с проинсулином, которые могут привести к диабету, включают мутации в количестве присутствующих цистеинов, которые могут повлиять на правильную укладку.[9] Если мутация вызывает только легкие изменения, она может просто усилить способность эндоплазматического ретикулума правильно сворачивать белок.[9] Этот стресс через некоторое время приведет к уменьшению количества β-клетки продуцирует зрелый инсулин, что приведет к сахарному диабету.[9]
Неонатальный сахарный диабет
Постнатальный проинсулин имеет решающее значение для регуляции метаболизма. Однако проинсулин в новорожденные важен для нормального развития глазных нервов, сердца и общего выживания эмбриональных клеток.[19] Регулирование концентрации проинсулина во время эмбрионального развития имеет решающее значение, так как слишком много или слишком мало пептида может вызвать дефекты и смерть плода.[19] До сих пор при изучении неонатального сахарного диабета только мутации с заменой аминокислот, обнаруженные в B-домене, приводили к заболеванию.[9]
Смотрите также
- инсулин
- препроинсулин
- сигнальный пептид
- сигнальная пептидная пептидаза
- пропротеин конвертаза 1 (ПК1)
- пропротеин конвертаза 2 (ПК2)
Рекомендации
- ^ «Энтрез Джин: инсулин INS».
- ^ Белл Г.И., Пикте Р.Л., Раттер В.Дж., Корделл Б., Тишер Э., Гудман Х.М. (март 1980 г.). «Последовательность гена человеческого инсулина». Природа. 284 (5751): 26–32. Bibcode:1980Натура 284 ... 26Б. Дои:10.1038 / 284026a0. PMID 6243748. S2CID 4363706.
- ^ а б c d «Интерпретация для проинсулина 80908, плазма». www.mayomedicallaboratories.com. Получено 2017-03-09.
- ^ Ассали Н.С., Кларк К.Э., Зугаиб М., Бринкман С.Р., Нувайхид Б. (1995). «Влияние эстрогенных гормонов на маточно-плацентарную гемодинамику и выработку прогестерона у овец». Международный журнал фертильности. 23 (3): 219–23. PMID 40897.
- ^ Филипсон Л.Х., Белл Г., Полонский К.С. (январь 2015 г.). "Дональд Ф. Штайнер, доктор медицины, 1930-2014: первооткрыватель проинсулина". Труды Национальной академии наук Соединенных Штатов Америки. 112 (4): 940–1. Bibcode:2015ПНАС..112..940П. Дои:10.1073 / pnas.1423774112. ЧВК 4313841. PMID 25561547.
- ^ Регистрационный номер универсального белкового ресурса P01308 для "INS_HUMAN" в UniProt.
- ^ а б c d е Нолан Ч., Марголиаш Э., Петерсон Дж. Д., Штайнер Д. Ф. (май 1971 г.). «Структура бычьего проинсулина». Журнал биологической химии. 246 (9): 2780–95. PMID 4928892.
- ^ а б c d Снелл CR, Смит Д.Г. (август 1975 г.). «Проинсулин: предлагаемая трехмерная структура». Журнал биологической химии. 250 (16): 6291–5. PMID 808541.
- ^ а б c d е ж грамм Weiss MA (июль 2009 г.). «Проинсулин и генетика сахарного диабета». Журнал биологической химии. 284 (29): 19159–63. Дои:10.1074 / jbc.R109.009936. ЧВК 2740536. PMID 19395706.
- ^ а б c Ян Й, Хуа QX, Лю Дж, Симидзу Э., Чокетт М. Х., Макин РБ, Вайс Массачусетс (март 2010 г.). «Структура раствора проинсулина: соединяющая гибкость домена и процессинг прогормона». Журнал биологической химии. 285 (11): 7847–51. Дои:10.1074 / jbc.c109.084921. ЧВК 2832934. PMID 20106974.
- ^ Белл Г.И., Пикте Р.Л., Раттер В.Дж., Корделл Б., Тишер Э., Гудман Х.М. (март 1980 г.). «Последовательность гена человеческого инсулина». Природа. 284 (5751): 26–32. Bibcode:1980Натура 284 ... 26Б. Дои:10.1038 / 284026a0. PMID 6243748. S2CID 4363706.
- ^ Groskreutz DJ, Sliwkowski MX, Gorman CM (февраль 1994 г.). «Генетически модифицированный проинсулин, который постоянно перерабатывается и секретируется в виде зрелого активного инсулина» (PDF). Журнал биологической химии. 269 (8): 6241–5. PMID 8119968.
- ^ а б c Кауфманн Дж. Э., Ирмингер Дж. К., Халбан П. А. (сентябрь 1995 г.). «Требования к последовательности для процессинга проинсулина на стыке В-цепь / С-пептид». Биохимический журнал. 310 (Pt 3) (3): 869–74. Дои:10.1042 / bj3100869. ЧВК 1135976. PMID 7575420.
- ^ Уилсон Р.М., Дуглас Калифорния, Таттерсолл Р.Б., Ривз В.Г. (сентябрь 1985 г.). «Иммуногенность высокоочищенного бычьего инсулина: сравнение с обычным бычьим инсулином и высокоочищенным человеческим инсулином». Диабетология. 28 (9): 667–70. Дои:10.1007 / BF00291973. PMID 3905477.
- ^ Tanyolac S, Goldfine ID, Kroon L. «Фармакология инсулина, схемы и корректировки». Endotext.com. Архивировано из оригинал на 2011-07-25. Получено 2011-03-18.
- ^ Домашний PD, Альберти К.Г. (ноябрь 1982 г.). «Новые инсулины. Их характеристика и клинические показания». Наркотики. 24 (5): 401–13. Дои:10.2165/00003495-198224050-00003. PMID 6756879. S2CID 28616749.
- ^ Грей Р.С., Коуэн П., ди Марио Ю., Элтон Р.А., Кларк Б.Ф., Дункан Л.Дж. (июнь 1985 г.). «Влияние антител к инсулину на фармакокинетику и биодоступность рекомбинантных человеческих и высокоочищенных инсулинов говядины у инсулинозависимых диабетиков». Британский медицинский журнал. 290 (6483): 1687–91. Дои:10.1136 / bmj.290.6483.1687. ЧВК 1416075. PMID 3924216.
- ^ Mykkänen L, Haffner SM, Hales CN, Rönnemaa T, Laakso M (декабрь 1997 г.). «Взаимосвязь проинсулина, инсулина и отношения проинсулина к инсулину с чувствительностью к инсулину и острым ответом на инсулин у нормогликемических субъектов». Сахарный диабет. 46 (12): 1990–5. Дои:10.2337 / diab.46.12.1990. PMID 9392485. S2CID 44874023.
- ^ а б Эрнандес-Санчес С., Мансилла А., де ла Роса Е.Дж., де Пабло Ф. (июнь 2006 г.). «Проинсулин в разработке: новые роли древнего прогормона». Диабетология. 49 (6): 1142–50. Дои:10.1007 / s00125-006-0232-5. PMID 16596360.