Уменьшение с помощью гидросиланов - Reductions with hydrosilanes
Уменьшение с помощью гидросиланов химические реакции, которые включают комбинацию гидросилана (R3SiH) с органическим субстратом, содержащим ненасыщенную или электроноакцепторную функциональность. В результате получаются продукты, в которых электроноакцепторная группа заменена водородом или ненасыщенная группа гидрирована.[1] Восстановление с помощью гидросиланов имеет только специализированное применение. Напротив, связанные гидросиляция алкенов является основой основных технологий.
Механизм
Поскольку кремний (1,90) более электроположителен, чем водород (2,20), гидросиланы обладают гидридным характером. Гидросиланы могут служить донорами гидридов для высокоэлектрофильных органических субстратов. Подходящими субстратами являются спирты, алкилгалогениды, ацетали, сложные ортоэфиры, алкены, альдегиды, кетоны и производные карбоновых кислот. Такие реакции требуют Кислоты Льюиса или активирующий нуклеофил (чаще всего фторид). Поскольку восстановлению подвергаются только реакционноспособные электрофилы, селективность возможна в реакциях субстратов с несколькими восстанавливаемыми функциональными группами. Хиральные кислоты Льюиса и комплексы металлов могут быть использованы для энантиоселективного восстановления кетонов гидросиланами.[2]
(1)

При образовании карбокатиона происходит определяющий скорость перенос гидрида из органосилана с образованием восстановленного продукта. Сохранение конфигурации кремния наблюдалось при силановом восстановлении хиральных триарилметилхлоридов в бензоле. Этот результат предполагает, что обмен хлора на водород происходит через метатезис σ-связи.[3] Уменьшение количества более полярных растворителей может включать ионы силицения.[4]
(2)

Восстановление, стимулированное фторидом, происходит через гипервалентные фторсиликаты (R3Si (F) H−).[5]
(3)

Стереоселективность
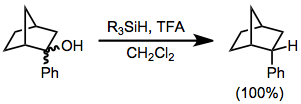
При восстановлении органосиланом субстратов, несущих простереогенные группы, диастереоселективность часто бывает высокой. Восстановление любого диастереомера 2-фенил-2-норборнанола приводит исключительно к эндо диастереомер 2-фенилнорборнана.[6] Ни один из экзо диастереомер.
(4)
Энантиоселективное восстановление кетонов может быть достигнуто за счет использования каталитических количеств хиральных комплексов переходных металлов. В некоторых случаях переходный металл просто служит кислотой Льюиса, которая координируется с кислородом кетона; однако некоторые металлы (в первую очередь медь) реагируют с гидросиланами с образованием промежуточных соединений гидрида металла, которые действуют как активный восстанавливающий агент.[7]
(5)

В присутствии родиевого катализатора 1 и трихлорид родия, 2-фенилциклогексанон восстанавливается без диастереоселективности, но с высокой энантиоселективностью.[8]
(6)

Объем и ограничения
Органосиланы используются для восстановления спиртов до алканов в присутствии сильной кислоты Льюиса. Могут также использоваться кислоты Бренстеда, хотя катионные перегруппировки скелета[9] и нуклеофильная атака конъюгированной основы на карбокатион[10] может быть проблематично. Скорость восстановления увеличивается с увеличением замещения у углерода спирта - третичные спирты легко восстанавливаются эфиратом трифторида бора.[11] но для первичных спиртов требуется избыток силана, более сильная кислота Льюиса и более длительное время реакции.[12]

(7)
Аллиловые спирты могут быть дезоксигенированы в присутствии третичных спиртов, когда используется эфирный перхлорат лития.[13]
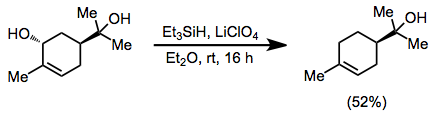
(8)
Восстановление алкилгалогенидов и трифлатов в целом дает более низкие выходы, чем восстановление спиртов. Кислота Льюиса, обычно хлорид или бромид алюминия (III), требуется независимо от схемы замещения алкилгалогенида. Бензилгалогениды могут быть восстановлены трифторуксусной кислотой (TFA) с высоким выходом.[14]

(9)
Гидросиланы особенно полезны для восстановления 1,1-дизамещенных двойных связей, которые образуют стабильные третичные карбокатионы при протонировании. Тризамещенные двойные связи можно избирательно восстанавливать в присутствии 1,2-дизамещенных или монозамещенных алкенов.[15]

(10)
В частности, ароматические соединения можно восстановить с помощью TFA и триэтилсилана. Заменен фураны восстанавливаются до производных тетрагидрофурана с высоким выходом.[16]
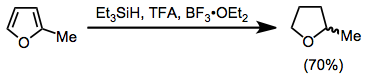
(11)
Сложные эфиры могут быть восстановлены до спиртов в условиях нуклеофильной активации фторидом цезия или калия.[17]

(12)
Альдегиды подвергаются гидросилилированию в присутствии гидросиланов и фторида. Полученные силиловые эфиры можно гидролизовать 1 М соляной кислотой. Оптимальные выходы гидросилилирования достигаются, когда реакцию проводят в очень полярных растворителях.[18]
(13)
Ацетали, кетали и аминали восстанавливаются в присутствии гидросиланов и кислоты. Сообщалось о сайт-селективном восстановлении ацеталей и кеталей, атомы кислорода которых неэквивалентны - приведенный ниже пример используется в синтезе Тамифлю.[19]

(14)
Другие функциональные группы, восстановленные гидросиланами, включают амиды,[20] α, β-ненасыщенные амиды,[21] и α, β-ненасыщенные сложные эфиры[22] енамины,[23] имины,[24] и азиды.[25]
Приложения
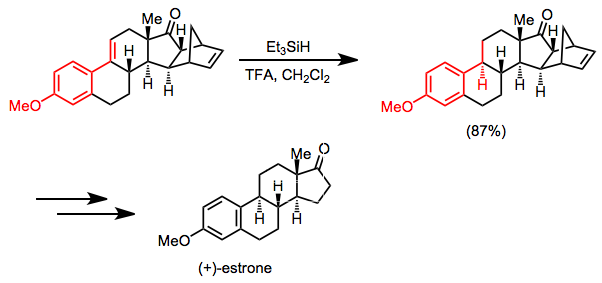
Синтез (+) - эстрона основан на селективном восстановлении гидросиланом сопряженного алкена как ключевой стадии. Карбонил кетона и изолированная двойная связь не затрагиваются в показанных условиях.[26]
(15)
Сравнение с другими методами
Известно множество альтернативных методов энантиоселективного восстановления двойных связей. В большинстве из них используются каталитические количества комплекса переходного металла и газообразный водород в качестве восстановителя. Например, иридиевые комплексы хиральных фосфин-оксазолиновых лигандов катализируют гидрирование тризамещенных алкенов с высоким выходом и энантиоселективностью.[27]
(16)

Кетоны могут быть восстановлены с использованием любого метода гидрогенизации с переносом.[28] или с водородом в присутствии родиевых катализаторов. В приведенном ниже примере используется лиганд PennPhos.[29]
(17)

Типичные условия
Сильные кислоты, такие как трифторуксусная кислота, часто используются для восстановления гидросилана, и с ними следует обращаться с особой осторожностью. Гидросиланы подвергаются гидролизу в сильной кислоте или основании (с образованием газообразного водорода); таким образом, во время этих реакций важно поддерживать безводные условия. Силаны с низким молекулярным весом часто бывают пирофорными. Полимерные гидросиланы, такие как полиметилгидросилоксан (ПГМС) может использоваться для облегчения отделения восстановленных продуктов от кремнийсодержащих побочных продуктов.[30][31]
(18)
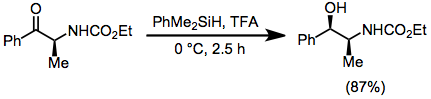
Рекомендации
- ^ л. Ларсон, Джеральд; л. Фрай, Джеймс (2008). «Ионное и металлоорганическое-катализируемое восстановление органосилана». Органические реакции: 1–737. Дои:10.1002 / 0471264180.or071.01. ISBN 978-0471264187.
- ^ Hayashi, T .; Hayashi, C .; Уодзуми, Ю. Тетраэдр: асимметрия 1995, 6, 2503.
- ^ Austin, J.D .; Иборн, К. J. Chem. Soc. 1964, 2279.
- ^ Sommer, L.H .; Баумана, Д. Варенье. Chem. Soc. 1969, 91, 7045.
- ^ Chuit, C .; Corriu, R. J. P .; Perz, R .; Рейе, К. Синтез 1982, 981.
- ^ Кэри, Ф. А .; Тремпер, Х.С. J. Org. Chem. 1969, 34, 4.
- ^ Lipshutz, B.H .; Noson, K .; Chrisman, W .; Нижний, А. Варенье. Chem. Soc. 2003, 125, 8779.
- ^ Nishiyama, H .; Парк, С.-Б .; Ито, К. Тетраэдр: асимметрия 1992, 3, 1029.
- ^ Adlington, M. G .; Orfanopoulos, M .; Фрай, Дж. Л. Tetrahedron Lett. 1976, 2955.
- ^ Doyle, M. P .; МакОскер, К. J. Org. Chem. 1978, 43, 693.
- ^ Kraus, G.A .; Молина, М. Т .; Уоллинг, Дж. А. J. Chem. Soc., Chem. Commun. 1986, 1568.
- ^ Геворгян, В .; Рубин, М .; Benson, S .; Liu, J.-X .; Ямамото, Ю. J. Org. Chem. 2000, 65, 6179.
- ^ Wustrow, D. J .; Smith, III, W.J .; Мудрый, Л. Д. Tetrahedron Lett. 1994, 35, 61.
- ^ Barclay, L.R.C .; Sonawane, H.R .; Макдональд, М.С. Может. J. Chem. 1972, 50, 281.
- ^ Курсанов, Д. Н .; Parnes, Z. N .; Болестова, Г.И. Докл. Акад. Наук. СССР Chem. (Англ. Пер.) 1968, 181, 726.
- ^ Болестова, Г. И .; Parnes, Z. N .; Курсанов, Д.Н. J. Org. Chem. СССР (англ. Пер.) 1979, 15, 1129.
- ^ Corriu, R. J. P .; Perz, R .; Рей, К. Тетраэдр 1983, 39, 999.
- ^ Fujita, M .; Хияма, Т. J. Org. Chem. 1988, 53, 5405.
- ^ Federspiel, M .; Fischer, R .; Hennig, M .; Mair, H.-J .; Оберхаузер, Т .; Rimmler, G .; Albiez, T .; Bruhin, J .; Estermann, H .; Gandert, C .; Göckel, V .; Götzö, S .; Hoffmann, U .; Huber, G .; Janatsch, G .; Lauper, S .; Röckel-Stäbler, O .; Trussardi, R .; Звален, А.Г. Орг. Процесс Res. Dev. 1999, 3, 266.
- ^ Selvakumar, K .; Харрод, Дж. Ф. Энгью. Chem. Int. Эд. 2001, 40, 2129.
- ^ Keinan, E .; Перес, Д. J. Org. Chem. 1987, 52, 2576.
- ^ Ojima, I .; Кумагаи, М. J. Organomet. Chem. 1976, 111, 43.
- ^ Ростентретер, У. Синтез 1985, 210.
- ^ Лойм, Н.М. Бык. Акад. Sci. СССР, Див. Chem. Sci. (Англ. Пер.) 1968, 1345.
- ^ Chandrasekhar, S .; Chandraiah, L .; Редди, гл. Р.; Редди, М.В. Chem. Lett. 2000, 780.
- ^ Takano, S .; Мория, М .; Огасавара, К. Tetrahedron Lett. 1992, 33, 1909.
- ^ Liu, D .; Tang, W .; Чжан, X. Орг. Lett. 2004, 6, 513.
- ^ Jiang, Y .; Jiang, Q .; Чжан, X. Варенье. Chem. Soc. 1998, 120, 3817.
- ^ Jiang, Q .; Jiang, Y .; Xiao, D .; Cao, P .; Чжан, X. Энгью. Chem. Int. Эд. 1998, 37, 1100.
- ^ Pri-Bar, I .; Бухман, О. J. Org. Chem. 1986, 51, 734.
- ^ Fujita, M .; Хияма, Т. J. Org. Chem. 1988, 53, 5415.





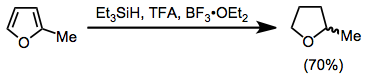

![{ displaystyle { ce {{ mathit {n}} - C10H21CHO}} + { color {Blue} { ce {PhMe2Si}}} { ce {H -> [{ ce {TBAF}}] [ { ce {rt}}] { mathit {n}} - C10H21CH2O}} { color {Синий} { ce {SiMe2Ph}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9215e2c1a06a3a1733ad5394e9b472acfb6daa54)

