Расширение и сжатие кольца - Ring expansion and contraction
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
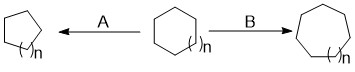
Расширение кольца и сжатие кольца реакции в ходе органический синтез относятся к набору реакций, которые могут привести к расширению или сжатию существующего звенеть. Это часто позволяет получить доступ к структурам, которые было бы трудно, если вообще возможно, синтезировать с помощью одного реакции циклизации. Расширения кольца ценны, потому что они позволяют получить доступ к более крупным системам, которые трудно синтезировать с помощью одной циклизации из-за низкой скорости образования. Кольцевые сокращения полезны для того, чтобы делать меньше, больше натянутые кольца из более крупных колец. Расширения классифицируются по механизму расширения и добавленным атомам; сокращения характеризуются просто реактивным промежуточным звеном, которое выполняет сокращение.
Описание
В ходе органический синтез, химику часто нужно создать новое или изменить существующее кольцо. Реакции расширения и сжатия кольца используются для расширения или сжатия существующего звенеть, часто позволяя получить доступ к структурам, которые было бы трудно, если вообще возможно, синтезировать с помощью одного реакции циклизации.
Реакции расширения кольца
Кольцевые расширения ценны, потому что они позволяют получить доступ к более крупным системам, которые трудно синтезировать посредством однократной циклизации из-за медленной скорости образования (семичленные и более крупные кольца).[1] Классификация кольцевых расширений по механизму расширения и добавленному (ым) атому (ам) позволяет увидеть сходство между различными методами расширения и разными включенными атомами. Самая широкая классификация происходит по механизму расширения. Кольца могут быть расширены путем атаки кольца на внешнюю группу, уже присоединенную к кольцу ( миграция / вставка), открытие велосипеда на одно кольцо большего размера или соединение замыкающего кольца с расширением.[2] Эти расширения могут быть далее разбиты по типу атома, который они включают (углерод или гетероатом) в расширенное кольцо.
Реакции внедрения углерода
Внедрения углерода представляют собой чрезвычайно полезные реакции, которые вводят дополнительный атом углерода в кольцо. Эти реакции используются при синтезе многих лекарств и натуральных продуктов.[2] Они могут осуществляться с помощью любого из механизмов, перечисленных ниже.
Внедрение углерода в результате миграции в экзоциклическую группу
Эти реакции имеют общие черты наличия экзоциклической уходящей группы на атоме углерода, примыкающем к кольцу, и электронодонорной группы на кольце, способной инициировать миграцию эндоциклической связи.
Обычным миграционным введением углерода является пинакольная перегруппировка.[2] Хотя эта реакция конкретно относится к перегруппировке вицинального дигидроксида, существуют и другие перегруппировки типа пинакола, которые протекают через тот же общий механизм, такой как Перестановка Тиффно-Демьянова. Эти перегруппировки семипинакола происходят в более мягких условиях и, таким образом, предпочтительны в сложных синтезах.[3] Эти реакции полезны помимо простого расширения кольца, потому что атакованная экзоциклическая группа может также иметь другие функциональные группы, добавленные к ней, помимо уходящей группы. Группа, к которой мигрирует эндоциклическая связь, также может быть выборочно добавлена к кольцу на основе уже присутствующей функциональности, например 1,2 сложение в циклический кетон.
Вставка углерода через отверстие велосипеда
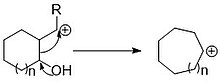
Введение углерода через открытие бициклическая система - это еще один способ ввести в кольцо один или несколько атомов углерода за раз. Введение единственного углерода часто проходит через циклопропан содержащий бициклический промежуточный продукт, который впоследствии открывается с образованием расширенного кольца. Расширение может происходить либо через раскрытие электроциклического кольца, либо за счет индуцированного разрыва общей связи.
Эти реакции различаются по способу добавления углерода для образования циклопропанового кольца. А Симмонс-Смит подобная реакция с алкенсодержащим кольцом может быть использована для введения одного углерода. Существуют и другие методы циклопропантации других функциональных возможностей, такие как Расширение кольца Бюхнера для нуклеофильной атаки (A) и донорства соседней группы (B). Образование циклопропанового кольца при одном расширении углерода позволяет вводить дополнительную функциональность вместе с расширением кольца, при условии, что дополнительная функциональность присоединена к вставляемому атому углерода. Мишень циклопропанирования также варьируется в зависимости от используемых условий. Реакция Симмонса-Смита добавляет к алкенам, тогда как расширение кольца Бюхнера позволяет добавлять обычно нереактивные арены. Расширение кольца Бюхнера полезно, потому что оно дает циклогептатриены в качестве продуктов с раскрытым циклом, которые находятся в ядре некоторых природных продуктов, таких как азулены. Важным соображением в этих расширениях кольца является раскрытие кольца в расширенное кольцо, а не экзоциклическая группа в исходном кольце или неоткрывающийся продукт. Расширение кольца Бюхнера поощряется к открытию желаемого продукта за счет размещения электроноакцепторных групп на добавляемом угле. Чтобы выполнить раскрытие кольца на насыщенных бициклических молекулах, циклопропан должен быть введен таким образом, чтобы соседняя группа могла способствовать расширению, или кольцо должно быть раскрыто путем атаки расширения.[4] или кольцо должно быть открыто атакой со стороны внешней группы.[5]
Размыкание кольца как средство расширения кольца также может применяться в более крупных системах, чтобы обеспечить доступ к еще большей сисциклизации кольца. В качестве примера такого расширения можно применить фрагментацию Гроба. Подобно миграции пинаколового типа, фрагментация Grob опирается на группу донора электронов, которая способствует миграции связей и побуждает уходящую группу к изгнанию. В этом случае электронодонорная группа может быть псевдодонорной группой, которая способна отщеплять и отдавать электронную пару в углерод с разрывающейся связью. Работа с двумя меньшими кольцами может позволить разработать две части молекулы отдельно перед работой с расширенным кольцом. Расширение кольца Дауда-Беквита также способно добавлять несколько атомов углерода к кольцу за раз, например, добавлять несколько атомов углерода к кольцу за раз, и является полезным инструментом для изготовления больших колец.[6] Пока он проходит через промежуточный велосипед, окончательная циклизация и раскрытие кольца происходят в том же самом радикальная реакция.[7] Это расширение полезно, потому что оно позволяет расширять бета-кетоэфир до большого циклического кетона, который может быть легко получен с использованием либо циклического кетона, либо экзоциклического сложного эфира.

Реакции внедрения гетероатома
Присоединения гетероатомов к кольцам могут происходить за счет расширения кольца, если не за счет синтеза кольца de novo.[8] Эти введения в основном представляют собой расширения кольца, потому что они часто происходят через пути миграции / внедрения, аналогичные тем, которые упоминались выше для углерода. Примеры включают высокоэффективные приложения Перестановка Бекмана (для введения азота в кодеин)[9] и Окисление Байера-Виллигера (введение кислорода в эфиры с аннелированными клетками)[10] в синтезе. Оба происходят с вытеснением уходящей группы, когда алкильная группа мигрирует на экзоциклический гетероатом, что поразительно похоже на перегруппировку пинакольного типа.
Реакции сжатия кольца

Сжатие колец полезно для изготовления колец меньшего размера с большей натяжкой из колец большего размера. Стимул к созданию этих колец исходит из трудностей, связанных с созданием полностью разработанного маленького кольца, когда такое кольцо может быть более легко сделано из более крупного кольца, из которого может быть вырезан атом, или что исходный более крупный каркас более доступен .[11]
Кольцевые сжатия легко описываются реактивным промежуточным звеном, которое выполняет сжатие. Стандартные промежуточные соединения - анионные, катионные и карбеноидные.[12]
Анионные сокращения
В Перестановка Фаворского является дочерним элементом сжатия анионного кольца.[13] Он проходит через карбанион, который атакует эндоциклический углерод и вытесняет уходящую группу (галогенид), образуя бициклическую молекулу с кольцами меньшего размера, чем исходный. Затем велосипед открывается путем нуклеофильной атаки на кетон, чтобы получить сокращенный продукт.
Альтернативой стандартной перегруппировке Фаворского является выполнение того, что можно рассматривать как отрицательную пинакольную перегруппировку, когда анионная группа стимулирует связь, выровненную с уходящей группой, для миграции и удаления уходящей группы, что использовалось в нескольких синтезах.[12] Следует также отметить, что так называемая «квази-фаворская перегруппировка» протекает без дополнительного нуклеофила с образованием конечного сокращенного продукта.

Катионные сокращения
Сокращение катионной перегруппировки происходит за счет потери уходящей группы и миграции эндоциклической связи к карбокатиону. Для этого типа сокращения часто используются перестройки типа пинакола.[14] Подобно реакции расширения, это происходит с помощью донорной группы электронов, помогающей в миграции.
Реакции сжатия одного кольца могут сочетаться с расширением другого, что дает неравный велосипед из сплавленного кольца одинакового размера. Эти катионные перегруппировки нашли применение для синтеза ядер сложных молекул.[15]
Карбеноидные сокращения
В Перестановка Вольфа может использоваться для выполнения кольцевых сокращений. Это происходит через карбеноид, образующийся при разложении диазокетона, который вставляется в углерод-углеродную связь на противоположной стороне кетона.[16]
Рекомендации
- ^ Casadei, M.A .; Calli, C .; Мандолини, Л. (1 февраля 1984 г.). «Реакции замыкания кольца. 22. Кинетика циклизации диэтил (омега-бромалкил) малонатов в диапазоне от 4 до 21-членных колец. Роль кольцевого штамма». Журнал Американского химического общества. 106 (4): 1051–1056. Дои:10.1021 / ja00316a039.
- ^ а б c Kantorowski, E.J .; Курт, М.Дж. (2000). «Расширение до семичленных колец» (PDF). Тетраэдр. 56 (26): 4317–4353. Дои:10.1016 / S0040-4020 (00) 00218-0.
- ^ Kurti, L .; Чако, Б. (2005). Стратегические приложения именованных реакций. Эльзевир. п. 350. ISBN 978-0-12-429785-2. OCLC 1107566236.
- ^ Bieräugel, H .; Аккерман, Дж. М .; Armande, J. C. L .; Пандит, У. К. (1974). «Специфическая вставка карбенов в углерод-углеродные связи». Буквы Тетраэдра. 15 (33): 2817–2820. Дои:10.1016 / S0040-4039 (01) 91751-4.
- ^ Hoberg, J.O .; Бозелл, Дж. Дж. (Сентябрь 1995 г.). «Циклопропанирование и расширение кольца ненасыщенных сахаров». Буквы Тетраэдра. 36 (38): 6831–6834. Дои:10.1016 / 0040-4039 (95) 01387-В.
- ^ Hierold, J .; Луптон, Д.В. (Июль 2012 г.). "Синтез спироциклических γ-лактонов каскадным расширением / циклизацией кольца Беквита-Дауда". Органические буквы. 14 (13): 3412–3415. Дои:10.1021 / ol301387t. PMID 22691029.
- ^ Dowd, P .; Чой; S. C. J. Am. Chem. Soc. 1987, 3493–3494
- ^ Макмерри, Джон (2008). Органическая химия, 7-е изд.. С. 945–946. ISBN 978-0-495-11258-7.
- ^ White, J.D .; Hrnciar, P .; Стаппенбек, Ф. (1999). «Асимметричный полный синтез (+) - кодеина посредством внутримолекулярного введения карбеноидов». Журнал органической химии. 63 (21): 7871–7884. Дои:10.1021 / jo990905z.
- ^ Marchand, A.P .; Кумар, В. С .; Харипракаша, Х. К. (2001). «Синтез новых клеточных оксагетероциклов». Журнал органической химии. 66 (6): 2072–2077. Дои:10.1021 / jo001611c. PMID 11300903.
- ^ Сильва, Л.Ф. Тетраэдр 2002, 9137–9161[требуется полная цитата ]
- ^ а б Майерс, Эндрю. «Способы сжатия кольца» (PDF). Получено 30 ноября, 2014 - через факультет химии и химической биологии Гарвардского университета.
- ^ Шенье, Филип Дж. (1978). "Перегруппировка Фаворского в мостиковых полициклических соединениях". Журнал химического образования. 55 (5): 286–291. Bibcode:1978JChEd..55..286C. Дои:10.1021 / ed055p286.
- ^ Сун, Чжэнь-Лэй; Фань, Чун-Ан; Ту, Юн-Цян (2011). «Перегруппировка семипинакола в синтезе природных продуктов». Химические обзоры. 111 (11): 7523–7556. Дои:10.1021 / cr200055g. PMID 21851053.
- ^ Büchi, G .; Hofheinz, W .; Паукстелис, Дж. В. (ноябрь 1969 г.). «Синтез (-) - ароматендрена и родственных сесквитерпенов». Журнал Американского химического общества. 91 (23): 6473–6478. Дои:10.1021 / ja01051a051.
- ^ Кирмс, В. (июль 2002 г.). «100 лет перестановки Вольфа». Европейский журнал органической химии. 2002 (14): 2193. Дои:10.1002 / 1099-0690 (200207) 2002: 14 <2193 :: AID-EJOC2193> 3.0.CO; 2-D.
