Уравнение Тафеля - Tafel equation
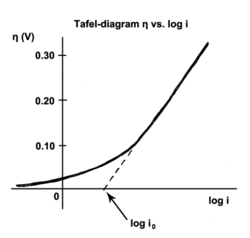
В Уравнение Тафеля это уравнение в электрохимическая кинетика относящиеся к ставке электрохимический реакция на перенапряжение.[1] Уравнение Тафеля сначала было выведено экспериментально, а позже было показано, что оно имеет теоретическое обоснование. Уравнение названо в честь швейцарского химика. Юлиус Тафель.
«Он описывает, как электрический ток через электрод зависит от разницы напряжений между электродом и основным электролитом для простой мономолекулярной окислительно-восстановительной реакции».[2][циркулярная ссылка ]
Когда электрохимическая реакция происходит в двух половина реакции на отдельных электроды, уравнение Тафеля применяется к каждому электроду отдельно. На одном электроде уравнение Тафеля можно записать как:
(1)
куда
- знак плюс под показателем степени относится к анодной реакции, а знак минус к катодной реакции[3][циркулярная ссылка ],
- : перенапряжение
- : "Тафелевый склон ", V
- : плотность тока, Являюсь2
- : "плотность тока обмена ", Являюсь2.
Здесь можно найти подтверждение и дальнейшее объяснение этого уравнения.[4] Уравнение Тафеля - это приближение Батлера-Фольмера уравнение в случае .
«[Уравнение Тафеля] предполагает, что концентрации на электроде практически равны концентрациям в объеме электролита, что позволяет выражать ток только как функцию потенциала. Другими словами, предполагается, что скорость массопереноса электрода равна намного больше, чем скорость реакции, и что в реакции преобладает более медленная скорость химической реакции ".[5][циркулярная ссылка ]
Кроме того, для данного электрода уравнение Тафеля предполагает, что обратная половина скорости реакции пренебрежимо мала по сравнению со скоростью прямой реакции.
Обзор условий
Ток обмена - это ток в состоянии равновесия, то есть скорость, с которой окисленные и восстановленные частицы переносят электроны с электродом. Другими словами, плотность тока обмена - это скорость реакции при обратимом потенциале (когда перенапряжение по определению равно нулю). При обратимом потенциале реакция находится в равновесии, что означает, что прямая и обратная реакции протекают с одинаковой скоростью. Эта скорость представляет собой плотность тока обмена.
Наклон Тафеля измерен экспериментально. Однако теоретически можно показать, что, когда доминирующий механизм реакции включает передачу одного электрона, который
где A определяется как
(2)
куда
- является Постоянная Больцмана,
- это абсолютная температура,
- электрический элементарный заряд электрона,
- это тепловое напряжение, и
- это "коэффициент передачи заряда ", значение которого должно быть от 0 до 1.
Уравнение для случая массопереноса электрода, которым нельзя пренебречь
В более общем случае
«Следующий вывод расширенного уравнения Батлера-Фольмера адаптирован из вывода Барда и Фолкнера, Ньюмана и Томаса-Алии».[6][циркулярная ссылка ]«[...] ток выражается как функция не только потенциала (как в простой версии), но и заданных концентраций. Скорость массопереноса может быть относительно небольшой, но это единственное влияние на химические вещества. реакция происходит через измененные (заданные) концентрации. Фактически, концентрации также являются функцией потенциала ".[5]
Уравнение Тафеля также можно записать как:
(3)
куда
- n - количество обмениваемых электронов, как в Уравнение Нернста,
- знак плюс под показателем степени относится к анодной реакции, а знак минус к катодной реакции,
- K - это константа скорости для электродной реакции в с−1,
- R - это универсальная газовая постоянная,
- C - концентрация активных веществ на поверхности электрода в моль / м².
Демонстрация
Как видно из уравнения (1),
, так:
, как видно из уравнения (2) и потому что .
потому что [7][циркулярная ссылка ][8][циркулярная ссылка ]
за счет массопереноса электродов [9][циркулярная ссылка ] , что в итоге приводит к уравнению (3).
Уравнение при малых значениях поляризации
Другое уравнение применимо при низких значениях поляризации. . В этом случае зависимость тока от поляризации обычно линейная (не логарифмическая):
Эта линейная область называется поляризационное сопротивление из-за его формального сходства с Закон Ома.
Смотрите также
Рекомендации
- ^ Bard, A.J .; Фолкнер, Л. Р. «Электрохимические методы. Основы и приложения »2-е изд. Вили, Нью-Йорк. 2001 г. ISBN 0-471-04372-9
- ^ «Применимость».
- ^ а б «Предельные случаи уравнения Батлера – Фольмера».
- ^ «Проверка уравнения Тафеля».
- ^ а б «Применимость».
- ^ «Вывод расширенного уравнения Батлера-Фольмера».
- ^ «Связь между постоянной Авогадро и постоянной Больцмана».
- ^ «Связь между постоянной Авогадро Na и постоянной Фарадея F».
- ^ «Выражение через стандартную константу скорости K = k0».
- G.T. Бурштейн (2005). "Век уравнения Тафеля: 1905–2005 гг. Памятный выпуск науки о коррозии". Наука о коррозии. 47 (12): 2858–2870. Дои:10.1016 / j.corsci.2005.07.002.
внешняя ссылка
 СМИ, связанные с Уравнение Тафеля в Wikimedia Commons
СМИ, связанные с Уравнение Тафеля в Wikimedia Commons

























