Комплекс Васькаса - Vaskas complex - Wikipedia
 | |
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК (SP-4-1) -карбонилхлорид | |
| Другие имена Иридий (I) бис (трифенилфосфин) карбонилхлорид Васьковский комплекс Подворье Васьки | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.035.386 |
| Номер ЕС |
|
| |
| |
| Характеристики | |
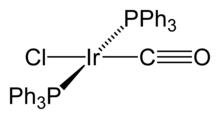
| IrCl (CO) [P (C6ЧАС5)3]2. | |
| Молярная масса | 780,25 г / моль |
| Внешность | желтые кристаллы |
| Температура плавления | 215 ° С (419 ° F, 488 К) (разлагается) |
| Точка кипения | 360 ° С (680 ° F, 633 К) |
| инсол | |
| Структура | |
| кв. плоский | |
| Опасности | |
| Главный опасности | никто |
| R-фразы (устарело) | никто |
| S-фразы (устарело) | 22-24/25 |
| Родственные соединения | |
Другой анионы | IrI (CO) [P (C6ЧАС5)3]2 |
Другой катионы | RhCl (CO) [P (C6ЧАС5)3]2 |
Родственные соединения | Pd [P (C6ЧАС5)3]4 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Васьковский комплекс это банальное имя для химическое соединение транс-карбонилхлорбис (трифенилфосфин) иридий (I), имеющий формулу IrCl (CO) [P (C6ЧАС5)3]2. Этот квадратный плоский диамагнитный металлоорганический комплекс состоит из центрального иридий атом связан с двумя взаимно транс трифенилфосфин лиганды, окись углерода и хлористый ион. Впервые о комплексе сообщили Дж. В. ДиЛузио и Лаури Васька в 1961 г.[1]Комплекс Васьки может пройти окислительная добавка и отличается своей способностью связываться с О2 обратимо. Это ярко-желтый кристаллический твердый.
Подготовка
Синтез включает нагревание практически любой соли хлорида иридия с трифенилфосфин и монооксид углерода источник. Самый популярный метод использует диметилформамид (ДМФ) в качестве растворителя, а иногда анилин добавляется для ускорения реакции. Другой популярный растворитель - 2-метоксиэтанол. Реакцию обычно проводят в атмосфере азота. При синтезе трифенилфосфин служит как лигандом, так и восстановителем, а карбонильный лиганд образуется при разложении диметилформамида, вероятно, путем удаления промежуточных соединений Ir-C (O) H. Ниже приведено возможное сбалансированное уравнение для этой сложной реакции.[2]
- IrCl3(ЧАС2O)3 + 3 П (С6ЧАС5)3 + HCON (CH3)2 + C6ЧАС5NH2 → IrCl (CO) [P (C6ЧАС5)3]2 + [(CH3)2NH2] Cl + OP (C6ЧАС5)3 + [C6ЧАС5NH3] Cl + 2 H2О
Типичные источники иридия, используемые в этом препарате: IrCl3·ИксЧАС2О и H2IrCl6.
Реакции
Исследования комплекса Васьки помогли создать концептуальную основу для гомогенный катализ. Комплекс Васьки с 16 валентными электронами считается «координационно ненасыщенным» и, таким образом, может связываться с одним двухэлектронным или двумя одноэлектронными лигандами, чтобы стать электронно насыщенным с 18 валентными электронами. Присоединение двух одноэлектронных лигандов называется окислительная добавка.[3] При окислительном добавлении степень окисления иридия увеличивается с Ir (I) до Ir (III). Четырехкоординатное квадратное плоское расположение в стартовом комплексе преобразуется в восьмигранный, шестикоординатное произведение. Комплекс Васьки подвергается окислительному присоединению с обычными окислителями, такими как галогены, сильные кислоты, такие как HCl, и другими молекулами, которые, как известно, реагируют как электрофилы, Такие как йодметан (CH3Я).
Комплекс Васьки связывает O2 обратимо:
- IrCl (CO) [P (C6ЧАС5)3]2 + O2 ⇌ IrCl (CO) [P (C6ЧАС5)3]2О2
Кислородный лиганд связан с Ir обоими атомами кислорода, что называется боковой связью. В миоглобине и гемоглобине, напротив, O2 связывается на конце, присоединяясь к металлу только через один из двух атомов кислорода. Результирующий аддукт диоксида превращается в исходный комплекс при нагревании или продувке раствора инертным газом, о чем свидетельствует изменение цвета с оранжевого на желтый.[2]
Спектроскопия
ИК-спектроскопия может быть использован для анализа продуктов окислительного присоединения к комплексу Васьки, потому что реакции вызывают характерные сдвиги частоты растяжения координированного монооксида углерода.[4]Эти сдвиги зависят от количества π-обратное соединение разрешено вновь связанными лигандами. Частоты растяжения CO для комплекса Васьки и окислительно добавленных лигандов задокументированы в литературе.[5]
- Комплекс Васьки: 1967 см.−1
- Комплекс Васьки + О2: 2015 см−1
- Комплекс Васьки + MeI: 2047 см−1
- Комплекс Васьки + I2: 2067 см−1
Окислительное добавление с образованием продуктов Ir (III) уменьшает π-связь от Ir к C, что вызывает увеличение частоты полосы валентных колебаний карбонила. Изменение частоты растяжения зависит от добавленных лигандов, но частота всегда превышает 2000 см.−1 для комплекса Ir (III).
Рекомендации
- ^ Лаури Васька; Дж. У. ДиЛузио (1961). «Карбонильные и гидридокарбонильные комплексы иридия по реакции со спиртами. Гидридокомплексы по реакции с кислотой». Журнал Американского химического общества. 83 (12): 2784–2785. Дои:10.1021 / ja01473a054.
- ^ а б Girolami, G.S .; Rauchfuss, T.B .; Анжеличи, Р.Дж. (1999). Синтез и техника в неорганической химии (3-е изд.). Саусалито, Калифорния: Университетские научные книги. п. 190. ISBN 0-935702-48-2.
- ^ Лабинджер, Джей А. (2015). «Учебник по окислительному добавлению». Металлоорганические соединения. 34 (20): 4784–4795. Дои:10.1021 / acs.organomet.5b00565.
- ^ Лаури Васька; ДиЛузио, Дж. У. (1962). «Активация водорода комплексом переходного металла в нормальных условиях, приводящая к стабильному молекулярному дигидриду». Журнал Американского химического общества. 84 (4): 679–680. Дои:10.1021 / ja00863a040.
- ^ Крэбтри, Р. (2001). Металлоорганическая химия переходных металлов. (3-е изд.). Канада: John Wiley & Sons. п. 152.
