Нулевой ионный слой - Zero ionic layer
Нулевой ионный слой является основным сайтом взаимодействия в основной комплекс SNARE. Диполь-дипольные взаимодействия иметь место между 3 глутамин (Q) остатки и 1 аргинин (R) остатки обнажены в этом слое. Несмотря на это, большая часть комплекса SNARE гидрофобна из-за лейциновой молнии.[1] Широко изученные слои внутри альфа-спирального пучка SNARE обозначены от «-7» до «+8». Нулевой ионный слой находится в центре пучка и поэтому обозначен как «0» слой.[2]
Структура
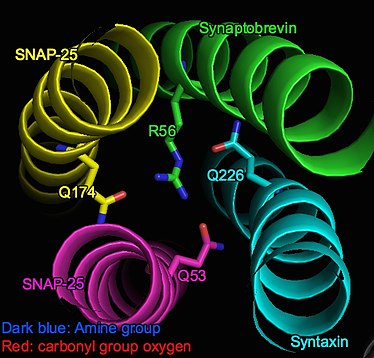
Комплекс SNARE представляет собой пучок, образованный 4 альфа-спиральными белками, включая везикул -ассоциированный Синаптобревин и связанные с клеточной мембраной Синтаксин и ЩЕЛЧОК.[3] Если смотреть на пучок сбоку, для каждого витка альфа-спирали альфа-атомы углерода от каждой спирали образуют плоскость, которая, таким образом, обозначается как «слой». Вдоль спирального пучка от N-конца до C-конца слои обозначены от «-7» до «+8» соответственно. Слой «0» (т.е. нулевой ионный слой) находится в центре спирального пучка.[2][4]
Нулевой ионный слой представляет собой ионный домен внутри в значительной степени гидрофобного альфа-спирального комплекса (SNARE сложный) . Стабилизируется силами притяжения (диполь-диполь взаимодействия) между тремя частично отрицательно заряженными карбонильные группы из глутамин остатки и положительно заряженный аргинин.[5] В частности, эти взаимодействующие группы включают Q226 на Синтаксин, Q53 на SNAP-25 (Sn1), Q174 на SNAP-25 (Sn2) и R56 на Синаптобревин (v-SNARE).[1]
4 аминокислоты асимметрично расположены в слое, как показано на рисунке. Однако их интенсивное взаимодействие обеспечивает стабильность слоя: конец боковой цепи аргинина находится в центре асимметрии, а аминогруппы образуют водородные связи с тремя остатками глутамина. Таким образом, стерическое и электростатическое соответствие хорошо установлено.[6]
Функции и исследовательский интерес
SNARE белки представляют собой семейство белков, которые расположены в клеточные мембраны посредничать в любых секреторные пути.[7] Комплекс образуется в экзоцитоз, процесс, при котором везикулы внутри клетки сливаются с клеточная мембрана секретировать молекулы во внеклеточное пространство.[3][8]
Нулевой ионный слой комплекса SNARE представляет особый интерес для ученых, изучающих SNARE, из-за его трех характеристик. Во-первых, это единственная гидрофильная область во всем гидрофобном комплексе SNARE; во-вторых, в отличие от большинства других слоев он демонстрирует асимметрию; в-третьих, расположение 3Q: 1R обнаруживается почти во всем суперсемействе SNARE среди эукариотических клеток.[6][4] Эти уникальные аспекты подразумевают его важность для эукариотических организмов в целом. Однако точные функции нулевого ионного слоя и все еще исследуются.[6][2]
Предыдущие исследования были сосредоточены на том, как мутации в этом слое могут влиять на функциональность комплекса SNARE в секреторных путях. Несмотря на то, что точный механизм все еще требует дальнейшего изучения, эти исследования показали, что целостность нулевого ионного слоя не важна для правильного выравнивания во время формирования комплекса, но важна для диссоциации комплекса SNARE и рециркуляции его 4 составляющих альфа -спиральные белки после экзоцитоза.[1][6]
An АТФаза (NSF) вместе с кофактор (α-SNAP) способствует разрушению комплекса SNARE после завершения экзоцитоза.[9] Исследования показали, что в процессе диссоциации комплекс NSF / α-SNAP специфически действует на нулевой ионный слой, в частности, на остаток глутамина (Q226) в синтаксине. Остаток глутамина передает конформационное изменение комплекса NSF / α-SNAP комплексу SNARE, чтобы разрушить и, таким образом, разъединить комплекс SNARE в нулевом ионном слое.[1][6] Более конкретно, даже если ионный слой по большей части скрыт внутри гидрофобного комплекса, во время диссоциации комплекс NSF / α-SNAP может нарушить гидрофобную защиту и, таким образом, пропустить молекулы воды в ядро. Это воздействие на другие гидрофильные молекулы нарушает исходное равновесие водородных связей и, таким образом, облегчает разборку альфа-спирального пучка.[4]
Мутация и чередование
В исследованиях, в которых в качестве моделей используются экзоцитотические SNARE дрожжей, мутация глутамина на аргинин в нулевом ионном слое приводит к дрожжевым клеткам, которые обладают недостаточной способностью к росту и секреции белка. Однако мутация аргинина на глутамин в этом слое приводит к дрожжевым клеткам, которые функционально являются дикими.[6] При мутации, когда все четыре аминокислоты в нулевом ионном слое являются остатками глутамина, клетки все еще проявляют нормальную секреторную способность, но дефекты могут стать выраженными при наличии других мутаций.[10]
Дополнительные мутации, когда мутация глутамина в аргинин сочетается с мутацией аргинина в глутамин в нулевом ионном слое, также привели к функциональным дрожжевым клеткам дикого типа в соответствии с их секреторной способностью.[11]
Эти исследования мутаций были проведены для изучения роли четырех аминокислот в нулевом ионном слое. Основные механизмы, объясняющие, почему эти мутации приводят к определенным результатам, недостаточно хорошо обсуждаются. В общем, остатки глутамина в этом слое имеют решающее значение для функциональности мутировавших штаммов. Пока глутамин не поврежден или каким-то образом компенсируется во время мутации, функциональность комплекса SNARE будет сохраняться.[6][10][11]
Рекомендации
- ^ а б c d Весы, Сьюзи Дж .; Ю, Брайан Ю.; Шеллер, Ричард Х. (2001-12-04). «Ионный слой необходим для эффективной диссоциации комплекса SNARE α-SNAP и NSF». Труды Национальной академии наук. 98 (25): 14262–14267. Дои:10.1073 / pnas.251547598. ISSN 0027-8424. ЧВК 64670. PMID 11762430.
- ^ а б c Fasshauer, D .; Sutton, R.B .; Brunger, A. T .; Ян, Р. (1998-12-22). «Консервированные структурные особенности комплекса синаптического слияния: белки SNARE реклассифицированы как Q- и R-SNARE». Труды Национальной академии наук Соединенных Штатов Америки. 95 (26): 15781–15786. Дои:10.1073 / пнас.95.26.15781. ISSN 0027-8424. ЧВК 28121. PMID 9861047.
- ^ а б Hanson, P. I .; Heuser, J. E .; Ян Р. (июнь 1997 г.). «Выпуск нейротрансмиттера - четыре года комплексов SNARE». Текущее мнение в нейробиологии. 7 (3): 310–315. Дои:10.1016 / s0959-4388 (97) 80057-8. ISSN 0959-4388. PMID 9232812.
- ^ а б c Sutton, R.B .; Fasshauer, D .; Jahn, R .; Брюнгер, А. Т. (24 сентября 1998 г.). «Кристаллическая структура комплекса SNARE, участвующего в синаптическом экзоцитозе с разрешением 2,4 А». Природа. 395 (6700): 347–353. Дои:10.1038/26412. ISSN 0028-0836. PMID 9759724.
- ^ МакМахон, Харви Т .; Зюдхоф, Томас К. (1995-02-03). «Комплекс синаптического ядра синаптобревина, синтаксина и SNAP25 формирует сайт связывания с высоким сродством -SNAP». Журнал биологической химии. 270 (5): 2213–2217. Дои:10.1074 / jbc.270.5.2213. ISSN 0021-9258. PMID 7836452.
- ^ а б c d е ж грамм Оссиг, Райнер; Шмитт, Ганс Дитер; Грут, Берт де; Ридель, Дитмар; Керанен, Сиркка; Ронне, Ханс; Грубмюллер, Гельмут; Ян, Рейнхард (2000-11-15). «Экзоцитоз требует асимметрии в центральном слое комплекса SNARE». Журнал EMBO. 19 (22): 6000–6010. Дои:10.1093 / emboj / 19.22.6000. ISSN 0261-4189. ЧВК 305815. PMID 11080147.
- ^ Гётте, М. (1998). «Новый бит для барабана SNARE». Тенденции в клеточной биологии. 8 (6): 215–218. Дои:10.1016 / s0962-8924 (98) 01272-0.
- ^ Зёлльнер, Томас; Уайтхарт, Сидни У .; Бруннер, Майкл; Эрдьюмент-Бромаж, Хедие; Героманос, Скотт; Темпст, Пол; Ротман, Джеймс Э. (март 1993 г.). «Рецепторы SNAP, участвующие в нацеливании и слиянии пузырьков». Природа. 362 (6418): 318–324. Дои:10.1038 / 362318a0. ISSN 1476-4687.
- ^ Чанг, Сунгхэ; Жирод, Ромен; Моримото, Такако; О’Донохью, Майкл; Попов, Сергей (1998). «Конститутивная секреция экзогенного нейротрансмиттера ненейрональными клетками: последствия для нейрональной секреции». Биофизический журнал. 75 (3): 1354–1364. Дои:10.1016 / с0006-3495 (98) 74053-6. ЧВК 1299809. PMID 9726936.
- ^ а б Katz, L .; Бреннвальд, П. (ноябрь 2000 г.). «Проверка« правила »3Q: 1R: мутационный анализ ионного« нулевого »слоя в дрожжевом экзоцитарном комплексе SNARE показывает отсутствие потребности в аргинине». Молекулярная биология клетки. 11 (11): 3849–3858. Дои:10.1091 / mbc.11.11.3849. ISSN 1059-1524. ЧВК 15041. PMID 11071911.
- ^ а б Граф, Кармен Т .; Ридель, Дитмар; Шмитт, Ганс Дитер; Ян, Рейнхард (01.05.2005). «Идентификация функционально взаимодействующих SNARE с использованием дополнительных замен в сохраняемом уровне« 0 »». Молекулярная биология клетки. 16 (5): 2263–2274. Дои:10.1091 / mbc.e04-09-0830. ISSN 1059-1524. ЧВК 1087233. PMID 15728725.
