Абсент - Absinthin
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК (1R, 2R, 5S, 8S, 9S, 12S, 13R, 14S, 15S, 16R, 17S, 20S, 21S, 24S) -12,17-дигидрокси-3,8,12,17,21,25-гексаметил- 6,23-диоксагептацикло [13.9.2.01,16.02,14.04,13.05,9.020,24] гексакоза-3,25-диен-7,22-дион | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Свойства | |
| C30ЧАС40О6 | |
| Молярная масса | 496.635 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Абсент это тритерпеновый лактон, производимый естественным путем из растений Artemisia absinthium (Полынь горькая ). Он представляет собой один из самых горьких химических агентов, ответственных за Абсент Отличный вкус.[1] Состав показывает биологическая активность и показал себя многообещающим в качестве противовоспалительного средства,[2] и не следует путать с туйон, нейротоксин также содержится в Artemisia absinthium.
Химическая структура
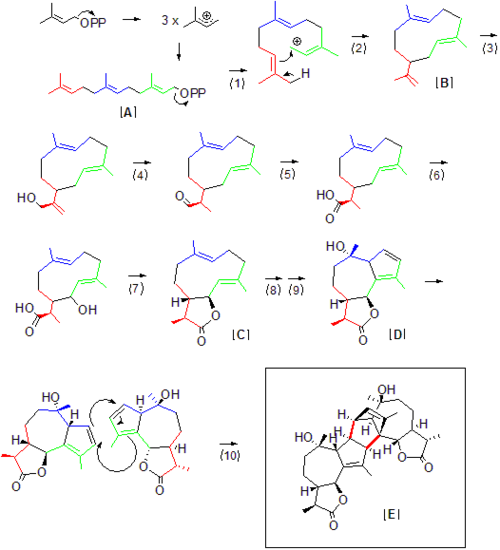
Сложная структура абсинтина (1) классифицируется как сесквитерпеновый лактон, что означает, что он принадлежит к большой категории натуральных продуктов, химически полученных из 5-углеродных «строительных блоков» (3), полученных из изопрен (4). Полная структура состоит из двух идентичных мономеров (2), которые связаны через предположительно встречающиеся в природе Дильс Альдер реакция, протекающая в алкенах 5-членного кольца гваяанолида.
 Иллюстрация изопреноид компоненты, участвующие в биосинтез абсентина
Иллюстрация изопреноид компоненты, участвующие в биосинтез абсентина
Полный синтез
Полный синтез of (+) - Absinthin был проведен в 2004 г. Zhang, et al.[3] Конечный выход, указанный для синтеза, составил 18,6% в течение 10 стадий, происходящих из Сантонин (1), коммерчески доступный реагент. Основой синтеза было расширение кольца исходного 6-членного углеродного кольца до 7-членного кольца, что привело к образованию каркаса мономера гваяанолида (2) с последующим Дильс Альдер соединение (3) и окончательные стереохимические модификации, приводящие к (+) - Абсинтин (4).

Биосинтез
Полный биосинтез абсентина в Artemisia absinthium не было выяснено, но большая часть этого может быть выведена из естественных предшественников продуктов, необходимых для доступа к абсинтину. Хотя можно сказать, что терпеноиды, такие как абсинтин, состоят из изопрен "единицы," изопрен сам по себе нестабилен и напрямую не реагирует. Скорее изопреновые звенья переносятся и реагируют как дифосфаты. Как следует из номенклатуры терпенов, первый предшественник абсинтина фарнезил дифосфат [A] содержит 15 атомов углерода или 3 единицы изопрена. Отход дифосфата (1) генерирует карбо-катион внутри синтазы, который затем может быть атакован двойной углерод-углеродной связью на противоположном конце молекулы (2). Первым стабильным промежуточным продуктом в пути биосинтеза у Artemisia, вероятно, является Germacrene A [B], который ранее был идентифицирован в сесквитерпеновых путях растений как предшественник гваяанолидов.[4] Отсюда происходит гидроксилирование (3) с последующим окислением (4) до альдегида, непосредственно с последующим дальнейшим гидроксилированием (5) и образованием карбоксильной группы. Важно отметить исчезновение концевой двойной связи углерод-углерод после (4), поскольку уменьшение этой связи в конечном продукте отличает мономер абсинтина от других последующих продуктов гермакрена А. Это уменьшение не обязательно происходит на этапе (4), но может происходить дальше по потоку. При наличии карбоксильной и гидроксильной группы в положении может происходить образование гваяанолактона [C] посредством дегидратации (7), как предполагается для общего пути гваяанолида.[5] Постулируется, что образование мономера сесквитерпен-гваяанолида абсинтина [D] в результате гидроксилирования и перегруппировки двойной связи (8,9) непосредственно предшествует димеризации до абсинтина [E] посредством естественного Дильс-Альдер реакция [10], которой, вероятно, способствует связанная синтаза, хотя сама реакция может происходить с хорошими выходами спонтанно,[3] хотя и медленнее, чем биосинтез обычных натуральных продуктов.
Пока нет синтаз, специфичных для Artemisia absinthium были достаточно изолированы, чтобы воссоздать это конкретное образование сесквитерпена in vitro, общая схема реакции, представленная здесь, описывает вероятный сценарий биосинтеза абсинтина за счет использования терпеновых промежуточных соединений, используемых в биосинтезе гермакрена А, другого сесквитерпенового лактона. Ферментные аналоги биосинтеза терпена, которые помогают рационализировать предложенные выше пронумерованные этапы биосинтеза, следующие:
- Фарнезил дифосфат отправление через сесквитерпен-синтазу [6]
- Замыкание кольца с помощью общей сесквитерпен-синтазы (как для №1)[6]
- Гидроксилирование концевого аллильного углерода через гермакрен А гидроксилазу, фермент цитохрома Р450.[6]
- Окисление спирта до альдола через гидроксилазу-гермакрен А.[6]
- Гидроксилирование спирта до карбоксильной группы через гидроксилазу гермакрена А.[6]
- НАДФН -опосредованное гидроксилирование аллильного углерода через постулируемое гидроксилирование, которое предшествует замыканию лактонового кольца [6]
- Образование лактона / замыкание кольца [6]
- Гидроксилирование по третичной двойной связи углерод-углерод.
- Дополнительное образование 5-членного кольца / циклизация [4]
- Дильс-Альдер связывание через неидентифицированный фермент в Artemisia absinthium.
использованная литература
- ^ Лахенмайер Д.В., Вальх С.Г., Падош С.А., Крёнер Л.У. (2006). «Абсент - обзор». Crit Rev Food Sci Nutr. 46 (5): 365–77. Дои:10.1080/10408690590957322. PMID 16891209. S2CID 43251156.
- ^ Баженова Е.Д .; Ашрафова Р. А .; Алиев К. У .; Туляганов; П. Д. (1977). Chem. Abstr. 87: 193909f.CS1 maint: журнал без названия (ссылка на сайт)
- ^ а б c Чжан В., Ло С., Фанг Ф и др. (Январь 2005 г.). «Полный синтез абсентина». Варенье. Chem. Soc. 127 (1): 18–9. Дои:10.1021 / ja0439219. PMID 15631427.
- ^ а б de Kraker JW, Franssen MC, de Groot A, Konig WA, Bouwmeester HJ (август 1998 г.). "(+) - Биосинтез гермакрена A: обязательный этап биосинтеза горьких сесквитерпеновых лактонов в цикории". Физиология растений. 117 (4): 1381–92. Дои:10.1104 / стр.117.4.1381. ЧВК 34902. PMID 9701594.
- ^ Kelsey, R.G .; Шафизаде, Ф. (1979). «Сесквитерпеновые лактоны и систематика рода Artemisia». Фитохимия. 18 (10): 1591–1611. Дои:10.1016/0031-9422(79)80167-3.[мертвая ссылка ]
- ^ а б c d е ж г de Kraker JW, Franssen MC, Dalm MC, de Groot A, Bouwmeester HJ (апрель 2001 г.). "Биосинтез гермакрена карбоновой кислоты в корнях цикория. Демонстрация цитохрома P450 (+) - гермакрен А гидроксилазы и НАДФ + -зависимой сесквитерпеноидной дегидрогеназы (ов), участвующих в биосинтезе сесквитерпенового лактона". Физиология растений. 125 (4): 1930–40. Дои:10.1104 / стр.125.4.1930. ЧВК 88848. PMID 11299372.