Низкокогерентная интерферометрия с угловым разрешением - Angle-resolved low-coherence interferometry
Низкокогерентная интерферометрия с угловым разрешением (a / LCI) является зарождающимся[когда? ] биомедицинская визуализация технология, использующая свойства рассеянный свет для измерения среднего размера клеточных структур, в том числе ядра клеток. Технология перспективна как клинический инструмент для на месте обнаружение диспластический, или же предраковый ткань.
Вступление
Комбайны A / LCI низкокогерентная интерферометрия с угловым разрешением рассеяние решить обратная задача определения геометрии рассеивателя на основе дальнее поле дифракционные картины. Подобно рефлектометрии в оптической области когерентности (OCDR) и оптической когерентной томографии (OCT), a / LCI использует широкополосный источник света в интерферометрия схема для достижения оптического сечения с разрешением по глубине, установленным длина когерентности источника. Регистрация измерений рассеяния с угловым разрешением свет в зависимости от угла рассеяния, и инвертировать углы, чтобы определить средний размер рассеивающих объектов с помощью вычислительная модель рассеяния света Такие как Теория Ми, который предсказывает углы на основе размера рассеивающего сфера. Комбинирование этих методов позволяет построить систему, которая может измерять средний размер рассеяния на различных глубинах в пределах образец ткани.
В настоящее время наиболее важным медицинским применением технологии является определение состояния здоровья тканей на основе измерения среднего размера ядер клеток. Было обнаружено, что по мере того, как ткань превращается из нормальной в злокачественную, средний размер ядер клеток увеличивается.[1] Несколько недавних исследований [2] показали, что с помощью измерений ядер клеток a / LCI может обнаруживать дисплазию низкой и высокой степени с чувствительностью 91% и различать нормальную и диспластическую с 97% специфичностью.
История
С 2000 года системы светорассеяния используются для биомедицинских приложений, таких как исследование клеточных морфология[3] а также диагностика дисплазия.[4] Вариации распределений рассеяния в зависимости от угол или же длина волны были использованы для вывода информации о размере клеток и субклеточных объектов, таких как ядра и органеллы. Эти измерения размеров могут затем использоваться диагностически для обнаружения изменений тканей, в том числе неопластический изменения (ведущие к раку).
Спектроскопия рассеяния света использовалась для обнаружения дисплазии в двоеточие, мочевой пузырь, шейка матки, и пищевод пациентов-людей.[2] Рассеяние света также использовалось для обнаружения Пищевод Барретта, метапластическое состояние с высокой вероятностью привести к дисплазии.[5]
Однако, в отличие от a / LCI, все эти методы основаны на измерениях на основе общей интенсивности, которые не позволяют получить результаты как функцию глубины в ткани.
Ранние модели A / LCI
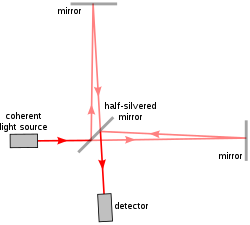
Первая реализация a / LCI[6] использовал Интерферометр Майкельсона, та же модель использовалась в знаменитых Эксперимент Майкельсона-Морли. Интерферометр Майкельсона разделяет один луч света на два пути, один эталонный путь и один путь дискретизации, и снова рекомбинирует их, чтобы получить форму волны, полученную в результате вмешательство. Разница между эталонным лучом и лучом для отбора проб, таким образом, показывает свойства образца в том, как он рассеивает свет.
Ранний / LCI устройство, используемое подвижное зеркало и линзы в опорном плече так, чтобы исследователи могли воспроизвести различные углы и глубины в эталонном пучке, как они имели место в собранном обратнорассеянноге света. Это позволяло изолировать обратно рассеянный свет на различной глубине отражения в образце. Затем, чтобы преобразовать данные в измерения структуры ячеек, угловые распределения рассеяния сравниваются с предсказаниями Теория Ми - который вычисляет размер сфер относительно их структуры рассеяния света.
Метод a / LCI был впервые проверен в исследованиях полистирольных микросфер,[6] размеры которых были известны и относительно однородны. Более позднее исследование расширило метод обработки сигналов, чтобы компенсировать несферическую и неоднородную природу ядер клеток.[7]
Эта ранняя система требовала до 40 минут для сбора данных для точки 1 мм² в образце, но доказала осуществимость идеи.
Реализация в Фурье-области

Как и OCT, ранние реализации a / LCI полагались на физическое изменение длина оптического пути (OPL) для управления глубиной в образце, из которого собираются данные. Однако было продемонстрировано[8] что можно использовать Область Фурье реализация для получения разрешения по глубине за один сбор данных. А широкополосный источник света используется для одновременного получения спектра длин волн, а рассеянный назад свет собирается последовательный оптоволокно на обратном пути для одновременного захвата различных углов рассеяния.[9] Затем интенсивность измеряется с помощью спектрометр: один кадр спектрометра содержит интенсивность рассеяния как функцию длина волны и угол. Наконец данные Преобразованный Фурье построчно для получения интенсивности рассеяния как функции OPL и угла. В результирующем изображении ось x представляет собой OPL, а ось y - угол отражения, что дает двумерную карту интенсивности отражения.
При использовании этого метода скорость сбора данных ограничивается только временем интегрирования спектрометра и может составлять всего 20 мс. Те же данные, для сбора которых изначально требовались десятки минут, могут быть получены ~ 105 раз быстрее.[9]
Схематическое описание

Версия системы a / LCI в области Фурье использует суперлюминесцентный диод (SLD) с волоконно-оптическим выходом в качестве источника света. Волоконный разветвитель разделяет путь прохождения сигнала при интенсивности 90% и опорный путь при 10%.
Свет от SLD проходит через оптический изолятор и впоследствии регулятор поляризации. Было показано, что контроль поляризации света важен для максимизации оптического сигнала и сравнения углового рассеяния с моделью рассеяния Ми.[10] Для передачи света к образцу используется поддерживающее поляризацию волокно. Второй контроллер поляризации аналогичным образом используется для управления поляризацией света, проходящего через опорный путь.
Выход волокна справа коллимированный с помощью линзы L1 и освещает ткань. Но поскольку волокно доставки смещено от оптической оси линзы, луч доставляется к образцу под косым углом. Затем обратно рассеянный свет коллимируется той же линзой и собирается пучком волокон. Волокна находятся на расстоянии одного фокусного расстояния от линзы, а образец - на одном фокусном расстоянии с другой стороны. Эта конфигурация захватывает свет с максимального диапазона углов и сводит к минимуму световой шум из-за зеркальных отражений.
На дальнем конце жгута волокон свет от каждого волокна отображается на спектрометре. Свет от образца и эталонного плеча смешивается светоделение куб (BS) и попадают на входную щель спектрометра изображения. Данные с визуализирующего спектрометра передаются в компьютер через универсальная последовательная шина интерфейс для обработки сигналов и отображения результатов. Компьютер также обеспечивает управление спектрометром изображений.
Прототип клинического устройства

Система a / LCI недавно была усовершенствована, чтобы позволить работу в клинические условия с добавлением ручной палочки. Тщательно контролируя поляризацию в оптоволокне доставки, используя волокна, сохраняющие поляризацию, и линейные поляризаторы, новая система позволяет манипулировать портативной палочкой без ухудшения сигнала из-за эффектов двойного лучепреломления. Кроме того, новая система использовала антибликовое покрытие шариковая линза в наконечнике зонда, которая уменьшает отражения, которые в противном случае ограничивают диапазон глубины системы.
В портативной системе используется 2 фута на 2 фута. оптический макет в качестве основания с источником, оптоволоконными компонентами, линзой, светоделителем и спектрометром формирования изображений, установленными на макетной плате. Алюминиевая крышка защищает оптику. Волоконный зонд с ручным зондом обеспечивает легкий доступ к образцам тканей для тестирования. С левой стороны находится белая платформа для образцов, куда помещается ткань для тестирования. Переносной зонд используется оператором для выбора определенных участков ткани, из которых собираются показания a / LCI.
Смотрите также
- Прикладная спектроскопия
- Длина когерентности
- преобразование Фурье
- Оптическая интерферометрия
- Оптической когерентной томографии
- Международный антарктический логистический центр
Рекомендации
- ^ Pyhtila, J; Чалут, К; Boyer, J; Кинер, Дж; Дамико, Т; Готфрид, М; Gress, F; Воск, А (2007). «Обнаружение ядерной атипии в пищеводе Барретта in situ с помощью низкокогерентной интерферометрии с угловым разрешением». Эндоскопия желудочно-кишечного тракта. 65 (3): 487–91. Дои:10.1016 / j.gie.2006.10.016. PMID 17321252.
- ^ а б Вакс, Адам; Pyhtila, John W .; Graf, Robert N .; Девятки, Рональд; Бун, Чарльз У .; Dasari, Ramachandra R .; Feld, Michael S .; Стил, Вернон Э .; Стоунер, Гэри Д. (2005). «Проспективная оценка неопластических изменений в эпителии пищевода крыс с использованием низкокогерентной интерферометрии с угловым разрешением». Журнал биомедицинской оптики. 10 (5): 051604. Дои:10.1117/1.2102767. HDL:1721.1/87657. PMID 16292952.
- ^ Бакман, В .; Гопал, В .; Калашников, М .; Бадизадеган, К .; Gurjar, R .; Воск, А .; Георгакуди, I .; Мюллер, М .; и другие. (2001). «Измерение клеточной структуры в субмикронном масштабе с помощью спектроскопии светорассеяния». IEEE Journal of Selected Topics in Quantum Electronics. 7 (6): 887–893. Дои:10.1109/2944.983289.
- ^ Уоллес, М; Перельман, LT; Бакман, В; Кроуфорд, JM; Фитцморис, М; Зайлер, М; Бадизадеган, К; Шилдс, SJ; и другие. (2000). «Эндоскопическое обнаружение дисплазии у пациентов с пищеводом Барретта с помощью светорассеивающей спектроскопии». Гастроэнтерология. 119 (3): 677–82. Дои:10.1053 / gast.2000.16511. PMID 10982761.
- ^ Ловат, Лоуренс Б .; Пикард, Дэвид; Новелли, Марко; Рипли, Пол М .; Фрэнсис, Хелен; Бигио, Ирвинг Дж .; Баун, Стивен Г. (2000-04-01). «4919 Новый метод оптической биопсии с использованием спектроскопии упругого рассеяния для диагностики дисплазии и рака пищевода Барретта». Эндоскопия желудочно-кишечного тракта. 51 (4): AB227. Дои:10.1016 / S0016-5107 (00) 14616-4. ISSN 0016-5107.
- ^ а б Воск, А; Ян, C; Бакман, В; Калашников, М; Дасари, Р.Р .; Фельд, MS (2002). «Определение размера частиц с использованием углового распределения обратно рассеянного света, измеренного с помощью низкокогерентной интерферометрии» (PDF). Журнал Оптического общества Америки A. 19 (4): 737–44. Дои:10.1364 / JOSAA.19.000737. PMID 11934166.
- ^ Воск, А; Ян, C; Бакман, В; Бадизадеган, К; Бун, CW; Дасари, Р.Р .; Фельд, MS (2002). «Сотовая организация и субструктура, измеренные с помощью низкокогерентной интерферометрии с угловым разрешением». Биофизический журнал. 82 (4): 2256–64. Дои:10.1016 / S0006-3495 (02) 75571-9. ЧВК 1302018. PMID 11916880.
- ^ Choma, M; Sarunic, M; Ян, C; Изатт, Дж (2003). «Преимущество в чувствительности свипируемого источника и оптической когерентной томографии в области Фурье» (PDF). Оптика Экспресс. 11 (18): 2183–9. Дои:10.1364 / OE.11.002183. PMID 19466106.
- ^ а б Pyhtila, John W .; Бойер, Джеффри Д .; Чалут, Кевин Дж .; Вакс, Адам (2006). «Фурье-доменная интерферометрия с низкой когерентностью с угловым разрешением через эндоскопический пучок волокон для спектроскопии светорассеяния». Письма об оптике. 31 (6): 772–4. Дои:10.1364 / OL.31.000772. PMID 16544619.
- ^ Pyhtila, John W .; Вакс, Адам (2007). «Влияние поляризации на точность определения размера рассеивателя проанализировано с помощью низкокогерентной интерферометрии с угловым разрешением в частотной области». Прикладная оптика. 46 (10): 1735–41. Дои:10.1364 / AO.46.001735. PMID 17356616.
