Тетрахлоралюминат кадмия (I) - Cadmium(I) tetrachloroaluminate
 | |
| Имена | |
|---|---|
| Название ИЮПАК дикадмий (2+) бис (тетрахоридоалюминат (1-)) | |
| Идентификаторы | |
| Свойства | |
| Компакт диск2[AlCl4]2 | |
| Молярная масса | 562,4123 г / моль |
| Внешность | белый кристалл |
| Температура плавления | 227 ° (разл.) |
| Опасности | |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | [1910.1027] TWA 0,005 мг / м3 (как Cd)[1] |
REL (Рекомендуемые) | Ca[1] |
IDLH (Непосредственная опасность) | Ca [9 мг / м3 (как Cd)][1] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
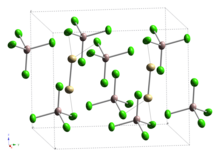
Тетрахлоралюминат кадмия (I) это неорганическое соединение с формулой Cd2(AlCl4)2, а тетрахлоралюминат из кадмий (I). Это было первое сообщение (1961), которое содержало кадмий в степени окисления +1 и было связано кадмий-кадмий.
Подготовка и свойства
Компакт диск2(AlCl4)2 изначально был получен растворением металлического кадмия в расплавленном CdCl2 с последующим добавлением AlCl3.[2]
- CdCl2 + Cd → Cd2Cl2
- Компакт диск2Cl2 + 2 AlCl3 → CD2(AlCl4)2
Последующие исследования Раман колебательный спектр указывает на наличие связи кадмий – кадмий,[3] что подтверждено двумя отдельными рентгеноструктурными исследованиями монокристаллов.[4][5] Таким образом, данное соединение можно сравнить с соединениями ртути (I) (ртутью) (такими как хлорид ртути (I) ), которые содержат Hg2+
2. Связи Cd – Cd входят в состав этан -как Cd2Cl6 единицы, разделяющие вершины с AlCl4 единиц, с длиной связи Cd – Cd, как сообщается, как 257,6 пм[4] или 256.1pm.[5]
Компакт диск2(AlCl4)2 диамагнитен. Он не содержит неспаренных электронов и легко реагирует с водой, диспропорционируя с образованием металлического Cd и Cd.2+.

использованная литература
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0087". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Corbett, J.D .; Burkhard, W. J .; Друдинг, Л. Ф. (январь 1961 г.). «Стабилизация состояния окисления кадмия (I). Система Cd-Cd.1
2(AlCl
4)
2-Компакт диск2
(AlCl
4)
2". Журнал Американского химического общества. 83 (1): 76–80. Дои:10.1021 / ja01462a016. - ^ Корбетт, Дж. Д. (август 1962 г.). "Кадмий (I) Ион Cd2+
2. Рамановский спектр и связь с Hg2+
2". Неорганическая химия. 1 (3): 700–703. Дои:10.1021 / ic50003a051. - ^ а б Faggiani, R .; Рональд Дж. Гиллеспи; Джон Э. Векрис (1986). «Ион кадмия (I), Cd2+
2; Рентгеновская кристаллическая структура Компакт диск
2(AlCl
4)
2". Журнал химического общества, химические коммуникации. 1986 (7): 517–518. Дои:10.1039 / C39860000517. - ^ а б Стаффель, Т .; Доктор Герд Мейер (1987). «Синтез и кристаллические структуры Cd [AlCl
4]
2 и Компакт диск
2[AlCl
4]
2". Zeitschrift für anorganische und allgemeine Chemie. 548 (5): 45–54. Дои:10.1002 / zaac.19875480505.
