Тетрахлоралюминат - Tetrachloroaluminate
 | |
| Имена | |
|---|---|
| Название ИЮПАК Тетрахлоралюминат (1–) | |
| Систематическое название ИЮПАК Тетрахлоралюминат (1-) | |
Другие имена
| |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| 2297 | |
PubChem CID | |
| |
| |
| Характеристики | |
| AlCl4− | |
| Молярная масса | 168.78 г · моль−1 |
| Структура | |
| Тd | |
| Тетраэдр | |
| Гибридизация | зр3 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тетрахлоралюминат [AlCl4]− является анион сформированный из алюминий и хлор. Анион имеет четырехгранный форма, похожая на четыреххлористый углерод где углерод заменен алюминием. Некоторые тетрахлоралюминаты растворимы в органических растворителях, образуя неводный ионный раствор, что делает их пригодными в качестве компонента электролитов для батарей. Например. тетрахлоралюминат лития используется в некоторых литиевые батареи.
Формирование
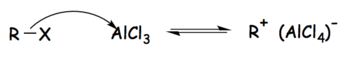
Ионы тетрахлоралюмината образуются как промежуточные соединения в Реакции Фриделя – Крафтса когда хлорид алюминия используется как катализатор. В случае с Фриделем– В процессе алкилирования реакция может быть разбита на три этапа следующим образом:[1]
Шаг 1: Алкилгалогенид реагирует с сильной кислотой Льюиса с образованием активированного электрофила, состоящего из тетрахлоралюминатного иона и алкильной группы.
Шаг 2: Ароматическое кольцо (бензол в этом случае) реагирует с активированным электрофилом, образуя карбокатион алкилбензола.
Шаг 3: Карбокатион алкилбензола реагирует с тетрахлоралюминатным анионом, регенерируя ароматическое кольцо и кислоту Льюиса и образуя соляная кислота (HCl).
Похожий механизм имеет место в методе Friedel– Ремесла ацилирования.[2]
Рекомендации
- ^ «электрофильное замещение - алкилирование бензола». www.chemguide.co.uk. Получено 2020-09-07.
- ^ Ацилирование Friedel-Crafts. Organic-chemistry.org. Проверено 11 января 2014.