Комиссия по изотопному содержанию и атомным весам - Commission on Isotopic Abundances and Atomic Weights
 | |
| Сокращение | CIAAW |
|---|---|
| Формирование | 1899 |
| Тип | Международная научная организация |
| Цель | Обеспечить рекомендованные на международном уровне значения изотопного состава и атомных масс элементов. |
Обслуживаемый регион | Мировой |
Официальный язык | английский |
Председатель | Юрис Мейя |
Секретарь | Томас Прохаска |
Головная организация | ИЮПАК (с 1920 г.) |
| Интернет сайт | http://www.ciaaw.org |
В Комиссия по изотопному содержанию и атомным весам (CIAAW) является международным научным комитетом Международный союз теоретической и прикладной химии (ИЮПАК) под своим Отдел неорганической химии. С 1899 г. ему поручается периодическая критическая оценка атомные веса из химические элементы и другие родственные данные, такие как изотопический состав элементов.[1] Стандартные атомные веса CIAAW, публикуемые раз в два года, признаны авторитетным источником в науке и появляются во всем мире в периодическая таблица настенные диаграммы.[2]
Использование стандартных атомных весов CIAAW также требуется по закону, например, при расчете теплотворной способности природного газа (ISO 6976: 1995) или при гравиметрической подготовке первичных стандартных образцов при анализе газов (ISO 6142: 2006). Кроме того, до 2019 года определение кельвин единица СИ для термодинамической температуры, сделанная с прямой ссылкой на изотопный состав кислорода и водорода в соответствии с рекомендациями CIAAW.[3] Последний отчет CIAAW был опубликован в феврале 2016 года.[4] После 20 мая 2019 года новое определение кельвин вступил в силу на основании Постоянная Больцмана.
Учреждение
| Фрэнк В. Кларк (СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ) | Карл Зейберт (Германия) | Сэр Эдвард Торп (ВЕЛИКОБРИТАНИЯ) |
Хотя атомный вес принял концепцию такой постоянной природы, как скорость света, отсутствие согласия по принятым значениям создало трудности в торговле. Количества, измеренные химическим анализом, не переводились в веса одинаково всеми сторонами, и стандартизация стала неотложной задачей.[5] Сообщается так много разных значений, что Американское химическое общество (ACS) в 1892 году назначил постоянный комитет для составления отчета о стандартной таблице атомных весов для принятия Обществом. Кларк, который в то время был главным химиком Геологической службы США, был назначен комитетом из одного человека для подготовки отчета. Он представил первый отчет на годовом собрании 1893 года и опубликовал его в январе 1894 года.[6]
В 1897 году Немецкое химическое общество по предложению Герман Эмиль Фишер, назначил рабочий комитет из трех человек для отчета по атомным весам. Комитет состоял из председателя проф. Ганс Х. Ландольт (Берлинский университет), проф. Вильгельм Оствальд (Университет Лейпцига) и проф. Карл Зейберт (Университет Ганновера). Этот комитет опубликовал свой первый отчет в 1898 году, в котором он высказал предположение о желательности создания международного комитета по атомным весам. 30 марта 1899 г. Ландольт, Оствальд и Зейберт направили другим национальным научным организациям приглашение назначить делегатов в Международный комитет по атомным весам. Пятьдесят восемь членов были назначены в Большой Международный комитет по атомным весам, в том числе Фрэнк В. Кларк.[7] Большой комитет вел свою работу по переписке с Ландольтом, что создавало трудности и задержки, связанные с перепиской между 58 членами. В результате 15 декабря 1899 года немецкий комитет попросил членов Интернационала выбрать небольшой комитет из трех-четырех членов.[8] В 1902 г. проф. Франк В. Кларк (США), проф. Карл Зеуберт (Германия) и проф. Томас Эдвард Торп (Великобритания) были избраны, и Международный комитет по атомным весам опубликовал свой первый отчет в 1903 году под председательством профессора Кларка.[9]
Функция
С 1899 года Комиссия периодически критически оценивает опубликованную научную литературу и составляет Таблицу стандартных атомных весов. В последнее время Таблица стандартных атомных масс публикуется раз в два года. Каждое рекомендуемое стандартное значение атомной массы отражает наилучшее знание оцененных опубликованных данных. Рекомендуя стандартные атомные веса, CIAAW, как правило, не пытается оценить средний или составной изотопный состав Земли или любого подмножества земных материалов. Вместо этого Комиссия стремится найти единую величину и симметричную неопределенность, которая включала бы почти все вещества, которые могут встретиться.[10]
Известные решения
За свою историю Комиссия приняла много заметных решений. Некоторые из них выделены ниже.

Международная единица атомного веса: H = 1 или O = 16.
Хотя Дальтон предложил принять атомный вес водорода за единицу в 1803 году, многие другие предложения были популярны на протяжении всего XIX века. К концу XIX века широкую поддержку получили две шкалы: H = 1 и O = 16. Такая ситуация была нежелательной в науке, и в октябре 1899 г. первой задачей Международной комиссии по атомным весам было определение международной шкалы, и кислородная шкала стала международным стандартом.[11] Принятие кислородной шкалы вызвало значительную негативную реакцию в химическом сообществе, и поэтому первый отчет по атомным весам был опубликован с использованием обеих шкал. Вскоре от этой практики отказались, и кислородная шкала оставалась международным стандартом на десятилетия вперед. Тем не менее, когда Комиссия присоединилась к ИЮПАК в 1920 году, ее попросили вернуться к шкале H = 1, которую она отклонила.
Современный блок: 12С = 12
С открытием изотопов кислорода в 1929 году возникла ситуация, когда химики основывали свои вычисления на средней атомной массе (атомной массе) кислорода, тогда как физики использовали массу преобладающего изотопа кислорода, кислорода-16. Это несоответствие стало нежелательным, и необходимо было объединить химию и физику.[12] На встрече в Париже 1957 года Комиссия выдвинула предложение по шкале углерода-12.[13] Шкала углерода-12 для атомных масс и масс нуклидов была утверждена IUPAP (1960) и IUPAC (1961) и до сих пор используется во всем мире.[14]
Неопределенность атомных весов
В начале 20 века измерения атомного веса свинца показали значительные колебания в зависимости от происхождения образца. Эти различия считались исключением из-за того, что изотопы свинца являются продуктами естественных цепочек радиоактивного распада урана. Однако в 1930-е гг. Малькольм Доул сообщили, что атомный вес кислорода в воздухе немного отличается от атомного веса в воде.[15] Вскоре после этого Альфред Ниер сообщили о естественных вариациях изотопного состава углерода. Стало ясно, что атомные веса не являются константами природы. На заседании Комиссии в 1951 году было признано, что изменение содержания изотопов серы оказывает значительное влияние на международно признанное значение атомного веса. Чтобы указать диапазон значений атомной массы, которые могут применяться к сере из различных природных источников, к атомной массе серы было добавлено значение ± 0,003. К 1969 году Комиссия установила неопределенности для всех значений атомной массы.
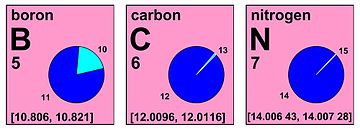
Обозначение интервалов
На своем заседании в 2009 году в Вене Комиссия решила выразить стандартный атомный вес водорода, углерода, кислорода и других элементов таким образом, чтобы четко указать, что эти значения не являются константами природы.[16][17] Например, запись стандартного атомного веса водорода как [1,007 84, 1,008 11] показывает, что атомный вес в любом нормальном материале будет больше или равен 1,007 84 и будет меньше или равен 1,008 11.[18]
Принадлежности и имя
- Международный союз теоретической и прикладной химии (ИЮПАК) с 1920 г.
- Международная ассоциация химических обществ (МАКО) с 1913-1919 гг.
Комиссия по изотопному содержанию и атомным весам претерпела множество изменений в названии:
- Большой международный комитет по атомным весам (1899–1902)
- Международный комитет по атомным весам (1902-1920)
- Комиссия ИЮПАК по атомным весам (1920-1922)
- Комиссия ИЮПАК по химическим элементам (1922-1930)
- Комиссия ИЮПАК по атомным весам (1930-1979)
- Комиссия ИЮПАК по атомным весам и изотопному содержанию (1979-2002 гг.)
- Комиссия ИЮПАК по изотопному содержанию и атомному весу (2002 г. - настоящее время)
Известные члены

С момента ее создания многие известные химики были членами Комиссии. Примечательно, что в Комиссии работали восемь нобелевских лауреатов: Анри Муассан (1903-1907), Вильгельм Оствальд (1906-1916), Фрэнсис Уильям Астон, Фредерик Содди, Теодор Уильям Ричардс, Нильс Бор, Отто Хан и Мари Кюри.
Ричардс был удостоен Нобелевской премии по химии 1914 года «в знак признания его точных определений атомной массы большого числа химических элементов».[19] пока он был членом комиссии.[20] Так же, Фрэнсис Астон был членом Комиссии, когда он был удостоен Нобелевской премии по химии 1922 года за свои работы по изотопным измерениям.[21] Между прочим, отчет об атомных весах 1925 года подписали три нобелевских лауреата.[22]
Среди других известных ученых, работавших в Комиссии, были Жорж Урбен (первооткрыватель лютеций, хотя приоритет оспаривался с Карл Ауэр фон Вельсбах ), Андре-Луи Дебьерн (первооткрыватель актиний, хотя приоритет оспаривается с Фридрих Оскар Гизель ), Маргарита Перей (первооткрыватель франций ), Георгий Флёров (тезка элемента флеровий ),[23] Роберт Уайтлоу-Грей (первый изолированный радон ), и Арне Оландер (Секретарь и член Нобелевский комитет по химии ).
Председатели комиссии
С момента создания председателями Комиссии были:
- Ганс Х. Ландольт
 (1899-1901)
(1899-1901) - Фрэнк В. Кларк
 (1902-1921)
(1902-1921) - Жорж Урбен
 (1922-1929)
(1922-1929) - Грегори П. Бакстер
 (1930-1949)
(1930-1949) - Эдвард Уичерс
 (1950-1959)
(1950-1959) - Томас Батуэкас
 (1960-1963)
(1960-1963) - Эдвард Уичерс
 (1964-1969)
(1964-1969) - Норман Гринвуд
 (1970-1975)
(1970-1975) - Этьен Рот
 (1976-1979)
(1976-1979) - Норман Э. Холден
 (1980-1983)
(1980-1983) - Раймонд Л. Мартин
 (1984-1987)
(1984-1987) - Джон де Лаэтер
 (1988-1991)
(1988-1991) - Клаус Г. Хойманн
 (1992-1995)
(1992-1995) - Людольф Шульц
 (1996-2001)
(1996-2001) - Филип Тейлор
 (2002-2003)
(2002-2003) - Типинг Дин
 (2004-2007)
(2004-2007) - Роберто Гонфиантини
 (2008-2009)
(2008-2009) - Вилли А. Брэнд
 (2010-2013)
(2010-2013) - Юрис Мейя
 (2014-настоящее время)
(2014-настоящее время)
В 1950 году испанский химик Энрике Молес стал первым секретарем комиссии при создании этой должности.
Смотрите также
Рекомендации
- ^ «Нобелевская премия по химии 1914 года - Вручение». Nobelprize.org. 11 ноября 1915 г. В архиве с оригинала 30 июня 2017 г.
- ^ «ИЮПАК, Оксфордский справочник». Дои:10.1093 / oi / author.20110803100007944 (неактивно 10.11.2020). В архиве из оригинала от 22.09.2013. Цитировать журнал требует
| журнал =(помощь)CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь) - ^ «Уточнение определения кельвина, единицы термодинамической температуры» (PDF). BIPM. 2005 г. В архиве (PDF) из оригинала от 26.06.2013.
- ^ Юрис Мейя; Тайлер Б. Коплен; Майкл Берглунд; Вилли А. Брэнд; Поль де Бьевр; Манфред Грёнинг; Норман Э. Холден; Йоханна Ирргехер; Роберт Д. Лосс; Томас Валчик; Томас Прохаска (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Pure Appl. Chem. 88 (3): 265–291. Дои:10.1515 / pac-2015-0305. S2CID 101719914.
- ^ Э. Кроуфорд (1992). Национализм и интернационализм в науке, 1880-1939 гг. (С.40). Издательство Кембриджского университета. ISBN 9780521524742. В архиве из оригинала от 09.05.2016.
- ^ «Атомный вес и Международный комитет - исторический обзор». Chemistry International. 2004 г. В архиве из оригинала от 09.07.2017.
- ^ Л.М.Деннис, Фрэнк Вигглсворт Кларк (Национальная академия наук, 1932 г.) стр.143 В архиве 2012-10-15 на Wayback Machine
- ^ Х. Ландольт; В. Оствальд; К. Зеберт (1900). "Zweiter Bericht der Commission für die Festsetzung der Atomgewichte". Бер. 22 (2): 1847–1883. Дои:10.1002 / cber.19000330270.
- ^ Ф. В. Кларк (1903). «Отчет Международного комитета по атомным весам». Варенье. Chem. Soc. 25 (1): 1–5. Дои:10.1021 / ja02003a001.
- ^ Майкл Э. Визер; Майкл Берглунд (2009). «Атомный вес элементов 2007 (Технический отчет IUPAC)» (PDF). Pure Appl. Chem. 81 (11): 2131–2156. CiteSeerX 10.1.1.540.9258. Дои:10.1351 / PAC-REP-09-08-03. S2CID 98084907. В архиве (PDF) из оригинала от 04.03.2016.
- ^ Ричардс, Теодор Уильям (1900). «Международные атомные веса». Труды Американской академии искусств и наук. 36 (10): 171–176. Дои:10.2307/20020992. JSTOR 20020992.
- ^ Ф.В. Астон (1931). «Единица атомного веса». Природа. 128 (3234): 731. Bibcode:1931Натура.128..731.. Дои:10.1038 / 128731a0. S2CID 4134425.
- ^ Эдвард Уичерс (1958). «Отчет об атомных весах за 1956-1957 годы». Варенье. Chem. Soc. 80 (16): 4121–4124. Дои:10.1021 / ja01549a001.
- ^ Британская энциклопедия В архиве 2013-03-08 в Wayback Machine
- ^ Малкольм Доул (1935). «Относительный атомный вес кислорода в воде и воздухе». Варенье. Chem. Soc. 57 (12): 2731. Дои:10.1021 / ja01315a511.
- ^ «Массовая миграция: химики пересматривают атомные веса 10 элементов». Scientific American. 16 декабря 2010 г. В архиве из оригинала от 30 декабря 2011 г.
- ^ «Атомный вес изменяется, чтобы отражать естественные вариации». Мир химии. 2010. В архиве из оригинала от 23.09.2013.
- ^ Тайлер Б. Коплен; Норман Э. Холден (2011). «Атомный вес: больше не константы природы». Chemistry International. В архиве из оригинала от 14.06.2013.
- ^ "Нобелевская премия по химии 1914 г.". В архиве из оригинала от 29.06.2017.
- ^ «Нобелевская премия Ричардсу; премия по химии за 1914 год достается исследователю из Гарварда». Нью-Йорк Таймс. 13 ноября 1915 г. В архиве из оригинала от 22.09.2013.
- ^ F.W. Aston; и другие. (1923). «Отчет Международного комитета по химическим элементам: 1923 г.». Варенье. Chem. Soc. 45 (4): 867–874. Дои:10.1021 / ja01657a001.
- ^ F.W. Aston; и другие. (1925). «Международная атомная масса 1925 года». Варенье. Chem. Soc. 47 (3): 597–601. Дои:10.1021 / ja01680a001.
- ^ "Резюме прошлого и настоящего членства, CIAAW". В архиве из оригинала от 15.10.2014.


