Внутренний сайт входа рибосомы вируса гепатита А (IRES) - Hepatitis A virus internal ribosome entry site (IRES)
| Внутренний сайт входа рибосомы вируса гепатита А (IRES) | |
|---|---|
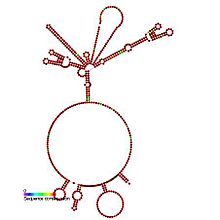 Предсказанный вторичная структура и сохранение последовательности из IRES_HepA | |
| Идентификаторы | |
| Символ | IRES_HepA |
| Альт. Символы | HepA_IRES |
| Рфам | RF00228 |
| Прочие данные | |
| РНК тип | Снг; IRES |
| Домен (ы) | Вирусы |
| ИДТИ | Термин GO должен начинаться с GO: |
| ТАК | ТАК: 0000243 |
| PDB структуры | PDBe |
Эта семья представляет внутренний сайт входа рибосомы (IRES) вирус гепатита А.[1] HAV IRES представляет собой последовательность длиной 450 нуклеотидов.[2] расположен в 5 ’UTR длиной 735 нуклеотидов (нетранслируемая область) вирусного гепатита А. Геном РНК.[1] Элементы IRES допускают независимость от крышки и конца перевод из мРНК в клетке-хозяине. IRES достигает этого, опосредуя внутреннее инициирование перевод путем набора рибосомальный Комплекс предварительной инициации 40S непосредственно в кодон инициации и устраняет необходимость в фактор инициации эукариот, eIF4F.[3]
История и предыстория
IRES был впервые обнаружен в геноме РНК Picornaviridae Норман Зоненберг в 1988 году.[4] Первоначально идентифицированный 5 ’UTR полиовирус (PV), который направлял внутреннюю инициацию синтеза белка, был назван посадочной площадкой рибосомы (RLP). Вскоре после этого этот термин был заменен на «внутренний сайт входа в рибосомы», который также чаще используется сегодня.[5] В 1988 г. только вирус энцефаломикоардита (EMCV ) и PV использовались для демонстрации способности IRES.[6] Исследование IRES при HAV было проведено в 1993 году Майклом Дж. Глассом, Си-Ю Цзя и Дональдом Ф. Саммерсом. Их исследования показали, что IRES HAV был расположен ниже нуклеотида 45 и включал до нуклеотида 734.[7] Cap-независимое внутреннее инициирование синтеза белка отличается от нормального клеточного cap-зависимого инициирования трансляции. eIF4 (фактор инициации эукариот 4) как единый комплекс, состоящий из eIF4A, eIF4B, eIF4E и eIF4G. eIF4F используется для обозначения комплекса, который включает eIF4E, 4G и 4A.[5] При инициации кэп-зависимой трансляции eIF4F связывается с кэпом m7G на конце 5 ’UTR, рекрутируя 40S малая рибосомная субъединица и сканирование вниз по течению для стартового кодона AUG.[1] Было показано, что внутреннее инициирование, не зависящее от кэпа, влияет либо на части eIF4, либо на весь комплекс.[5]
Функция
Без оболочки в цитоплазме геном HAV инициирует трансляцию независимо от 5 ’кэпа, чтобы синтезировать свои вирусные белки. В вторичная структура HAV IRES необходимо и достаточно для того, чтобы геном рекрутировал рибосому и инициировал трансляцию. Рибосома клетки-хозяина распознает IRES и будет непосредственно входить в последовательность, а не сканировать с 5 ’конца.[2] Геном HAV не кодирует белки, которые обладают способностью отключать белок хозяина. Следовательно, HAV IRES должен конкурировать с мРНК, кэпированной m7G клетки-хозяина.[8] К сожалению, инициация трансляции HAV IRES не так эффективна, как типичная кэп m7G клетки-хозяина. Хотя структура HAV IRES имеет сродство к eIF4F, ее сродство не так высоко, как у кэпированных мРНК клетки-хозяина. Это приводит к более длительному периоду, необходимому для достижения максимального выделения вируса. Это также приводит к гибели клеток, происходящей только в результате иммунного ответа хозяина, а не лизиса.[1]
Подавление IRES
Поскольку eIF4F играет важную роль в инициации HAV IRES, он является мишенью для подавления IRES. Расщепление eIF4G белковый каркас eIF4F с помощью специфичных для последовательности протеаз 2А протеазы или L-протеазы приведет к сильно ингибированной активности HAV IRES. Эти протеазы кодируются другими членами Picornaviridae семья. Вирус ящура (ящур), например, кодирует эти протеазы для подавления трансляции клеточной мРНК, позволяя транслировать вирусную РНК.[2] Требование интактного eIF4G для инициации IRES специфично для HAV IRES среди других пикорнавирусов.[6] eIF4E-связывающий белок I (4E-BP1) также будет мешать белку eIF4G. 4E-BP1 функционирует путем секвестрации eIF4E, что, таким образом, ингибирует его ассоциацию с eIF4G и приводит к инактивации HAV IRES (1). Другой метод инактивации активности eIF4F заключается в воздействии аналога кэпа m7GpppG, который нацелен на eIF4E и затем способен предотвратить его ассоциацию с кэпированными 5 ’концами мРНК. Точный механизм, в котором этот аналог кэпа влияет на IRES, не ясен, но предполагается, что связывание этого аналога с eIF4E приводит к конформационному изменению eIF4G, которое нарушает нормальную функцию eIF4G.[2]
глицеральдегид-3-фосфат-дегидрогеназа (GAPDH)
Глицеральдегид-3-фосфат-дегидрогеназа (GAPDH ) - клеточный фермент, обычно участвующий в гликолиз. Известно, что GAPDH связывается с перекрывающимися сайтами в пределах стебля-петли IIIa в HAV IRES. Ствол-петля IIIa содержит UU делеция нуклеотидов внутри 5 нуклеотидной последовательности, которая усиливает активность IRES. GAPDH, эффективно связываясь с этой областью, будет дестабилизировать вторичную структуру, которую образует IRES, подавляя способность IRES выполнять независимую от кэпа трансляцию.[9]
Подавление белка La
Белок клетки-хозяина, широко и исключительно обнаруженный в эукариотических клетках, белок La связывается непосредственно со специфическими областями HAV IRES во время трансляции мРНК, а также Репликация РНК. В исследовании 2008 года наблюдалось, что цитоплазматический La снижает инициирование HAV IRES.[8] Однако в 2014 году более недавнее исследование продемонстрировало успешное ингибирование (in vivo) белка La в качестве предлагаемого метода ингибирования трансляции и репликации IRES HAV, что означает, что он более чем вероятно играет неотъемлемую роль в трансляции и репликации HAV.[10]
Амантадин
Амантадин, трициклический симметричный амин, является доказанным супрессором, который специфически ингибирует HAV IRES-зависимую трансляцию HAV РНК. Эксперимент 2005 года показал, что амантадин подавляет трансляцию HAV IRES и не вызывает интерферонового ответа, что указывает на перспективное противовирусное использование амантадина.[4] За вирус гриппа А, его основной метод действия в качестве противовирусного препарата заключается в предотвращении отслоения вирусного генома, что ингибирует трансляцию и репликацию, опосредованные HAV IRES. Эффективность амантадина проистекает из расположения IRES в области 5’NTR, которая имеет высокое сродство к противовирусным препаратам, что делает его эффективной мишенью. Также выяснилось, что Белок M2 вируса гриппа A может быть другой жизнеспособной мишенью для потенциального противовирусного препарата.[11]
Было обнаружено, что все пикорнавирусы содержат IRES.[12] Есть четыре класса IRES в рамках Picornaviridae семья, от 270 до 450 нт.[5] Среди пикорнавирусов многие 5’-UTR также содержат дополнительные структурные элементы, расположенные выше по течению, которые могут способствовать репликации вирусного генома. Многие пикорнавирусы IRES также позволяют многим вирусам блокировать cap-зависимую инициацию, что приводит к отключению синтеза белка клетки-хозяина.[5]Четыре класса - это энтеро- / риновирус IRES, кардио- / афтовирус IRES, HAV IRES, HCV-подобный пикорнавирус IRES. Эти IRES классифицируются по их нуклеотидным последовательностям, но имеют структурное сходство, потому что это структура РНК, которая имеет способность внутренне рекрутировать трансляционный аппарат.[6] Элементы IRES энтеро- / риновирусов имеют общие структурные мотивы с IRES HAV. HAV IRES, энтеро- / риновирус и кардио- / аптовирус IRES составляют примерно 450 нуклеотидов, но сильно различаются по своей структуре. Кардиовирус, EMCV, и аптовирус, вирус ящура (FMDV) имеют около 50% идентичных элементов IRES. HCV-подобный пикорнавирус IRES включает в себя наибольшее отличие элементов IRES от трех других классов. Существует большое разнообразие Picornaviridae вирусы, содержащие высококонсервативные HCV-подобные элементы IRES, некоторые из которых, как ожидается, все еще будут идентифицированы.[5] Важно отметить, что активность HAV IRES отличается от трех других классов своим специфическим требованием для неповрежденного eIF4G. Другие пикорнавирусы кодируют белки, которые расщепляют eIF4G для повышения активности IRES.[2]
Рекомендации
- ^ а б c d Браун Е.А., Заяц А.Дж., Лимон С.М. (февраль 1994 г.). «In vitro характеристика внутреннего сайта входа рибосомы (IRES), присутствующего в 5'-нетранслируемой области РНК вируса гепатита A: сравнение с IRES вируса энцефаломиокардита». Журнал вирусологии. 68 (2): 1066–1074. ЧВК 236545. PMID 8289336.
- ^ а б c d е Али И.К., Маккендрик Л., Морли С.Дж., Джексон Р.Дж. (сентябрь 2001 г.). «Активность IRES вируса гепатита А требует ассоциации между кэп-связывающим фактором инициации трансляции (eIF4E) и eIF4G». Журнал вирусологии. 75 (17): 7854–7863. Дои:10.1128 / jvi.75.17.7854-7863.2001. ЧВК 115028. PMID 11483729.
- ^ Колупаева В.Г., Пестова Т.В., Hellen CU (декабрь 2000 г.). «Связывание рибосом с внутренним сайтом проникновения рибосом вируса классической чумы свиней». РНК. 6 (12): 1791–1807. Дои:10.1017 / S1355838200000662. ЧВК 1370049. PMID 11142379.
- ^ а б Канда Т., Йокосука О, Имазеки Ф, Фудзивара К., Нагао К., Сайшо Х. (июнь 2005 г.). «Амантадин подавляет трансляцию, опосредованную внутренним сайтом входа в рибосомы вируса гепатита А, в клетках гепатомы человека». Сообщения о биохимических и биофизических исследованиях. 331 (2): 621–629. Дои:10.1016 / j.bbrc.2005.03.212. PMID 15850805.
- ^ а б c d е ж Belsham GJ (февраль 2009 г.). «Дивергентные элементы IRES пикорнавируса». Вирусные исследования. 139 (2): 183–192. Дои:10.1016 / j.virusres.2008.07.001. PMID 18675861.
- ^ а б c Фернандес-Мирагалл О., Лопес де Куинто С., Мартинес-Салас Е. (февраль 2009 г.). «Актуальность структуры РНК для активности элементов IRES пикорнавируса». Вирусные исследования. 139 (2): 172–182. Дои:10.1016 / j.virusres.2008.07.009. PMID 18692097.
- ^ Гласс MJ, Цзя XY, Саммерс Д.Ф. (апрель 1993 г.). «Идентификация внутреннего сайта рибосомы вируса гепатита А: анализ in vivo и in vitro бицистронных РНК, содержащих некодирующую область 5 'HAV». Вирусология. 193 (2): 842–852. Дои:10.1006 / viro.1993.1193. PMID 8384758.
- ^ а б Cordes S, Kusov Y, Heise T, Gauss-Müller V (апрель 2008 г.). «La аутоантиген подавляет IRES-зависимую трансляцию вируса гепатита А». Сообщения о биохимических и биофизических исследованиях. 368 (4): 1014–1019. Дои:10.1016 / j.bbrc.2008.01.163. PMID 18282467.
- ^ Йи М., Шульц Д.Е., Лимон С.М. (июль 2000 г.). «Функциональное значение взаимодействия РНК вируса гепатита А с глицеральдегид-3-фосфатдегидрогеназой (GAPDH): противоположные эффекты GAPDH и белка, связывающего полипиримидиновый тракт, на функцию внутреннего сайта входа в рибосомы». Журнал вирусологии. 74 (14): 6459–6468. Дои:10.1128 / jvi.74.14.6459-6468.2000. ЧВК 112154. PMID 10864658.
- ^ Цзян Х, Канда Т., Ву С., Накамото С., Сайто К., Ширасава Х, Киёхара Т., Исии К., Вакита Т., Окамото Х., Йокосука О. (2014). «Подавление антигена La оказывает потенциальное противовирусное действие против вируса гепатита А». PLOS ONE. 9 (7): e101993. Дои:10.1371 / journal.pone.0101993. ЧВК 4084951. PMID 24999657.
- ^ Ян Л., Киёхара Т., Канда Т., Имазеки Ф., Фудзивара К., Гаусс-Мюллер В., Исии К., Вакита Т., Йокосука О. (сентябрь 2010 г.). «Ингибирующее действие на опосредованную HAV IRES трансляцию и репликацию комбинацией амантадина и интерферона-альфа». Журнал вирусологии. 7 (1): 212. Дои:10.1186 / 1743-422x-7-212. ЧВК 2940810. PMID 20815893.
- ^ Hellen CU, Sarnow P (июль 2001 г.). «Внутренние сайты входа в рибосомы в молекулах мРНК эукариот». Гены и развитие. 15 (13): 1593–1612. Дои:10.1101 / gad.891101. PMID 11445534.
