Гексахлорфосфазен - Hexachlorophosphazene - Wikipedia
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гексахлортрифосфазен | |
| Другие имена Фосфонитрилхлорид Гексахлорциклотрифосфазен Трифосфонитрилхлорид 2,2,4,4,6,6-гексахлор-2,2,4,4,6,6- гексагидро-1,3,5,2,4,6-триазатрифосфорин | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.012.160 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| N3Cl6п3 | |
| Молярная масса | 347,66 г / моль |
| Внешность | бесцветное твердое вещество |
| Плотность | 1,98 г / мл при 25 ° C |
| Температура плавления | От 112 до 115 ° C (от 234 до 239 ° F, от 385 до 388 K) |
| Точка кипения | разлагается |
| разлагается | |
| Растворимость в хлороуглеродах | растворимый |
| Структура | |
| 0 D | |
| Опасности | |
| Главный опасности | мягкий раздражитель |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Опасность |
| H314 | |
| P260, P264, P280, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P363, P405, P501 | |
| точка возгорания | Негорючий |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Гексахлорфосфазен является неорганическое соединение с формулой (NPCl2)3. Молекула имеет циклический ненасыщенный каркас, состоящий из чередующихся фосфор и азот центры. Его классификация как фосфазен подчеркивает его связь с бензолом.[1] Его можно рассматривать как тример гипотетического соединения N≡PCl2.
Структура
Химикам давно известны кольца, содержащие только углерод или углерод и другие элементы, например бензол, пиридин, или же циклогексан. Родственные циклические соединения, лишенные углерода, также были изучены; гексахлортрифосфазен является одним из таких неорганических колец. Другие хорошо известные неорганические кольцевые системы включают: боразин, бициклический S4N4, а циклический силоксаны.
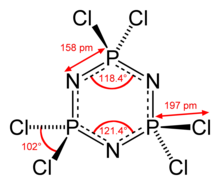
Молекула имеет P3N3 ядро с шестью эквивалентными связями P-N. В молекуле D3ч симметрия. Расстояния P-N составляют 157 м. Каждый фосфорный центр является тетраэдрическим с углом Cl-P-Cl 101 °.[2] P3N3 кольцо почти плоское в гексахлорфосфазене, но строго плоское в гексафторфосфазене.[3]
Склеивание
Ранние анализы
Циклофосфазены, такие как гексахлортрифосфазен, отличаются значительной стабильностью и равной длиной связи P-N, что подразумевает делокализацию и, возможно, даже ароматичность. Чтобы учесть эти особенности, в ранних моделях связывания использовалась делокализованная π-система, возникающая из перекрытия N 2п и P 3d орбитали.[3]

Современные склеивающие модели
Современные расчеты показывают, что P 3d вклад незначителен, что опровергает предыдущую гипотезу; вместо этого более общепринята модель с разделением зарядов.[1] Согласно этому описанию, связь P – N рассматривается как очень поляризованная (между условными P+ и н–, как показано справа), с достаточным ионным характером, чтобы составлять большую часть прочности связи.
Остальное (~ 15%) прочности связи можно отнести к отрицательная гиперконъюгация взаимодействие: N одинокие пары могут пожертвовать некоторую электронную плотность в π-акцептирующие σ * молекулярные орбитали на P.
Синтез
Первоначальный синтез включал реакцию пентахлорид фосфора и аммиак или хлорид аммония, давая смесь продуктов.[3] При проведении в горячих хлороуглеродных растворителях применяется следующая стехиометрия:
- NH4Cl + PCl5 → 1 / n (Cl2PN)п + HCl
куда п обычно может принимать значения п= 2 (димер тетрахлордифосфазен ), п= 3 (тример гексахлортрифосфазен), и п= 4 (тетрамер октахлортетрафосфазен ).[4]

Очистка сублимацией дает в основном тример и тетрамер, в то время как медленная сублимация в вакууме примерно при 60 ° C дает чистый тример, свободный от тетрамера. Условия реакции, такие как температура, также могут быть отрегулированы, чтобы максимизировать выход тримера за счет других возможных продуктов; тем не менее коммерческие образцы гексахлортрифосфазена обычно содержат заметные количества октахлортетрафосфазена, даже до 40%.[5]
Реакции
Замена на P
Гексахлорфосфазен легко реагирует с кислородом и азотом. нуклеофилы.[1][3] Обычно используются алкоксиды и амиды щелочных металлов. Восприимчивость связей P-Cl к замещению весьма различима.[6]

Полизамещение исходного фосфазена поднимает вопрос о региоселективность. Установлено, что доминирующими факторами, влияющими на это, являются: (а) стерические эффекты; и (b) способность неподеленной пары алкокси-кислорода к π-бэкдонату к атому Р, в котором произошло замещение, уменьшая электрофильность последнего и дезактивируя его в направлении дальнейшего замещения.[1] В сочетании эти факторы обычно приводят к сильному предпочтению 2,4 атаке монозамещенных промежуточных соединений 2,2 (обратите внимание, что нумерация положений кольца начинается с N). Эти промежуточные соединения продолжают образовывать 2,4,6-тризамещенные и 2,2,4,6-тетразамещенные промежуточные соединения до достижения гексазамещения.[1] Образующиеся гексалкоксифосфазены (особенно арилокси видов) ценятся за высокую термическую и химическую стабильность, а также за низкую температура стеклования, что подразумевает гибкость при низких температурах. Некоторые гексалкоксифосфазены нашли коммерческое применение в качестве огнестойких материалов и высокотемпературных смазок.[6]
Полимеризация: «Неорганический каучук».
Нагревание гексахлорфосфазена до прибл. 250 ° C вызывает полимеризацию. Конверсия - это разновидность полимеризация с раскрытием кольца. Продукт представляет собой линейный полимер (PNCl2)п, куда п ~ 15000. Тетрамер также полимеризуется таким образом, хотя и медленнее.[6]

Образующиеся неорганические хлорполимер является отправной точкой для широкого класса полимерных производных, известных под общим названием полифосфазены. Замена хлоридных групп другими нуклеофильными группами, особенно алкоксиды как изложено выше, дает множество охарактеризованных производных. Некоторые из этих полифосфазенов кажутся многообещающими для потенциальных коммерческих применений, таких как высокоэффективные эластомеры или термопласты с различными желаемые свойства.
Основность Льюиса
Азотные центры умеренно основные. Гексахлорфосфазен образует аддукт 1: 1 с трихлорид алюминия.[7]
Другие реакции
Тример также нашел применение в исследованиях, позволяя ароматизировать связь реакции между пиридин и либо N, N-диалкиланилины или индол, что приводит к 4,4'-замещенному фенилпиридин производные, предположительно проходящие через промежуточную соль пиридиниевой соли циклофосфазена.[5]
Соединение также можно использовать в качестве пептидное связывание реагент для синтеза олигопептиды в хлороформе, хотя для этого применения тетрамер октахлортетрафосфазен обычно оказывается более эффективным.[5]
Наконец, и тример, и тетрамер могут фотохимически реагируют при растворении в гексане, декалине, бензоле или толуоле, образуя прозрачные жидкости, идентифицированные как алкилзамещенные по P производные формы (NPCl2-ИксрИкс)п=3,4.[5] Такие реакции протекают при длительном UVC (ртутная дуга ) освещением, но циклофосфазеновые кольца не пострадали, что свидетельствует об их заметной химической стабильности. Действительно, твердые пленки тримера и тетрамера не претерпевают никаких химических изменений при таких условиях облучения, когда они не находятся в растворе.
дальнейшее чтение
- Открытие фосфазности: Liebig-Wöhler, Briefwechsel vol. 1, 63; Анна. Chem. (Либих), т. 11 (1834), 146.
- Первые сообщения об их полимеризации: H. N. Stokes (1895), О хлорнитридах фосфора. Американский химический журнал, т. 17, стр. 275.H. Н. Стокс (1896 г.), О триметафосфимовой кислоте и продуктах ее разложения. Американский химический журнал, т. 18 выпуск 8, с. 629.
- Allcock, Гарри R .; Ngo, Dennis C .; Парвез, Масуд; Уиттл, Роберт Р .; Бердсолл, Уильям Дж. (1991-03-01). «Синтезы и структуры циклических и короткоцепочечных линейных фосфазенов, содержащих 4-фенилфеноксильные боковые группы». Журнал Американского химического общества. 113 (7): 2628–2634. Дои:10.1021 / ja00007a041. ISSN 0002-7863.
- Е, Чэнфэн; Чжан, Зефу; Лю, Вэйминь (01.01.2002). «Новый синтез гексазамещенных циклотрифосфазенов». Синтетические коммуникации. 32 (2): 203–209. Дои:10.1081 / SCC-120002003. ISSN 0039-7911. S2CID 97319633.
Рекомендации
- ^ а б c d е Аллен, Кристофер В. (1991-03-01). «Регио- и стереохимический контроль в реакциях замещения циклофосфазенов». Химические обзоры. 91 (2): 119–135. Дои:10.1021 / cr00002a002. ISSN 0009-2665.
- ^ Бартлетт, Стюарт У .; Коулз, Саймон Дж .; Дэвис, Дэвид Б .; Херстхаус, Майкл Б.; i̇Bişogˇlu, Hanife; Килич, Адем; Шоу, Роберт А .; Юн, Илкер (2006). «Структурные исследования фосфорно-азотных соединений. 7. Взаимосвязь между физическими свойствами, электронной плотностью, механизмами реакций и мотивами водородных связей производных N3P3Cl (6 - n) (NHBu t) n». Acta Crystallographica Раздел B Структурные науки. 62 (2): 321–329. Дои:10.1107 / S0108768106000851. PMID 16552166.
- ^ а б c d Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Холлеман, А. Ф .; Виберг, Э. "Неорганическая химия" Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5.
- ^ а б c d Оллкок, Х. Р. (1972). Фосфорно-азотные соединения; циклические, линейные и высокополимерные системы. Нью-Йорк: Academic Press. ISBN 978-0-323-14751-4. OCLC 838102247.
- ^ а б c Mark, J. E .; Allcock, H.R .; Уэст Р. «Неорганические полимеры» Прентис Холл, Энглвуд, Нью-Джерси: 1992. ISBN 0-13-465881-7.
- ^ Хестон, Эми Дж .; Панзнер, Мэтью Дж .; Янгс, Уайли Дж .; Тессье, Клэр А. (2005). «Аддукты кислоты Льюиса [PCl2N] 3». Неорганическая химия. 44 (19): 6518–6520. Дои:10.1021 / ic050974y. PMID 16156607.
