Внутримолекулярная доставка агликона - Intramolecular aglycon delivery
Внутримолекулярная доставка агликона синтетическая стратегия построения гликаны. Этот подход обычно используется для формирования сложных гликозидные связи.
Введение
Гликозилирование реакции - очень важные реакции в химия углеводов, что приводит к синтезу олигосахариды предпочтительно стереоселективным образом. Было показано, что стереоселективность этих реакций зависит как от природы, так и от конфигурации защитной группы у C-2 на гликозильный донор звенеть. В то время как 1,2-транс-гликозиды (например, α-маннозиды и β-глюкозиды) может быть легко синтезирован в присутствии участвующей группы (такой как OAc или NHAc) в положении C-2 в гликозильном донорном кольце, 1,2-СНГ-гликозиды приготовить сложнее. 1,2-СНГ-гликозиды с α-конфигурацией (например, глюкозиды или галактозиды) часто можно получить с использованием неучаствующей защитной группы (такой как Bn или All) на гидроксигруппе C-2. Однако, 1,2-СНГ-гликозиды с β-конфигурацией являются наиболее сложными для достижения и представляют наибольшую проблему в реакциях гликозилирования.

Один из самых последних подходов к подготовке 1,2-СНГ-β-гликозиды стереоспецифическим образом называется "Внутримолекулярная доставка агликона’, И на основе этого подхода были разработаны различные методы.[1]При таком подходе гликозильный акцептор присоединяется к C-2-O-защитной группе (X) на первой стадии. После активации гликозильный донор группы (Y) (обычно группы SR, OAc или Br) на следующем этапе связанный агликон улавливает развивающийся оксокарбениевый ион на C-1 и переносится с той же стороны, что и OH-2, стереоспецифически формируя гликозидную связь. Выход этой реакции падает по мере увеличения объема спирта.

Методы внутримолекулярной доставки агликона (IAD)
Углеродный модем
Кислотно-катализируемое связывание с енольными эфирами
В этом методе донор гликозила защищен в положении C-2 группой OAc. Защитная группа C-2-OAc превращается в енольный эфир посредством Реагент Теббе (Cp2Ti = CH2), а затем гликозильный акцептор привязан к енольный эфир в условиях кислотного катализатора с образованием смешанного ацеталя. На следующем этапе β-маннозид образуется при активации аномерной уходящей группы (Y) с последующей обработкой.[2]

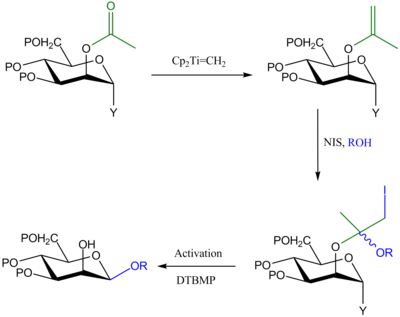
Присоединение йодония к енольным эфирам
Этот метод аналогичен предыдущему в том, что гликозильный донор защищен в C-2 группой OAc, которая превращается в енольный эфир посредством Реагент Теббе. Однако при таком подходе N-иодосукцинимид (NIS) используется для связывания гликозильного акцептора с енольным эфиром, и на второй стадии активация аномерной уходящей группы приводит к внутримолекулярной доставке агликона к C-1 и образованию 1,2-СНГ-гликозидный продукт.[3]
Присоединение йодония к проп-1-ениловым эфирам
Донор гликозила защищен по C-2 группой OAll. Затем аллильная группа изомеризуется в проп-1-ениловый эфир с использованием гидрида родия, полученного из Катализатор Уилкинсона ((PPh3)3RhCl) и бутиллитий (BuLi). Полученный эфир енола затем обрабатывают NIS и гликозильным акцептором с образованием смешанного ацетала. 1,2-СНГ (например, β-маннозил) продукт образуется на заключительной стадии посредством активации аномерной уходящей группы, доставки агликона из смешанного ацеталя и, наконец, гидролитической обработки для удаления остатков пропенилового эфира из O-2.[4]

Окислительная привязка к параграф-метоксибензил (PMB) эфиры
В этом методе донор гликозила защищен по C-2 с помощью параграф-метоксибензил (PMB) группа. Затем гликозильный акцептор связывается в бензильном положении защитной группы PMB в присутствии 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ). Затем активируется аномерная уходящая группа (Y), и образующийся оксокарбениевый ион захватывается связанным агликоновым спиртом (OR) с образованием 1,2-СНГ β-гликозидный продукт.[5]

Окислительное крепление на твердой основе к параграф-алкоксибензиловые эфиры
Это модификация метода окислительной привязки к параграф-метоксибензиловый эфир. Разница здесь в том, что параграф-алкоксибензильная группа присоединена к твердой подложке; β-маннозидный продукт высвобождается в фазу раствора на последней стадии, в то время как побочные продукты остаются прикрепленными к твердой фазе. Это облегчает очистку β-гликозида; он оформлен как почти эксклюзивный продукт.[6]

Силиконовый модем
Первым шагом в этом методе является формирование силиловый эфир у С-2 гидроксильной группы гликозильного донора при добавлении диметилдихлорсилан в присутствии сильного основания, такого как бутиллитий (BuLi); затем добавляется гликозильный акцептор с образованием смешанного силакеталя. Затем активация аномерной уходящей группы в присутствии затрудненного основания приводит к β-гликозиду.[7]
Модифицированный метод связывания кремния включает смешивание гликозильного донора с гликозильным акцептором и диметилдихлорсиланом в присутствии имидазол дать смешанный силакеталь в одной посуде. Затем активация связанного промежуточного продукта приводит к β-гликозидному продукту.[8]
Смотрите также
Рекомендации
- ^ Кампсти, И. Carbohydr. Res. 2008, 343, 1553–1573
- ^ Barresi, F .; Хиндсгаул, О. Варенье. Chem. Soc. 1991, 113, 9376–9377
- ^ Ennis, S.C .; Фэрбенкс, А. Дж .; Slinn, C.A .; Теннант-Эйлз, Р. Дж .; Йейтс, Х.С. Тетраэдр 2001, 57, 4221–4230
- ^ Сьюард, К. М. П .; Cumpstey, I .; Aloui, M .; Ennis, S.C .; Редгрейв, А. Дж .; Фэрбенкс, А. Дж. Chem. Commun. 2000, 1409–1410
- ^ Ито, Й .; Огава, Т. Энгью. Chem. Int. Эд. Англ. 1994, 33, 1765–1767
- ^ Ито, Й .; Огава, Т. Варенье. Chem. Soc. 1997, 119, 5562–5566
- ^ Аист, Г .; Ким, Г. Варенье. Chem. Soc. 1992, 114, 1087-1088
- ^ Аист, Г .; Ла Клер, Дж. Дж. Варенье. Chem. Soc. 1996, 118, 247–248
