К-казеин - K-casein
Κ-казеин, или же каппа казеин, это млекопитающее молоко белок участвует в нескольких важных физиологических процессах. в кишка, проглоченный белок расщепляется на нерастворимые пептид (пара-каппа-казеин) и растворимый гидрофильный гликопептид (казеиномакропептид). Казеиномакропептид отвечает за повышение эффективности пищеварения, предотвращение гиперчувствительности новорожденных к потребляемым белкам и ингибирование желудочных патогенов.[1]
Структура

Казеины семья фосфопротеины (αS1, αS2, β, κ), на долю которых приходится почти 80% белков коровьего молока.[3] и которые образуют растворимые агрегаты, известные как «мицеллы казеина», в которых молекулы κ-казеина стабилизируют структуру. Существует несколько моделей, объясняющих особую конформацию казеина в мицеллах.[4] Один из них предполагает, что мицеллярное ядро образовано несколькими субмицеллами, периферия которых состоит из микровышек κ-казеина.[5][6] Другая модель предполагает, что ядро образовано фибриллами, соединенными между собой казеином.[7] Наконец, самая последняя модель[8] предлагает двойное звено между казеинами для гелеобразования. Все три модели рассматривают мицеллы как коллоидные частицы, образованные агрегатами казеина, обернутыми в растворимые молекулы κ-казеина. Протеазы свертывания молока действуют на растворимую часть κ-казеина, создавая таким образом нестабильное мицеллярное состояние, которое приводит к образованию сгустка.[9]
Свертывание молока

Химозин (EC 3.4.23.4) является аспарагиновая протеаза что конкретно гидролизует пептидной связи в Phe105-Met106 κ-казеина и считается наиболее эффективной протеазой для сыроделие промышленность.[10] Однако существуют протеазы свертывания молока, способные расщеплять другие пептидные связи в цепи κ-казеина, такие как эндотиапепсин, продуцируемый Эндотия паразитическая.[11] Существует также несколько протеаз свертывания молока, которые, будучи способны расщеплять связь Phe105-Met106 в молекуле κ-казеина, также расщепляют другие пептидные связи в других казеинах, например, производимых Cynara cardunculus[6][12][13] или даже бычий химозин.[14] Это позволяет производить разные сыры с различными реологический и органолептические свойства.
Процесс свертывания молока состоит из трех основных фаз:[15]
- Ферментативная деградация κ-казеина.
- Мицеллярная флокуляция.
- Образование геля.
Каждый шаг следует за другим кинетический При этом лимитирующим этапом свертывания молока является скорость разложения κ-казеина. На кинетический паттерн второй стадии процесса свертывания молока влияет кооперативный характер мицеллярной флокуляции,[16][13] тогда как реологический Свойства образующегося геля зависят от типа действия протеаз, типа молока и характера протеолиза казеина.[13] На весь процесс влияет несколько различных факторов, таких как pH или температура.[12][9]
Обычный способ количественной оценки данного фермента свертывания молока[17] использует молоко в качестве субстрата и определяет время, прошедшее до появления молочных сгустков. Однако свертывание молока может происходить без участия ферментов из-за различий в физико-химических факторах, таких как низкий pH или высокая температура.[6][3][9] Следовательно, это может привести к запутанным и невоспроизводимым результатам, особенно когда ферменты имеют низкую активность. В то же время классический метод недостаточно специфичен с точки зрения установления точного начала гелеобразования молока, так что определение участвующих ферментных единиц становится трудным и неясным. Более того, хотя сообщалось, что гидролиз κ-казеина протекает типично Михаэлис-Ментен кинетика,[15] это трудно определить с помощью классического анализа свертывания молока.
Чтобы преодолеть это, было предложено несколько альтернативных методов, таких как определение диаметра ореола в желированном с агаром молоке,[17] колориметрическое измерение,[18] или определение скорости разложения казеина, ранее помеченного радиоактивным индикатором[19] или флуорохром сложный.[20] Все эти методы используют казеин в качестве субстрата для количественной оценки протеолитической активности или активности свертывания молока.
Анализ FTC-Κ-казеина
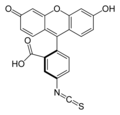
Κ-казеин с флюорохромом флуоресцеина изотиоцианат (FITC) с образованием тиокарбамоила флуоресцеина (FTC) производная. Этот субстрат используется для определения активности протеаз в отношении свертывания молока.[21]
Метод FTC-κ-казеина обеспечивает точное и точное определение разложения κ-казеинолиза, первого шага в процессе свертывания молока. Этот метод является результатом модификации метода, описанного S.S. Twining (1984). Основная модификация заключалась в замене ранее использовавшейся подложки (казеин ) -казеином, меченным флуорохромом изотиоцианатом флуоресцеина (FITC), с образованием производного тиокарбамоила флуоресцеина (FTC). Это изменение позволяет количественно определять расщепленные молекулы -казеина более точным и специфическим образом, обнаруживая только те ферменты, которые способны расщеплять такие молекулы. Однако метод, описанный Twining (1984), был разработан для обнаружения протеолитической активности значительно большего числа ферментов. FTC-κ-казеин позволяет обнаруживать различные типы протеаз на уровнях, когда свертывание молока еще не наблюдается, демонстрируя его более высокую чувствительность по сравнению с используемыми в настоящее время процедурами анализа. Таким образом, метод может найти применение в качестве индикатора во время очистки или характеристики нового молока - ферменты свертывания крови.
Примечания
- ^ «Казеин каппа (IPR000117)». ИнтерПро.
- ^ а б Кумосински, Браун и Фаррелл, 1993 г..
- ^ а б Люси, Джонсон и Хорн 2003.
- ^ Далглиш 1998.
- ^ Вальстра 1979.
- ^ а б c Люси 2002.
- ^ Холт 1992.
- ^ Хорн 1998.
- ^ а б c Vasbinder et al. 2003 г..
- ^ Rao et al. 1998 г..
- ^ Drøhse & Foltmann 1989.
- ^ а б Esteves et al. 2003 г..
- ^ а б c Сильва и Мальката 2005.
- ^ Кобаяши 2004.
- ^ а б Карлсон, Хилл и Олсон, 1987a.
- ^ Карлсон, Хилл и Олсон, 1987b.
- ^ а б Poza et al. 2003 г..
- ^ Корпус 1947 года.
- ^ Кристен 1987.
- ^ Твининг 1984 г..
- ^ Ageitos et al. 2006 г..
Рекомендации
- Ageitos, J.M .; Vallejo, J.A .; Поза, М .; Вилла, T.G. (2006). «Анализ флуоресцеина, тиокарбамоил-каппа-казеина для специфического тестирования протеаз свертывания молока». Журнал молочной науки. 89 (10): 3770–7. Дои:10.3168 / jds.S0022-0302 (06) 72418-3. PMID 16960051.
- Карлсон, Альфред; Хилл, Чарльз Джи; Олсон, Норман Ф. (1987). «Кинетика коагуляции молока: I. Кинетика гидролиза каппа-казеина в присутствии дезактивации ферментов». Биотехнологии и биоинженерия. 29 (5): 582–9. Дои:10.1002 / бит. 260290507. PMID 18576489. S2CID 38359395.
- Карлсон, Альфред; Хилл, Чарльз Дж .; Олсон, Норман Ф. (1987). «Кинетика коагуляции молока: II. Кинетика вторичной фазы: флокуляция мицелл». Биотехнологии и биоинженерия. 29 (5): 590–600. Дои:10.1002 / бит. 260290508. PMID 18576490. S2CID 44397261.
- Кристен, Г.Л. (1987). «Быстрый метод измерения активности протеазы в молоке с использованием казеина с радиоактивной меткой». Журнал молочной науки. 70 (9): 1807–14. Дои:10.3168 / jds.S0022-0302 (87) 80218-7. PMID 3117854.
- Далглиш, Д. (1998). «Мицеллы казеина как коллоиды: структура поверхности и стабильность». Журнал молочной науки. 81 (11): 3013–8. Дои:10.3168 / jds.S0022-0302 (98) 75865-5.
- Drøhse, Helle B .; Фольтманн, Бент (1989). «Специфичность ферментов свертывания молока в отношении κ-казеина крупного рогатого скота». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 995 (3): 221–4. Дои:10.1016/0167-4838(89)90039-3. PMID 2495817.
- Esteves, C.L.C .; Lucey, J.A .; Wang, T .; Пирес, Э. (2003). «Влияние pH на гелеобразование гелей обезжиренного молока, изготовленных из растительных коагулянтов и химозина». Журнал молочной науки. 86 (8): 2558–67. Дои:10.3168 / jds.S0022-0302 (03) 73850-8. PMID 12939079.
- Холт, К. (1992). «Структура и стабильность мицелл бычьего казеина». In Anfinsen, C.B .; Richards, Frederic M .; Эдсалл, Джон Т .; и другие. (ред.). Достижения в химии белков, том 43. Успехи в химии белков. 43. С. 63–151. Дои:10.1016 / S0065-3233 (08) 60554-9. ISBN 978-0-12-034243-3. PMID 1442324.
- Хорн, Дэвид С. (1998). «Взаимодействие казеина: свет на черные ящики, структуру молочных продуктов». Международный молочный журнал. 8 (3): 171–7. Дои:10.1016 / S0958-6946 (98) 00040-5.
- Халл, M.E. (1947). «Исследования белков молока. II. Колориметрическое определение частичного гидролиза белков в молоке». Журнал молочной науки. 30 (11): 881–4. Дои:10.3168 / jds.S0022-0302 (47) 92412-0.
- Кобаяси, Хидеюки (2004). «Полипоропепсин». В Barrett, Alan J .; Весснер, Дж. Фред; Роулингс, Нил Д. (ред.). Справочник протеолитических ферментов. С. 111–5. Дои:10.1016 / B978-0-12-079611-3.50035-5. ISBN 978-0-12-079611-3.
- Кумосински, Т.Ф .; Brown, E.M .; Фаррелл, Х. (1993). «Трехмерное молекулярное моделирование казеинов крупного рогатого скота: усовершенствованная структура κ-казеина с минимальной энергией». Журнал молочной науки. 76 (9): 2507–20. Дои:10.3168 / jds.S0022-0302 (93) 77586-4. PMID 8227653.
- Люси, Дж. (2002). «Образование и физические свойства гелей молочного белка». Журнал молочной науки. 85 (2): 281–94. Дои:10.3168 / jds.S0022-0302 (02) 74078-2. PMID 11913691.
- Lucey, J.A .; Johnson, M.E .; Хорн, Д.С. (2003). «Приглашенный обзор: перспективы на основе реологии и текстурных свойств сыра». Журнал молочной науки. 86 (9): 2725–43. Дои:10.3168 / jds.S0022-0302 (03) 73869-7. PMID 14507008.
- Поза, М .; Sieiro, C .; Carreira, L .; Barros-Velázquez, J .; Вилла, Т. Г. (2003). «Производство и характеристика протеазы свертывания молока штамма Myxococcus xanthus 422». Журнал промышленной микробиологии и биотехнологии. 30 (12): 691–8. Дои:10.1007 / s10295-003-0100-у. PMID 14634834. S2CID 23067478.
- Rao, Mala B .; Tanksale, Aparna M .; Ghatge, Mohini S .; Дешпанде, Васанти В. (1998). «Молекулярные и биотехнологические аспекты микробных протеаз». Обзоры микробиологии и молекулярной биологии. 62 (3): 597–635. Дои:10.1128 / MMBR.62.3.597-635.1998. ЧВК 98927. PMID 9729602.
- Silva, S.V .; Malcata, F.X. (2005). «Частичная идентификация водорастворимых пептидов, выделяемых на ранних стадиях протеолиза в стерилизованных овечьих сыроподобных системах: влияние типа коагулянта и закваски». Журнал молочной науки. 88 (6): 1947–54. Дои:10.3168 / jds.S0022-0302 (05) 72870-8. PMID 15905424.
- Твининг, Салли С. (1984). «Анализ казеина, меченного флуоресцеином изотиоцианатом, на протеолитические ферменты». Аналитическая биохимия. 143 (1): 30–4. Дои:10.1016/0003-2697(84)90553-0. PMID 6442109.
- Vasbinder, A.J .; Rollema, H.S .; Bot, A .; де Крюиф, К. (2003). «Механизм гелеобразования молока под влиянием температуры и pH; изучен с использованием трансглутаминазных поперечно-связанных мицелл казеина». Журнал молочной науки. 86 (5): 1556–63. Дои:10.3168 / jds.S0022-0302 (03) 73741-2. PMID 12778566.
- Вальстра, Питер (1979). «Объем мицелл бычьего казеина и некоторые из его последствий». Журнал молочных исследований. 46 (2): 317–23. Дои:10.1017 / S0022029900017234. PMID 469060.
