Узловатый белок - Knotted protein

Связанные белки белки, основы которых запутываются в узел. Можно представить, как протягивают белковую цепь с обоих концов, как если бы тянули за нить с обоих концов. Когда связанный белок «вытягивается» с обоих концов, он не распутывается. Узловатые белки интересны тем, что они очень редки, а их механизмы и функции сворачивания недостаточно изучены. Хотя были проведены некоторые экспериментальные и теоретические исследования, которые подсказали некоторые ответы, систематических ответов на эти вопросы не найдено.
Хотя был разработан ряд вычислительных методов для обнаружения белковых узлов, до сих пор не существует полностью автоматических методов для обнаружения белковых узлов без необходимого ручного вмешательства из-за отсутствия остатков или разрывов цепи в рентгеновских структурах или нестандартных форматах PDB.
Большинство узлов, обнаруженных в белках, глубокие. трилистник (31) узлы. Фигура восемь узлов (41), трехвитковые узлы (52), и Стивидорные узлы (61) также были обнаружены.

Математическая интерпретация
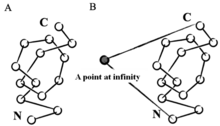
Математически узел определяется как подмножество трехмерного пространства, которое гомеоморфный в круг.[2] Согласно этому определению, узел имеет смысл только в замкнутой петле. Однако для создания искусственного замкнутого контура использовалось множество стратегий. Например, если мы выберем точку в пространстве на бесконечном расстоянии и соединим ее с концами N и C посредством виртуальной связи, белок можно рассматривать как замкнутый цикл или стохастические методы, которые создают случайные замыкания.
Глубина узла
Глубина белкового узла связана со способностью белка сопротивляться распусканию. Глубокий узел сохраняется, даже если удаление значительного количества остатков с любого конца не разрушает узел. Чем больше остатков можно удалить, не повредив узел, тем глубже узел.
Образование узлов
Учитывая, как можно создать узлы с помощью нити, сворачивание связанных белков должно включать сначала образование петли, а затем продевание одного конца через петлю. Это единственный топологический способ формирования узла-трилистника. Для более сложных узлов теоретически возможно, чтобы петля несколько раз закручивалась вокруг себя, что означает, что один конец цепочки оборачивается по крайней мере один раз, а затем происходит заправка нитей. В теоретическом исследовании также было замечено, что узел 6-1 может образоваться, если С-конец продет через петлю, а другая петля перевернется через первую петлю, а также если С-конец продет через обе петли, которые имеют предварительно перевернули друг друга.[3]
Были проведены экспериментальные исследования с участием YibK и YbeA, узловатые белки, содержащие трилистные узелки. Было установлено, что эти связанные белки сворачиваются медленно, и что образование узлов при сворачивании является этапом, ограничивающим скорость.[4] В другом экспериментальном исследовании белок длиной 91 остаток был присоединен к концам YibK и YbeA.[5] Присоединение белка к обоим концам дает глубокий узел с примерно 125 удаляемыми остатками на каждом конце, прежде чем узел будет разрушен. Тем не менее было замечено, что полученные белки могут складываться спонтанно. Было показано, что прикрепленные белки сворачиваются быстрее, чем сами YibK и YbeA, поэтому во время сворачивания ожидается, что они будут действовать как пробки на обоих концах YibK и YbeA. Было обнаружено, что прикрепление белка к N-концу не изменяет скорость сворачивания, но прикрепление к C-концу замедляет сворачивание вниз, предполагая, что событие зацепления происходит на C-конце. Шапероны, хотя и способствуют связыванию белков, не играют решающей роли в самовязывании белков.[5][6]
Сворачивание связанных белков можно объяснить взаимодействием возникающей цепи с рибосомой. В частности, сродство цепи к поверхности рибосомы может приводить к созданию петли, которая может быть продлена зарождающейся цепью. Было показано, что такой механизм правдоподобен для одного из известных белков с самыми глубокими узлами.[7]
Другие топологически сложные структуры в белках

Класс узловых белков содержит только структуры, у которых остов после замыкания образует узловую петлю. Однако некоторые белки содержат «внутренние узлы», называемые скользящими узлами, то есть несвязанные структуры, содержащие узловую субцепь.[8] Другая топологически сложная структура - это звено, образованное ковалентными петлями, замкнутыми дисульфидными мостиками.[9][10] В белках идентифицированы три типа дисульфидных связей: две версии Ссылка Хопфа (отличающиеся хиральностью) и один вариант Ссылка Соломона. Другой сложной структурой, возникающей при замыкании части цепи ковалентным мостиком, являются сложные белки лассо, для которых ковалентная петля продета цепью один или несколько раз.[11] Еще одна сложная структура, возникающая в результате существования дисульфидных мостиков, - это цистиновые узлы, для которой два дисульфидных мостика образуют замкнутую ковалентную петлю, которая проходит через третью цепь. Термин «узел» в названии мотива вводит в заблуждение, так как мотив не содержит замкнутого цикла с узлами. Более того, формирование цистиновых узлов в целом не отличается от сворачивания незаузленного белка.
Помимо закрытия только одной цепи, можно также выполнить процедуру закрытия цепи для всех цепей, присутствующих в кристаллической структуре. В некоторых случаях получаются нетривиально связанные структуры, называемые вероятностными связями.[12]
Можно также рассмотреть петли в белках, образованные частями основной цепи и дисульфидными мостиками, и взаимодействие через ионы. Такие петли также могут быть связаны из звеньев даже внутри структур с несвязанной основной цепью.[13][14]
Первые открытия
В 1994 году Марк Л. Мэнсфилд предположил, что в белках могут быть узлы.[15] Он поставил белкам безузловую оценку, построив сферу с центром в центре масс альфа-атомов углерода позвоночника с радиусом, вдвое превышающим расстояние между центром масс и кальфой, которая находится дальше всего от центра масс, и путем выборки двух случайных точек на поверхности сферы. Он соединил две точки, начертив геодезическую на поверхности сферы (дуги больших окружностей), а затем соединил каждый конец белковой цепи с одной из этих точек. Повторение этой процедуры 100 раз и подсчет количества раз, когда узел был разрушен в математическом смысле, дает счет без узла. Установлено, что карбоангидраза человека имеет низкий балл без узлов (22). При визуальном осмотре структуры было видно, что узел неглубокий, а это означает, что удаление нескольких остатков с любого конца разрушает узел.
В 2000 году Уильям Р. Тейлор идентифицировал глубокий узел в изомероредуктазе ацетогидроксикислот (PDB ID: 1YVE), используя алгоритм, который сглаживает белковые цепи и делает узлы более заметными.[16] Алгоритм сохраняет оба конца фиксированными и итеративно присваивает координатам каждого остатка среднее значение координат соседних остатков. Необходимо убедиться, что цепи не проходят друг через друга, иначе перекрестки и, следовательно, узел могут быть разрушены. Если узла нет, алгоритм в конечном итоге создает прямую линию, соединяющую оба конца.
Исследования о функции узла в белке
Некоторые предложения о функции узлов заключались в том, что они могут повышать термическую и кинетическую стабильность. Одно конкретное предположение заключалось в том, что для человеческой убиквитин гидролазы, которая содержит узел 5–2, присутствие узла могло бы препятствовать его втягиванию в протеасому.[17] Поскольку это деубиквитинирующий фермент, он часто обнаруживается рядом с белками, которые вскоре расщепляются протеасомой, и поэтому он сам сталкивается с опасностью разложения. Таким образом, наличие узла может служить пробкой, которая его предотвращает. Это понятие было дополнительно проанализировано на других белках, таких как YbeA и YibK, с помощью компьютерного моделирования.[18] Кажется, что узлы затягиваются, когда их втягивают в пору, и в зависимости от силы, с которой они втягиваются, они либо застревают и блокируют пору, вероятность чего увеличивается с увеличением силы тяги, либо в случае небольшая тянущая сила, они могут распутаться, когда один конец будет вытянут из узла. Для более глубоких узлов более вероятно, что поры будут заблокированы, так как слишком много остатков, которые необходимо протянуть через узел. В другом теоретическом исследовании[19] Было обнаружено, что смоделированный белок с узлами не был термически стабильным, но был кинетически стабильным. Также было показано, что узел в белках создает места на границе гидрофобных и гидрофильных участков цепи, характерные для активных центров.[20] Это может объяснить, почему более 80% связанных белков являются ферментами.[21]
Веб-серверы для экстраполяции связанных белков
Некоторые местные программы[22] и ряд веб-серверы доступны, обеспечивая удобные службы запросов для узловых структур и инструменты анализа для обнаружения белковых узлов.[14][21][23]
Смотрите также
использованная литература
- ^ Роберт, Шарейн. «KnotPlot: гипнагогическое программное обеспечение (версия 0.1)». Почти все изображения здесь были созданы с помощью KnotPlot, довольно сложной программы для визуализации и управления математическими узлами в трех и четырех измерениях..
- ^ Кромвель, П. Д. (2004). Узлы и ссылки. Кембридж: Издательство Кембриджского университета.
- ^ Bölinger, D .; Sułkowska, J.I .; Hsu, H-P .; Мирный, Л.А .; Кардар, М. (1 апреля 2010 г.). "Белковый узел стивидора". PLOS Comput Biol. 6 (4): e1000731. Bibcode:2010PLSCB ... 6E0731B. Дои:10.1371 / journal.pcbi.1000731. ЧВК 2848546. PMID 20369018.
- ^ Mallam, A.L .; Джексон, С. (2012). «Узелобразование во вновь транслируемых белках происходит спонтанно и ускоряется шаперонинами». Nat Chem Biol. 8 (2): 147–153. Дои:10.1038 / nchembio.742. PMID 22179065.
- ^ а б Lim, Nicole C.H .; Джексон, С. (30 января 2015 г.). «Механистические взгляды на сворачивание связанных белков in vitro и in vivo». J. Mol. Биол. 427 (2): 248–258. Дои:10.1016 / j.jmb.2014.09.007. PMID 25234087.
- ^ Чжао, Яни; Домбровский-Туманский, Павел; Невечерзал, Шимон; Сулковска, Джоанна И. (2018-03-16). «Эксклюзивные эффекты шаперонина на поведение белков с 52 узлами». PLOS вычислительная биология. 14 (3): e1005970. Bibcode:2018PLSCB..14E5970Z. Дои:10.1371 / journal.pcbi.1005970. ISSN 1553-7358. ЧВК 5874080. PMID 29547629.
- ^ Домбровский-Туманский, Павел; Пейко, Мацей; Невечерзал, Шимон; Стасяк, Анджей; Сулковская, Джоанна И. (12.10.2018). «Узеливание белка путем активного переплетения растущей полипептидной цепи, выходящей из канала выхода рибосомы». Журнал физической химии B. 122 (49): 11616–11625. Дои:10.1021 / acs.jpcb.8b07634. ISSN 1520-6106. PMID 30198720.
- ^ Кинг, Нил П .; Йейтс, Эрик О .; Йейтс, Тодд О. (октябрь 2007 г.). «Идентификация редких узлов скольжения в белках и их значение для стабильности и складывания». Журнал молекулярной биологии. 373 (1): 153–166. Дои:10.1016 / j.jmb.2007.07.042. ISSN 0022-2836. PMID 17764691.
- ^ Домбровский-Туманский, Павел; Сулковска, Джоанна И. (28 марта 2017 г.). «Топологические узлы и звенья в белках». Труды Национальной академии наук. 114 (13): 3415–3420. Дои:10.1073 / pnas.1615862114. ISSN 0027-8424. ЧВК 5380043. PMID 28280100.
- ^ Boutz, Daniel R .; Cascio, Duilio; Уайтлегдж, Джулиан; Перри, Л. Жанна; Йейтс, Тодд О. (май 2007 г.). «Открытие термофильного белкового комплекса, стабилизированного топологически связанными цепями». Журнал молекулярной биологии. 368 (5): 1332–1344. Дои:10.1016 / j.jmb.2007.02.078. ISSN 0022-2836. ЧВК 1955483. PMID 17395198.
- ^ Немиска, Ванда; Домбровский-Туманский, Павел; Кадлоф, Михал; Хаглунд, Эллинор; Сулковский, Петр; Сулковска, Джоанна И. (22 ноября 2016 г.). «Сложное лассо: новые запутанные мотивы в белках». Научные отчеты. 6 (1): 36895. Bibcode:2016НатСР ... 636895Н. Дои:10.1038 / srep36895. ISSN 2045-2322. ЧВК 5118788. PMID 27874096.
- ^ Домбровский-Туманский, Павел; Ярмолинская, Александра I .; Немиска, Ванда; Родон, Эрик Дж .; Millett, Kenneth C .; Сулковска, Джоанна И. (28.10.2016). «LinkProt: база данных, собирающая информацию о биологических связях». Исследования нуклеиновых кислот. 45 (D1): D243 – D249. Дои:10.1093 / нар / gkw976. ISSN 0305-1048. ЧВК 5210653. PMID 27794552.
- ^ Лян, Чэнчжи; Мислоу, Курт (ноябрь 1994). «Узлы в белках». Журнал Американского химического общества. 116 (24): 11189–11190. Дои:10.1021 / ja00103a057. ISSN 0002-7863.
- ^ а б Домбровский-Туманский, Павел; Рубах, Павел; Гундарулис, Димос; Дорье, Жюльен; Сулковский, Петр; Millett, Kenneth C .; Родон, Эрик Дж .; Стасяк, Анджей; Сулковская, Джоанна I. (2018). «KnotProt 2.0: база данных белков с узлами и другими запутанными структурами». Исследования нуклеиновых кислот. 47 (D1): D367 – D375. Дои:10.1093 / нар / gky1140. ЧВК 6323932. PMID 30508159.
- ^ Мэнсфилд, Марк Л. (1994). «Есть ли в белках узлы?». Nat. Struct. Биол. 1 (4): 213–214. Дои:10.1038 / nsb0494-213. PMID 7656045. S2CID 32625699.
- ^ Тейлор, Уильям Р. (2000). «Структура протеина с глубокими узлами и то, как она может складываться». Природа. 406 (6798): 916–919. Bibcode:2000Натура406..916Т. Дои:10.1038/35022623. PMID 10972297. S2CID 4420225.
- ^ Вирнау, Питер; Мирный, Л.А .; Кардар, М. (2006). «Сложные узлы в белках: функции и эволюция». PLOS Comput Biol. 2 (9): e122. Bibcode:2006PLSCB ... 2..122В. Дои:10.1371 / journal.pcbi.0020122. ЧВК 1570178. PMID 16978047.
- ^ Шимчак, П. (2014). «Транслокация узловых белков через поры». Европейский физический журнал ST. 223 (9): 1805–1812. Bibcode:2014EPJST.223.1805S. Дои:10.1140 / epjst / e2014-02227-6. S2CID 16379224.
- ^ Soler, M.A .; Nunes, A .; Файска, П. Ф. Н. (2014). «Эффекты узлового типа при сворачивании топологически сложных белков решетки». J. Chem. Phys. 141 (2): 025101. Bibcode:2014ЖЧФ.141б5101С. Дои:10.1063/1.4886401. PMID 25028045.
- ^ Домбровский-Туманский, Павел; Стасяк, Анджей; Сулковска, Джоанна И. (02.11.2016). «В поисках функциональных преимуществ узлов в белках». PLOS ONE. 11 (11): e0165986. Bibcode:2016PLoSO..1165986D. Дои:10.1371 / journal.pone.0165986. ISSN 1932-6203. ЧВК 5091781. PMID 27806097.
- ^ а б Ямроз, М; Niemyska W; Родон EJ; Стасяк А; Millett KC; Sułkowski P; Сулковская Ю.И. (2015). «KnotProt: база данных белков с узлами и сучками». Исследования нуклеиновых кислот. 43 (База данных): D306 – D314. Дои:10.1093 / нар / gku1059. ЧВК 4383900. PMID 25361973.
- ^ Ярмолинская, AI; Гамбин А; Сулковская Ю.И. (2019). «Knot_pull - пакет Python для разглаживания биополимера и обнаружения узлов». Биоинформатика. 36 (3): 953–955. Дои:10.1093 / биоинформатика / btz644. PMID 31504154.
- ^ Lai, Y.-L .; Yen, S.-C .; Ю., С.-Х .; Хван, Дж .-К. (7 мая 2007 г.). «pKNOT: веб-сервер Protein KNOT». Исследования нуклеиновых кислот. 35 (Веб-сервер): W420 – W424. Дои:10.1093 / нар / гкм304. ЧВК 1933195. PMID 17526524.
