N-Нитрозамиды - N-Nitrosamides - Wikipedia
| Базовая структура с синий подчеркнул функциональная группа | N-Нитрозамидные производные с синий подчеркнул функциональная группа |
 N-Нитрозамиды | 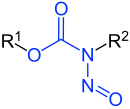 N-Нитрозокарбаматы
|
| р1-Р3 атомы водорода или органические остатки | |
Нитрозамиды находятся химические соединения которые содержат химическая структура р1C (= X) N (–R2) –N = O, т. Е. A нитрозо группа, связанная с азотом амид или похожие функциональная группа.[1] Конкретные классы включают N-нитрозамиды, N-нитрозомочевина, N-нитрозогуанидины, и N-нитрозокарбаматы. Нитрозамиды обычно химически реактивны, метаболически нестабильны,[1] и часто канцерогенный; однако, в отличие от N-нитрозамины, N-нитрозамиды обычно не загрязняющие вещества, обнаруженные в пище.[1]
Использовать
Различные хлорэтилнитрозомочевины (такие как N, N '-бис (2-хлорэтил) нитрозомочевина, BCNU) получили медицинское применение в области злокачественные опухоли.[2] Предполагается, что эффективность против раковых клеток основана на алкилируемости гуаниновых цитозиновых центров в последовательностях генетического материала, особенно онкогены.[2]
Синтез
N-Нитрозамиды можно получить, начиная с N-монозамещенный карбоксамиды и нитрозильный катион (который возникает из-за катиона азота в присутствии сильных кислот из азотистая кислота ), здесь на примере N-метилацетамид (1).[3][4] Карбоксамид реагирует нуклеофильной атакой на нитрозильный катион. После отрыва протона N-нитрозамид (2) образуется из образующегося катиона:

Токсичность
В генотоксический эффект из N-нитрозосоединения можно отнести к образованию реактивных электрофильные виды в метаболизм.[5] Спонтанный разложение из N-нитрозомочевины в водной среде метаболизма, например 1-метилнитрозомочевины (3), производит диазоний или ионы карбения соответственно.[5] Разложение происходит на изоциановая кислота и метилдиазогидроксид. В результате перегруппировки до иона диазония и последующего удаления азота образуется ион карбения (4), которые могут алкилировать нуклеофильные пересечения ДНК.[5]

В организме происходит разложение N-нитрозомочевины с более высокой степенью замещения могут протекать. Альтернативно возможное образование ионов диазония и карбения происходит через ферментативную реакцию нитрозаминов.[5]
Типичные сопутствующие симптомы во время лечения рака через N-нитрозомочевины нарушают Костный мозг (повреждение компартмента стволовых клеток), лимфатической ткани и желудочно-кишечного тракта.[5]
Рекомендации
- ^ а б c Ханс Марквардт, Зигфрид Г. Шефер (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004 г., ISBN 3-8047-1777-2, С. 747.
- ^ а б Ханс Марквардт, Зигфрид Г. Шефер (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004 г., ISBN 3-8047-1777-2, С. 752–753.
- ^ Адальберт Воллраб: Organische Chemie. Eine Einführung für Lehramts- und Nebenfachstudenten. 4. Auflage, Springer-Verlag Berlin Heidelberg 2014, ISBN 978-3-642-45144-7, С. 898.
- ^ Хайнц Г.О. Беккер, Райнер Беккерт, Вернер Бергер, Гюнтер Домшке, Эгон Фанганель, Мехтильд Фишер, Фритьоф Гентц, Карл Гевальд, Райнер Глух, Вольф Д. Хабичер, Ханс-Йоахим Кнёлькер, Роланд Майер, Петер Метюль, Дельт Миль, Клаус Миль Герман Шмидт, Карл Шоллберг, Клаус Шветлик, Эрика Зайлер, Гюнтер Цеппенфельд: Органикум. 24. Auflage, Wiley-VCH Verlag GmbH & Co.KGaA, Weinheim 2015, ISBN 978-3-527-33968-6, С. 648.
- ^ а б c d е Ханс Марквардт, Зигфрид Г. Шефер (Hrsg.): Lehrbuch der Toxikologie. 2. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 2004 г., ISBN 3-8047-1777-2, С. 753–758.
внешняя ссылка
- «нитрозамид». Викисловарь. Получено 2017-08-28.


