Осмотическое давление - Osmotic pressure

Осмотическое давление это минимум давление который необходимо применить к решение чтобы предотвратить приток его чистого растворитель через полупроницаемая мембрана.[1]Он также определяется как мера тенденции раствора впитывать чистый растворитель за счет осмос. Возможное осмотическое давление это максимальное осмотическое давление, которое могло бы развиться в растворе, если бы он был отделен от чистого растворителя полупроницаемой мембраной.
Осмос возникает, когда два раствора, содержащие разные концентрации растворенное вещество разделены селективно проницаемой мембраной. Растворитель молекулы проходят предпочтительно через мембрану из раствора с низкой концентрацией в раствор с более высокой концентрацией растворенного вещества. Перенос молекул растворителя будет продолжаться до достижения равновесия.[1][2]
Теория и измерения

Якобус ван 'т Хофф обнаружили количественную зависимость между осмотическим давлением и концентрацией растворенного вещества, выраженную в следующем уравнении:
куда осмотическое давление, я безразмерный индекс Ван 'т Гоффа, c это молярная концентрация растворенного вещества, R - постоянная идеального газа, и Т это температура в кельвины. Эта формула применяется, когда концентрация растворенного вещества достаточно низка, чтобы раствор можно было рассматривать как идеальное решение. Пропорциональность концентрации означает, что осмотическое давление коллигативная собственность. Обратите внимание на сходство этой формулы с закон идеального газа в виде где n - общее количество молей молекул газа в объеме V, и п/V - молярная концентрация молекул газа. Хармон Нортроп Морс и Фрейзер показали, что уравнение применяется к более концентрированным растворам, если единица измерения концентрации молярный скорее, чем коренной зуб;[3] поэтому, когда используется молярность, это уравнение было названо Уравнение Морса.
Для более концентрированных растворов уравнение Ван 'т Гоффа может быть расширено в виде степенного ряда по концентрации растворенного вещества: c. В первом приближении
куда - идеальное давление, A - эмпирический параметр. Значение параметра A (и параметров из более высоких приближений) можно использовать для вычисления Параметры Питцера. Эмпирические параметры используются для количественной оценки поведения растворов ионных и неионных растворенных веществ, которые не являются идеальные решения в термодинамическом смысле.
В Клетка Пфеффера был разработан для измерения осмотического давления.
Приложения
Измерение осмотического давления может использоваться для определения молекулярная масса.
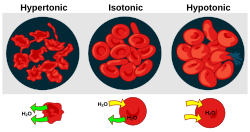
Осмотическое давление - важный фактор, влияющий на клетки. Осморегуляция это гомеостаз механизм организма для достижения баланса осмотического давления.
- Гипертонус наличие раствора, заставляющего клетки сокращаться.
- Гипотоничность наличие раствора, вызывающего набухание клеток.
- Изотоничность - это наличие раствора, не вызывающего изменения объема ячейки.
Когда биологический клетка находится в гипотонической среде, внутри клетки накапливается вода, вода течет через клеточная мембрана в клетку, заставляя ее расширяться. В клетки растений, то клеточная стенка ограничивает расширение, в результате чего давление на стенку ячейки изнутри называется тургорное давление. Тургорное давление позволяет травянистые растения стоять прямо. Это также определяющий фактор того, как растения регулируют апертуру своих устьица. В клетках животных чрезмерное осмотическое давление может привести к цитолиз.
Осмотическое давление - основа фильтрации ("обратный осмос "), процесс, обычно используемый в очистка воды. Очищаемая вода помещается в камеру и подвергается давлению, превышающему осмотическое давление, оказываемое водой и растворенными в ней веществами. Часть камеры открывается для дифференциально проницаемой мембраны, которая пропускает молекулы воды, но не растворенные частицы. Осмотическое давление океанской воды около 27 банкомат. Обратный осмос опресняет пресная вода из соленая вода океана.
Вывод формулы ван т Гоффа
Рассмотрим систему в точке, когда она достигла равновесия. Условием для этого является то, что химический потенциал из растворитель (так как только он может свободно течь к равновесию) с обеих сторон мембраны одинаковы. Отсек, содержащий чистый растворитель, имеет химический потенциал , куда это давление. С другой стороны, в отсеке, содержащем растворенное вещество, химический потенциал растворителя зависит от мольная доля растворителя, . Кроме того, в этом отсеке может быть разное давление, . Поэтому мы можем записать химический потенциал растворителя как . Если мы напишем , поэтому баланс химического потенциала равен:
- .
Здесь разница в давлении двух отсеков определяется как осмотическое давление, оказываемое растворенными веществами. Удерживая давление, добавление растворенного вещества снижает химический потенциал ( энтропийный эффект ). Таким образом, давление раствора необходимо увеличить, чтобы компенсировать потерю химического потенциала.
Чтобы найти , осмотическое давление, мы рассматриваем равновесие между раствором, содержащим растворенное вещество, и чистой водой.
- .
Мы можем записать левую часть как:
- ,
куда это коэффициент активности растворителя. Продукт также известен как активность растворителя, которая для воды - это активность воды. . Добавка к давлению выражается выражением для энергии расширения:
- ,
куда - молярный объем (м³ / моль). Подставляя приведенное выше выражение в уравнение химического потенциала для всей системы и перестраивая его, мы получим:
- .
Если жидкость несжимаемая, молярный объем постоянен, , а интеграл принимает вид . Таким образом, мы получаем
- .
Коэффициент активности является функцией концентрации и температуры, но в случае разбавленных смесей он часто очень близок к 1,0, поэтому
- .
Мольная доля растворенного вещества, , является , так можно заменить на , который, когда мала, может быть аппроксимирована .
- .
Мольная доля является . Когда маленький, он может быть приблизительно равен , Также молярный объем, , можно записать как объем на моль, . Их объединение дает следующее.
- .
Для водных растворов солей необходимо учитывать ионизацию. Например, 1 моль NaCl ионизируется до 2 моль ионов.
Смотрите также
Рекомендации
- ^ а б Воет, Дональд; Джудит Адил; Шарлотта В. Пратт (2001). Основы биохимии (Ред. Ред.). Нью-Йорк: Вили. п. 30. ISBN 978-0-471-41759-0.
- ^ Аткинс, Питер У .; де Паула, Хулио (2010). «Раздел 5.5 (е)». Физическая химия (9-е изд.). Oxford University Press. ISBN 978-0-19-954337-3.
- ^ Льюис, Гилберт Ньютон (1908-05-01). «Осмотическое давление концентрированных растворов и законы идеального раствора». Журнал Американского химического общества. 30 (5): 668–683. Дои:10.1021 / ja01947a002. ISSN 0002-7863.



































