Пероксимонофосфорная кислота - Peroxymonophosphoric acid
 | |
| Имена | |
|---|---|
| Название ИЮПАК пероксифосфорная кислота | |
| Систематическое название ИЮПАК (диоксиданидо) дигидроксидооксидофосфор | |
Другие имена
| |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Характеристики | |
| ЧАС3PO5 | |
| Молярная масса | 114,00 г / моль |
| Внешность | бесцветная жидкость |
| Растворимость | растворим в ацетонитрил, диоксан |
| Родственные соединения | |
Родственные соединения | пероксидифосфорная кислота; фосфорная кислота |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пероксимонофосфорная кислота (ЧАС
3PO
5) является оксикислота из фосфор. Его соли называются пероксимонофосфатами. Это одна из двух известных пероксифосфорных кислот, наряду с пероксидифосфорная кислота.
История
Обе пероксифосфорные кислоты были впервые синтезированы и охарактеризованы в 1910 году Юлиусом Шмидлином и Полем Массини посредством реакции между пятиокись фосфора и высококонцентрированный водный раствор пероксид водорода.[1] Однако эта реакция протекает очень бурно и ее трудно контролировать. Помимо пятиокиси фосфора, синтезируется из метафосфорная кислота и дифосфорная кислота также сообщалось.
Менее эффективный метод получения пероксифосфорной кислоты путем введения инертного растворителя. ацетонитрил был описан Герритом Тоеннисом в 1937 году. Было показано, что этот метод не подходит для диэтиловый эфир или же изоамиловый спирт.[2]
Подготовка
Наиболее широко используемый метод получения - гидролиз калия пероксидифосфата лития в сильной кислоте, такой как хлорная кислота.[3] Пероксидифосфатные соли могут быть получены электролизом их соответствующих фосфатных солей.[4]
Его можно получить в результате реакции между пентоксидом фосфора и высококонцентрированной перекисью водорода в инертном растворителе, таком как ацетонитрил или четыреххлористый углерод.[3]
Его также получают в виде смеси с пероксидифосфорной кислотой при фосфорная кислота лечится с фтор.[4] Компаунд не является коммерчески доступным и должен быть приготовлен по мере необходимости.
Характеристики

Пероксимонофосфорная кислота - бесцветная вязкая жидкость. Он стабилизирован внутримолекулярной водородной связью.[5] Соединение представляет собой трипротонную кислоту с константами кислотной диссоциации pK.а1 = 1,1, pKа2 = 5,5 и pKа3 = 12,8. В водных растворах медленно гидролизуется до перекиси водорода и фосфорной кислоты.[6]
При избытке воды гидролиз можно рассматривать как псевдопервый порядок. Период полураспада для этого разложения зависит от pH и температуры и составляет около 31 часа при 35 ° C и 2,5 часа при 61 ° C.[6] Раствор в ацетонитриле также медленно разлагается, теряя 30% активного кислорода после 26 дней хранения при 5 ° C.[5] Относительно стабильные соли можно получить нейтрализация с базами, например с гидроксид калия дать гигроскопичный дигидрогенпероксимонофосфат калия KH2PO5.[4]
Использует
Пероксимонофосфорная кислота используется в органическом синтезе как электрофильный реагент для окисления алкены, алкины, ароматические соединения и амины. Из-за сильнокислой природы только относительно кислотоустойчивые эпоксиды могут быть получены из алкенов, например транс-стильбена оксид из транс-стильбен. Менее стабильные эпоксиды расщепляются или реагируют дальше; циклогексен, стирол или же α-метилстирол не дают выделяемых эпоксидов. В случае стирола и α-метилстирола катализируемая кислотой алкильная миграция вместо этого приводит к основным продуктам фенилуксусная кислота и 2-фенилпропионовая кислота соответственно.[7]
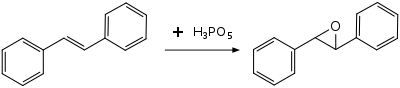
Окисление дифенилацетилен при комнатной температуре дает бензил, предположительно через оксирен средний.[8]
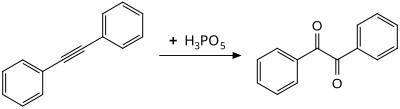
Пероксимонофосфорная кислота - эффективный реагент для гидроксилирования ароматических колец. Преобразование мезитилен к мезитол достигается при комнатной температуре менее чем за четыре часа.[9]
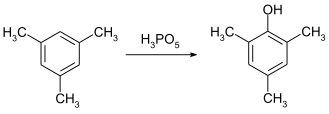
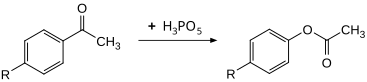
Соединение можно использовать как эффективный окислитель для Окисление Байера-Виллигера. Заменен ацетофеноны может быть превращен в соответствующие фенилацетаты при 30 ° C с высокими выходами. Скорость примерно в 100 раз выше по сравнению с использованием пероксибензойная кислота.[10]
Третичные ароматические амины, такие как диметиланилин окисляются до соответствующих оксид амина.[11]

Окисление THF с пероксимонофосфорной кислотой дает γ-бутиролактон.[5]
Рекомендации
- ^ Шмидлин, Юлий; Массини, Пол (1910). "Phosphormonopersäure und Überphosphorsäure". Бер. Dtsch. Chem. Ges. 43 (1): 1162–1171. Дои:10.1002 / cber.191004301195.
- ^ Toennies, Геррит (1937). «Новый метод приготовления пермонофосфорной кислоты». Варенье. Chem. Soc. 59 (3): 555–557. Дои:10.1021 / ja01282a037.
- ^ а б Чжу, Тянь; Чанг, Хоу-Минь; Кадия, Джон Ф. (2003). «Новый метод получения пероксимонофосфорной кислоты». Может. J. Chem. 81 (2): 156–160. Дои:10.1139 / v03-010.
- ^ а б c Харальд, Якоб; Лейнингер, Стефан; Леманн, Томас; Якоби, Сильвия; Gutewort, Свен (2007). «Пероксосоединения неорганические». Энциклопедия промышленной химии Ульмана. Wiley ‐ VCH Verlag. С. 310–311. Дои:10.1002 / 14356007.a19_177.pub2. ISBN 9783527306732.
- ^ а б c Рао, А. Сомасекар; Мохан, Х. Рама (2001). «Монопероксифосфорная кислота». Энциклопедия реагентов для органического синтеза. Джон Вили и сыновья. Дои:10.1002 / 047084289X.rm287m. ISBN 9780470842898.
- ^ а б Батталья, Чарльз Дж .; Эдвардс, Джон О. (1965). «Константы диссоциации и кинетика гидролиза пероксимонофосфорной кислоты». Неорг. Chem. 4 (4): 552–558. Дои:10.1021 / ic50026a024.
- ^ Огата, Йоширо; Томизава, Кохтаро; Икеда, Тошиюки (1979). «Окисление транс-Стилбена пероксимонофосфорной кислотой». J. Org. Chem. 44 (14): 2362–2364. Дои:10.1021 / jo01328a006.
- ^ Огата, Йоширо; Саваки, Ясухико; Оно, Такаши (1982). «Механизм окисления фенилацетиленов пероксимонофосфорной кислотой. Оксирен как промежуточный продукт, не превращающийся в кетокарбен». Варенье. Chem. Soc. 104 (1): 216–219. Дои:10.1021 / ja00365a039.
- ^ Огата, Йоширо; Саваки, Ясухико; Томидзава, Кохтаро; Оно, Такаши (1981). «Ароматическое гидроксилирование пероксимонофосфорной кислотой». Тетраэдр. 37 (8): 1485–1486. Дои:10.1016 / S0040-4020 (01) 92087-3.
- ^ Огата, Йоширо; Томизава, Кохтаро; Икеда, Тошиюки (1978). «Кинетика реакции Байера-Виллигера ацетофенонов с пермонофосфорной кислотой». J. Org. Chem. 43 (12): 2417–2419. Дои:10.1021 / jo00406a025.
- ^ Огата, Йоширо; Томизава, Кохтаро; Морикава, Такаши (1979). «Кинетика окисления ароматических аминов пероксимонофосфорной кислотой». J. Org. Chem. 44 (3): 352–355. Дои:10.1021 / jo01317a009.




![{ displaystyle { ce {P2O8 ^ {4} - + H2O -> [ наверху { ce {HClO_ {4}}}] {H3PO5} + H3PO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe1c24231286229cb984cf20478d4a27ace42b03)

