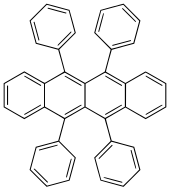
Рубрен - Rubrene
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 5,6,11,12-тетрафенилтетрацен | |
| Другие имена 5,6,11,12-тетрафенилнафтацен, рубрен | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.007.494 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
| C42ЧАС28 | |
| Молярная масса | 532,7 г / моль |
| Температура плавления | 315 ° С (599 ° F, 588 К) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Рубрен (5,6,11,12-тетрафенилтетрацен) красный полициклический ароматический углеводород. Рубрен используется как сенсибилизатор в хемолюминесценция и как источник желтого света в световые палочки.
Электронные свойства
Как органический полупроводник, основное применение рубрена - органические светодиоды (OLED) и органические полевые транзисторы, которые являются основными элементами гибких дисплеев. Монокристалл транзисторы может быть приготовлен из кристаллического рубрена, выращенного в модифицированной зонной печи при градиенте температуры. Этот метод, известный как физический перенос пара, был внедрен в 1998 году.[1][2]
Рубрен является органическим полупроводником с самой высокой подвижностью носителей, достигающей 40 см.2/ (В · с) для дыры. Это значение было измерено в OFET, полученных путем отслаивания тонкого слоя монокристаллического рубрена и переноса на Si / SiO.2 субстрат.[3]
Кристальная структура
Несколько полиморфы рубрена известны. Кристаллы, выращенные из пара в вакууме, можно моноклинический,[4] триклинический,[5] и ромбический мотивы.[6] Орторомбические кристаллы (космическая группа Bбац) получают в закрытой системе в двухзонной печи при атмосферном давлении.[7]
Синтез
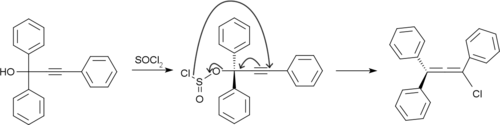
Рубрен получают обработкой 1,1,3-трифенилпроп-2-ин-1-ола тионилхлорид.[8]
Образующийся хлораллен подвергается димеризация и дегидрохлорирование дать рубрен.[9]
Редокс-свойства
Рубрен, как и другие полициклические ароматические молекулы, в растворе претерпевает окислительно-восстановительные реакции. Он окисляется и восстанавливается обратимо при 0,95 В и -1,37 В соответственно против SCE. Когда катион и анион совместно генерируются в электрохимической ячейке, они могут сочетаться с аннигиляцией своих зарядов, но при этом образуется возбужденная молекула рубрена, которая излучает на длине волны 540 нм. Это явление называется электрохемилюминесценция.[10]
Рекомендации
- ^ Laudise, R.A; Kloc, Ch; Симпкинс, П.Г .; Зигрист, Т. (1998). «Физический рост органических полупроводников из паров». Журнал роста кристаллов. 187 (3–4): 449. Bibcode:1998JCrGr.187..449L. Дои:10.1016 / S0022-0248 (98) 00034-7.
- ^ Юрческу, Оана Диана (2006) «Низкотемпературная кристаллическая структура монокристаллов рубрена, выращенных паропереносом» в Молекулярные органические полупроводники для электронных устройств, Кандидатская диссертация Rijksuniversiteit Groningen.
- ^ Хасегава, Тацуо и Такея, июн (2009). «Органические полевые транзисторы на монокристаллах». Sci. Technol. Adv. Матер. 10 (2): 024314. Bibcode:2009STAdM..10b4314H. Дои:10.1088/1468-6996/10/2/024314. ЧВК 5090444. PMID 27877287.CS1 maint: несколько имен: список авторов (связь)
- ^ Тейлор, У. Х. (1936). «Рентгеновские измерения дифлавилена, рубрена и родственных соединений». Zeitschrift für Kristallographie. 93: 151. Дои:10.1524 / zkri.1936.93.1.151.
- ^ Акопян, С. А .; Авоян Р.Л., Стручков Ю. T. Z. Strukt. Хим. 3, 602 (1962)
- ^ Хенн Д. Э. и Уильямс В. Г. (1971). «Кристаллографические данные для ромбической формы рубрена». J. Appl. Кристалл. 4 (3): 256. Дои:10.1107 / S0021889871006812.
- ^ Булгаровская, И .; Возженников, В .; Александров, С .; Бельский, В. (1983). Латв. ПСР Зинат. Акад. Вестис, Физ. Тех. Зинат. Сер. 4. 53: 115
- ^ Фернисс, Б. Учебник практической органической химии Фогеля (5-е изд.). С. 840–841.
- ^ Фернисс, Б. Учебник практической органической химии Фогеля (5-е изд.). С. 844–845.
- ^ Рихтер, М. М. (2004). «Электрохемилюминесценция (ЭХЛ)». Химические обзоры. 104 (6): 3003–36. Дои:10.1021 / cr020373d. PMID 15186186.