Стереохимия кетонизации енолов и енолятов - Stereochemistry of ketonization of enols and enolates - Wikipedia
в стереохимия кетонизации енолов и енолятов, представлена теория, объясняющая диастереоселективность[1] наблюдается при преобразовании некоторых Enols и енолирует в соответствующий кетон.
Вступление
Кетоны и их соответствующие Enols находятся изомеры, названный таутомеры. Они легко трансформируются. Но простые енолы обычно нестабильны и обладают значительно большей энергией, чем соответствующие кетоны. Тем не менее, очень большое количество органические реакции продолжаются через енольные промежуточные соединения. Таким образом, поведение енолов имеет решающее значение для понимания множества органических реакций.
Многие из этих енолов, образующиеся в органической реакции, априори, может вести вперед и позволить себе два диастереомеры по кетонизации. Если кто-то знает стереохимия кетонизации этих енольных промежуточных продуктов, то можно предсказать стереохимию бесчисленных органические реакции.
Предложен в 1955 г.[2] что кинетический протонирование энольных видов протекает с ранним переходное состояние с альфа-углерод быть близко к sp2 гибридизированный. Донор протонов избирательно приближается к менее затрудненным лицо енолята, что приводит к менее стабильному из двух диастереомеров. Реакции, контролируемые таким образом, включают:
- (а) декарбоксилирование из малоновые кислоты
- (б) декарбоксилирование бета-кетокислоты
- (c) Майкл дополнение из нуклеофилы к ненасыщенным карбонил соединения
- (г) Сокращение березы из Enones
- (д) депротонирование - протонирование карбонильных соединений
- (е) дегалогенирование альфа-галокетоны
- (е) Реакция Норриша типа II
- и многое другое.[2][3][4][5][6][7][8][9]
Кинетический или термодинамический контроль
Протонирование с менее затрудненной поверхности енола приводит к менее стабильной из двух, априори, диастереомеры. В этом примере[6] Есть две разные реакции, которые дают енол в качестве промежуточного промежуточного продукта. Одним из них является обработка α-бромкетона разбавленным HI в ацетон. Второй - реакция енолацетата с метиллитий. Первая из двух реакций является примером микроскопическая обратимость. Это обратное бромирование кетона, реакция, как хорошо известно, протекает через енол в качестве промежуточного продукта. Это пример с крайней стереоселективностью из-за серьезных стерических затруднений этано-мостика.
![Пример стереохимии кинетического протонирования енола [6]](http://upload.wikimedia.org/wikipedia/commons/0/05/LinusLinder.gif)
С кислотный катализатор а также с основным катализатором, таким как этоксид натрия а термодинамическое равновесие Достигнут. Образовавшийся диастереомер теперь имеет ацетильную группу экваториальный.
Рисунок 2. Уравновешивание диастереомеров с помощью общего енола.

Необычный случай фенилпиридиленола
На рисунке 3 показаны результаты кетонизации двух диастереомеров фенил-пиридила. В экзопиридильном изомере слева обычный контроль стерических препятствий блокирует протонирование сверху. То есть фенильная группа расположена непосредственно над енольным альфа-углеродом, и протонирование должно происходить снизу. Напротив, в случае эндопиридильного изомера справа основной пиридильный фрагмент оказывается способным сначала улавливать протон, а затем доставлять его к альфа-углероду с этой верхней, затрудненной стороны. Результаты внутримолекулярной доставки протонов противоположны обычной стереохимии.[9]
Рисунок 3. Два диастереомера фенилпиридиленола.

Типичный пример; енол, полученный из альфа-бромкетона
Рисунок 4. Пример кетонизации енола 4-фенил-1-бензоилциклогексана.
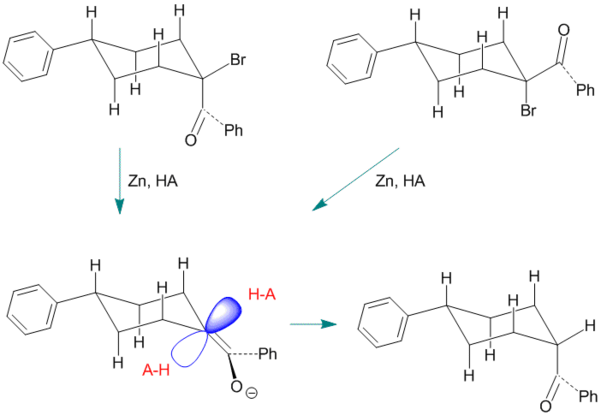
В этом примере промежуточное енольное соединение получают либо из цис-, либо из транс-стереоизомера 1-бром-1-бензоил-4-фенилциклогексана с использованием цинка в качестве реагента. Доступ эндопротона блокируется двумя аксиальными атомами водорода. Этот пример несколько более типичен, чем показанные ранее, поскольку стереоселективность[1] составляет всего от 60 до 70 процентов, благоприятствуя образованию (менее стабильного) цис-продукта.[10]
Рекомендации
- ^ а б (а) «Контроль перекрытия карбанионоидных реакций. I. Стереоселективность при щелочном эпоксидировании», Zimmerman, H.E .; Певица, Л .; Thyagarajan, B. S. J. Am. Chem. Soc., 1959, 81, 108-116. (B) Элиэль, Э., «Стереохимия углеродного соединения», McGraw-Hill, 1962, стр. 434-436.
- ^ а б «Стереохимия реакции кетонизации энолов», Циммерман, Х. J. Org. Chem., 1955, 20, 549-557.
- ^ (а) «Стереохимия реакции кетонизации энолов. III», Zimmerman, H.E .; Джалломбардо, Х. Дж. Варенье. Chem. Soc., 1956, 78, 6259-6263.
- ^ (б) «Стереохимия кетонизации. IV», Циммерман, Х. Э. Варенье. Chem. Soc., 1957 г., 79, 6554-6558.,
- ^ (c) «Стереохимия кетонизации. X. Энолы из альфа-галокислот», Zimmerman, H.E .; Катшолл, Т. Варенье. Chem. Soc., 1959, 81, 4305-4308.
- ^ а б c (d) «Повышенная эндо-экзо-селективность в стереохимии кетонизации энолов», Zimmerman, H.E .; Линдер, Л. В. J. Org. Chem., 1985, c48, 1637–1646.
- ^ (e) «Кинетическое протонирование енолов, енолатов и аналогов; стереохимия кетонизации», Циммерман, Х. Э. Счета Chem. Res., 1987, 20, 263-268.
- ^ (f) «Стереохимия таутомерии алленовых енолов»; Независимая генерация и реактивность »Zimmerman, H.E .; Пушечников, А., Eur J. Org. Chem., 2006, 15 3491-3497.
- ^ а б (g) «Меж- и внутримолекулярное стереоселективное протонирование енолов», Zimmerman, H.E .; Ван, П., J. Org. Chem. 2002, 69, 9216-9226.
- ^ «Стереохимия протонирования. XI», Zimmerman, H.E .; Mariano, P. S., J. Am. Chem. Soc., 1968, 90, 6091-6096.
